Академический Документы
Профессиональный Документы
Культура Документы
Formas Alotropicas
Загружено:
Luciana VargasОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Formas Alotropicas
Загружено:
Luciana VargasАвторское право:
Доступные форматы
UNIVERSIDAD POLITCNICA SALESIANA
Facultad de Ciencias Agropecuarias y Ambientales
Ingeniera En Biotecnologa De Los Recursos Naturales
NOMBRE: Vargas Luciana
NIVEL: Segundo
PARALELO: B
FECHA: 09/06/2014
MATERIA: Qumica Orgnica I
TEMA: Propiedades fsicas de los Alcanos
INTRODUCCIN:
El tomo de carbono en los alcanos tiene hibridacin sp3 y cada orbital se
dirige a los vrtices de un tetraedro. Cada orbital forma un enlace sigma con
cada H. La longitud del enlace C-H es 1.1 y el ngulo de 109.5.
Los alcanos lineales desde C5H12 hasta C17H36 son lquidos. Alcanos de
mayor nmero de carbonos son slidos a temperatura ambiente
(Fernndez, 2007).
Los alcanos son no polares, ya que estn formados slo por carbono e
hidrgeno. Debido a esto son insolubles en agua, son excelentes
disolventes de grasas y algunas ceras, y tienen puntos de ebullicin
bajos.
Los alcanos de bajo peso molecular (metano, etano, propano y butano)
son gases, pero a medida que el nmero de carbonos en la serie
homloga aumenta tambin lo hace el nmero de pequeos dipolos
instantneos porque crece el nmero de enlaces C-C y C-H y as las
molculas se mantienen ms fijas, y el compuesto se presenta a
temperatura ambiente como lquido (pentano, hexano, etc.) y los
alcanos con ms de 18 tomos de carbono son slidos a temperatura
ambiente.
De la misma manera al aumentar el tamao de la molcula se
incrementa el punto de fusin, ebullicin, as como la densidad.
Los alcanos tienen una baja densidad, la cual crece al aumentar el peso
molecular. Sin embargo, siempre su valor es menor que la densidad del
agua.
(Nicasio, 2013)
DESARROLLO:
1. Punto de Fusin:
El punto de fusin tambin aumenta con el tamao del alcano por la misma
razn. Los alcanos con nmero de carbonos impar se empaquetan peor en la
estructura cristalina y poseen puntos de ebullicin un poco menores de lo
esperado (Agustn).
Los alcanos normales son lquidos desde el pentano hasta el heptadecano
C17H36 (22.5C); comenzando en el octadecano C18H38 (28C) son slidos a
temperatura ambiente (Sabelotodo).
En su lugar podemos encontrar dos curvas que gradualmente convergen para
los altos pesos moleculares (figura 3). Una curva ms alta para los alcanos con
nmeros pares de carbonos, y una ms baja para nmeros nones de carbono
(Sabelotodo).
El hecho de que una cadena est ramificada tambin afecta al punto de fusin
del alcano. Un alcano ramificado generalmente funde a una temperatura ms
alta que la del n-alcano con el mismo nmero de tomos de carbono. La
ramificacin de un alcano da lugar a una estructura tridimensional slida ms
compacta en la que las molculas pueden empaquetarse ms fcilmente,
incrementando el punto de fusin (Agustn).
2. Punto de Ebullicin:
El punto de ebullicin aumenta con el tamao del alcano porque las fuerzas
intermoleculares atractivas (fuerzas de van der Waals y de London) son ms
efectivas cuanto mayor es la superficie de la molcula (Agustn).
Los alcanos normales son lquidos desde el pentano hasta el heptadecano
C17H36 (22.5C); comenzando en el octadecano C18H38 (28C) son slidos a
temperatura ambiente (Sabelotodo).
En el caso de los alcanos ramificados, stos presentan un punto de ebullicin
ms bajo que el de los lineales con el mismo nmero de tomos de carbono.
Esta diferencia se debe a que los alcanos ramificados son ms compactos, con
menos rea superficial para las interacciones por fuerzas de London (Agustn).
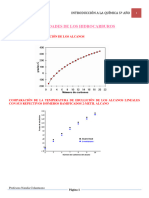
De tal modo, los tres ismeros del pentano, tienen un decrecimiento del punto
de ebullicin a medida que la estructura es ms ramificada, como se indica en
la figura 2, de forma que, incluso, el dimetilpropano es gaseoso a temperatura
ambiente. El patrn de decrecimiento del punto de ebullicin con el incremento
de la ramificacin de la estructura molecular es generalizado, as tenemos que;
mientras ms ramificada es la molcula, menor ser su punto de ebullicin
(Sabelotodo).
3. Densidad:
Los alcanos son apolares, por lo que se disuelven en disolventes orgnicos
apolares o dbilmente polares. Se dice que son hidrofbicos (repelen el agua)
ya que no se disuelven en agua (Agustn).
La razn de la baja polaridad se debe a los enlaces covalentes entre tomos
iguales como C-C o entre tomos cuyas electronegatividades difieren muy poco
como C-H. Adems los enlaces estn dirigidos de manera que las polaridades
dbiles que puedan existir se cancelen originando molculas no-polares. Por
ltimo, todos los alanos son menos densos que el agua (Jaramillo, 2001).
En lo que se refiere a la densidad, cuanto mayor es el nmero de carbonos las
fuerzas intermoleculares son mayores y la cohesin intermolecular aumenta,
resultando en un aumento de la proximidad molecular y, por tanto, de la
densidad. Ntese que en todos los casos es inferior a uno (Agustn).
(Jaramillo, 2001)
(Jaramillo, 2001)
BIFLIOGRAFIA:
Agustn, G. (s.f.). RECURSOS EDUCATIVOS DE QUMICA ORGNICA. Recuperado
el 9 de Junio de 2014, de RECURSOS EDUCATIVOS DE QUMICA
ORGNICA: www.liceoagb.es/quimiorg/docencia/textos/TEMA3.pdf
Fernndez, G. (3 de Octubre de 2007). Qumica Orgnica. Recuperado el 9 de
Junio de 2014, de Qumica Orgnica:
http://www.quimicaorganica.org/alcanos/66-propiedades-fisicas-dealcanos.html
Jaramillo, L. (2001). Qumica Orgnica General. Santiago de Cali: Universidad
del Valle: Facultad de Ciencias - Departamento de Qumica.
Nicasio, E. (10 de Abril de 2013). Blog de Qumica. Recuperado el 09 de Junio
de 2014, de Blog de Qumica:
http://edithnicasio108b4.blogspot.com/2013/04/propiedades-de-losalcanos-alquenos-y.html
Sabelotodo. (s.f.). Recuperado el 9 de Junio de 2014, de Sabelotodo:
http://www.sabelotodo.org/quimica/alcanos.html
Вам также может понравиться
- Hoja de Ruta N°9 Alcanos, Propiedades FísicasДокумент3 страницыHoja de Ruta N°9 Alcanos, Propiedades FísicasLususフリークОценок пока нет
- Propiedades Fisicas de Los AlcanosДокумент8 страницPropiedades Fisicas de Los AlcanosRudy Zenon Chaquilla100% (3)
- Los Alcanos Son Compuestos Con Hibridación sp3 en Todos Sus CarbonosДокумент3 страницыLos Alcanos Son Compuestos Con Hibridación sp3 en Todos Sus CarbonosLimberg OSINAGAОценок пока нет
- ALCANOSДокумент7 страницALCANOSMajo NavarroОценок пока нет
- Conformaciones de AlcanosДокумент35 страницConformaciones de Alcanosjbrenaore100% (3)
- Actividad N°5 Alcanos-Propiedades FísicasДокумент3 страницыActividad N°5 Alcanos-Propiedades Físicasmanuel FigueiraОценок пока нет
- Propiedades Físicas y Químicas de Los HidrocarburosДокумент8 страницPropiedades Físicas y Químicas de Los HidrocarburosAngeles GonzalezОценок пока нет
- Alcano, Alqueno, Alquino, Cicloalcano, Cicloalqueno, Cicloalquino y Todo Lo Referente, QUIMICA ORGANICAДокумент12 страницAlcano, Alqueno, Alquino, Cicloalcano, Cicloalqueno, Cicloalquino y Todo Lo Referente, QUIMICA ORGANICAKathryn FontaiinesОценок пока нет
- GresiaДокумент14 страницGresiaJhon Brayan Perez CruzattОценок пока нет
- ALCANOSДокумент7 страницALCANOSMitzy Felipe RodriguezОценок пока нет
- Grupos Funcionales de La Química OrgánicaДокумент9 страницGrupos Funcionales de La Química OrgánicaKratosGamer86Оценок пока нет
- Propiedades de Los HidrocarburosДокумент11 страницPropiedades de Los HidrocarburossofiasleonardaОценок пока нет
- Informe Hid Aromaticos y Pre InformeДокумент26 страницInforme Hid Aromaticos y Pre InformeLuz KpОценок пока нет
- AlquinosДокумент20 страницAlquinosAlexandra chata monsalve momsalveОценок пока нет
- Conformación Del EtanoДокумент26 страницConformación Del EtanoGonzalo AltamiranoОценок пока нет
- Alcanos, Alquenos y AlquinosДокумент24 страницыAlcanos, Alquenos y Alquinosluca_nfОценок пока нет
- Alquenos TesisДокумент8 страницAlquenos TesisCarlos LeonОценок пока нет
- Capitulo 3 Hidrocarburos AlifaticosДокумент46 страницCapitulo 3 Hidrocarburos AlifaticosEdwin Pomatanta PlasenciaОценок пока нет
- Informe Alifaticos Alan Ruben Chavez Quispe PDFДокумент19 страницInforme Alifaticos Alan Ruben Chavez Quispe PDFRhomi ChavezОценок пока нет
- Al CanosДокумент9 страницAl Canosgeysell arely0% (1)
- 228-PN2015 2 PDFДокумент21 страница228-PN2015 2 PDFjulianОценок пока нет
- Propiedades Fisicas de Los AlcanosДокумент7 страницPropiedades Fisicas de Los Alcanoscatherine garcia miranda100% (1)
- UNIDAD III Cap. 4 AlquinosДокумент4 страницыUNIDAD III Cap. 4 AlquinosAndrea Bravo MelgarОценок пока нет
- Obtencion de AlcanosДокумент13 страницObtencion de AlcanosMarolОценок пока нет
- Laboratorio 2 HidrocarburosДокумент18 страницLaboratorio 2 HidrocarburosNatRodriguezОценок пока нет
- Lab 2 AcetilenoДокумент12 страницLab 2 AcetilenoJhony PosadaОценок пока нет
- ALQUINOSДокумент4 страницыALQUINOSKatherine Laura CRОценок пока нет
- Practica 1Документ6 страницPractica 1LenarCanaviriОценок пока нет
- MARCO TEORICO AlquinosДокумент11 страницMARCO TEORICO AlquinosKathe AlexaОценок пока нет
- Alquenos y AlquinosДокумент5 страницAlquenos y AlquinosRichard RangelОценок пока нет
- Informe AlifaticosДокумент21 страницаInforme AlifaticosHeidy QuispeОценок пока нет
- Alcanos Alquenos AlquinosДокумент7 страницAlcanos Alquenos AlquinosJessy ParraОценок пока нет
- Introduccion Marco TeoricoДокумент7 страницIntroduccion Marco TeoricoJohnnathan Javier MedinaОценок пока нет
- Determinacion de AlcanosДокумент12 страницDeterminacion de AlcanosJuan ChaparroОценок пока нет
- Resumen AlcanosДокумент3 страницыResumen AlcanosVictor Hugo Lindarte Vega60% (5)
- Practica N 03Документ10 страницPractica N 03JIM MAICOL LUDEÑA PAÑAOОценок пока нет
- Los Puentes de HidrogenoДокумент9 страницLos Puentes de HidrogenoAdam ZaaОценок пока нет
- Informe 8 de Quimica IIДокумент34 страницыInforme 8 de Quimica IIFernando Callata CardenasОценок пока нет
- Guia de MetanoДокумент10 страницGuia de MetanoyennyОценок пока нет
- Alcanos y AlquenosДокумент41 страницаAlcanos y AlquenosWily Stoichkov Alvarado CuevaОценок пока нет
- Ácido Carboxilicos y AlcanosДокумент13 страницÁcido Carboxilicos y AlcanosLuz Belen GonzalezОценок пока нет
- Alquenos y AlquinosДокумент15 страницAlquenos y AlquinosAriadna Janeth Cruz CuandonОценок пока нет
- Informe 4. Quimica. Alquinos.. DiegoДокумент21 страницаInforme 4. Quimica. Alquinos.. Diegodiego silva moscol75% (4)
- ALCANOSДокумент7 страницALCANOSLuisa MoraОценок пока нет
- Alquenos y AlquinosДокумент3 страницыAlquenos y AlquinosMikaela VázquezОценок пока нет
- Punto de Ebullición de AlcanosДокумент9 страницPunto de Ebullición de AlcanosRodrigo Solano JustinianoОценок пока нет
- Presentacion - AlcanosДокумент45 страницPresentacion - AlcanosGhino Xavier Huertas Paico100% (2)
- AlcanoДокумент4 страницыAlcanomichellОценок пока нет
- Practica 3 AlcanosДокумент17 страницPractica 3 AlcanosDIEGO GALVANОценок пока нет
- Obtención de Una Cetona - Informe Completo de LaboratorioДокумент9 страницObtención de Una Cetona - Informe Completo de LaboratorioPaul Delgado Mendoza100% (2)
- Ejercicios de AplicacionДокумент4 страницыEjercicios de AplicacionCatalina SánchezОценок пока нет
- QUIMICA-InFORME Obtencion de Alcanos Alequenos Y AlquinosДокумент13 страницQUIMICA-InFORME Obtencion de Alcanos Alequenos Y AlquinosDennis Tinoco T100% (1)
- DIENOSДокумент12 страницDIENOSAnaid DianaОценок пока нет
- ALQUINOSДокумент4 страницыALQUINOSDenis Dante Corilla FloresОценок пока нет
- Tema 10 QOДокумент44 страницыTema 10 QOYamilito GarnicaОценок пока нет
- Obtencion de Acetileno y Propiedades de Alquinos y AlcanosДокумент5 страницObtencion de Acetileno y Propiedades de Alquinos y AlcanosLuisa ValenciaОценок пока нет
- Química CabralДокумент55 страницQuímica Cabralmelisa gaonaОценок пока нет
- Clase Teorica de AlcanosДокумент34 страницыClase Teorica de AlcanosRaúl Nicolás Caicedo VidalОценок пока нет
- Métodos de Mejora Genética de AlógamasДокумент11 страницMétodos de Mejora Genética de AlógamasAndrea YumboОценок пока нет
- Lunes 17 de OctubreДокумент21 страницаLunes 17 de OctubreNayeli Maricielo Olaya GarciaОценок пока нет
- Estudios Clínicos y Paraclínicos en GinecologíaДокумент37 страницEstudios Clínicos y Paraclínicos en Ginecologíanaomy uribeОценок пока нет
- Fp-Pas Peru-04-03 Iperc Continuo v-03Документ2 страницыFp-Pas Peru-04-03 Iperc Continuo v-03GinoPalaciosОценок пока нет
- Saponinas y TerpenosДокумент11 страницSaponinas y TerpenosDeisy CerriteñoОценок пока нет
- Reseña Crear CapacidadesДокумент3 страницыReseña Crear CapacidadesAngela VargasОценок пока нет
- Humus Liquido PDFДокумент50 страницHumus Liquido PDFFlavioTeixeiraОценок пока нет
- El TamarugoДокумент7 страницEl Tamarugofernando scmОценок пока нет
- 3ro Bgu Texto Quimica Unidad 6Документ12 страниц3ro Bgu Texto Quimica Unidad 6jedaymc27Оценок пока нет
- Proyecto Final 1Документ14 страницProyecto Final 1api-520939289Оценок пока нет
- PGC Q Sistemas Dispersos Equilibrio Químico Rev 20101 PDFДокумент5 страницPGC Q Sistemas Dispersos Equilibrio Químico Rev 20101 PDFJose FloresОценок пока нет
- Psicología AlimentariaДокумент335 страницPsicología Alimentariablanca Alicia100% (2)
- Mecánica de Fluidos - Usmp 3, HidrostaticaДокумент11 страницMecánica de Fluidos - Usmp 3, HidrostaticaPercy AJОценок пока нет
- Plan Anual de Seguridad y Salud en El Trabajo Abc 2020Документ16 страницPlan Anual de Seguridad y Salud en El Trabajo Abc 2020Dennis Alexander Rojas Bicerra100% (1)
- PSI Correccion v2.0Документ8 страницPSI Correccion v2.0Gisela RomeroОценок пока нет
- Glándula TiroidesДокумент28 страницGlándula Tiroidespablo gustavoОценок пока нет
- Guion LiterarioДокумент2 страницыGuion LiterarioAracelis PaoliniОценок пока нет
- La Memoria Está en Los BesosДокумент64 страницыLa Memoria Está en Los BesosMaria PitaОценок пока нет
- Comparación de Ruido - México y BoliviaДокумент3 страницыComparación de Ruido - México y BoliviaJaime RiosОценок пока нет
- Comparación Entre PSL 1 y PSL2 PDFДокумент9 страницComparación Entre PSL 1 y PSL2 PDFVictor Hugo DiazОценок пока нет
- Manual Del Usuario Tostadora BT PM2BAR1Документ12 страницManual Del Usuario Tostadora BT PM2BAR1PreciousОценок пока нет
- ConjugaciónДокумент56 страницConjugaciónOmar PopocaОценок пока нет
- Las Reservas y La Contabilidad PDFДокумент5 страницLas Reservas y La Contabilidad PDFSosa AlfredoОценок пока нет
- FasciolasisДокумент20 страницFasciolasisJorge Andrés García CarpinteroОценок пока нет
- Mejoramiento Del Servicio de Movilidad Urbana de Las Vías Locales de La Localidad de Coya Del Distrito de Coya - Provincia de Calca - Departamento de CuscoДокумент22 страницыMejoramiento Del Servicio de Movilidad Urbana de Las Vías Locales de La Localidad de Coya Del Distrito de Coya - Provincia de Calca - Departamento de CuscoRicardo GarciaОценок пока нет
- Cartilla Procedimientos AE-1Документ78 страницCartilla Procedimientos AE-1Yomara RicoОценок пока нет
- 072 Productos - Sellantes02Документ9 страниц072 Productos - Sellantes02Francisco José Carnero RodríguezОценок пока нет
- Revista 21 1 2014 4Документ10 страницRevista 21 1 2014 4Maria Peschiera BenitesОценок пока нет
- Los Peligros Que Acechan Los Pingüinos.Документ1 страницаLos Peligros Que Acechan Los Pingüinos.Des AnnОценок пока нет
- Prueba de Comprension LectoraДокумент4 страницыPrueba de Comprension LectoraRoly Ortega Marcatoma100% (1)