Академический Документы
Профессиональный Документы
Культура Документы
Metales Alcalinotérreos
Загружено:
Ezeq Morales MartiОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Metales Alcalinotérreos
Загружено:
Ezeq Morales MartiАвторское право:
Доступные форматы
Metales alcalinotrreos
PROPIEDADES QUMICAS:
Los metales alcalinotrreos presentan carcter metlico, intenso brillo y buena
conductividad. Son ms duros que los alcalinos pero, al igual que stos, pueden ser cortados
con un cuchillo. Sus puntos de fusin son ms elevados que los puntos de fusin de los
metales alcalinos.
PROPIEDADES FSICAS:
Los metales alcalinotrreos son poderosos agentes reductores. El berilio presenta
propiedades qumicas lgicamente diferentes a las de los dems elementos del grupo, forma
compuestos predominantemente covalente. Los restantes metales alcalinotrreos forman
compuestos inicos, a excepcin del magnesio, que tiende a formar tambin compuestos
covalentes.
Los alcalinotrreos aparecen como silicatos, carbonatos, sulfatos y fosfatos en los cuales el
estado de oxidacin es siempre +2. Todos estos compuestos son inicos, a excepcin de los
del berilio.
Los halgenos son los elementos qumicos que se localizan en el
grupo VIIA o grupo 17 de la tabla peridica. Est formado por los
elementos flor, cloro, bromo, yodo y astato.
El nombre de halgeno proviene del griego y significa productor
de sales, ya que estos elementos forman con el sodio sales de
caractersticas semejantes a la sal comn.
Caractersticas comunes de los halgenos:
Son elementos monovalentes, es decir, que slo tienen un nmero
de valencia. En los halgenos la valencia es -1.
Poseen afinidad por el hidrgeno, formando los llamados
hidrcidos.
Tienen poca afinidad por el oxgeno, por lo que no forman xidos
sino a muy altas temperaturas.
Se combinan con los metales formando las sales halgenas.
La electronegatividad es una medida de la capacidad de un tomo (o de manera menos
frecuente de un grupo funcional) para atraer a los electrones, cuando forma un enlace
qumico en una molcula.1 Tambin debemos considerar la distribucin de densidad
electrnica alrededor de un tomo determinado frente a otros distintos, tanto en una especie
molecular como en sistemas o especies no moleculares. El flor es el elemento con ms
electronegatividad, el Francio es el elemento con menos electronegatividad.
La electronegatividad de un tomo determinado est afectada fundamentalmente por dos
magnitudes: su masa atmica y la distancia promedio de los electrones de valencia con
respecto al ncleo atmico. Esta propiedad se ha podido correlacionar con otras propiedades
atmicas y moleculares. Fue Linus Pauling el investigador que propuso esta magnitud por
primera vez en el ao 1932, como un desarrollo ms de su teora del enlace de valencia.2 La
electronegatividad no se puede medir experimentalmente de manera directa como, por
ejemplo, la energa de ionizacin, pero se puede determinar de manera indirecta efectuando
clculos a partir de otras propiedades atmicas o moleculares.
Se han propuesto distintos mtodos para su determinacin y aunque hay pequeas
diferencias entre los resultados obtenidos todos los mtodos muestran la misma tendencia
peridica entre los elementos.
El procedimiento de clculo ms comn es el inicialmente propuesto por Pauling. El resultado
obtenido mediante este procedimiento es un nmero adimensional que se incluye dentro de la
escala de Pauling. Esta escala vara entre 0,7 para el elemento menos electronegativo y 4,0
para el mayor.
Es interesante sealar que la electronegatividad no es estrictamente una propiedad atmica,
pues se refiere a un tomo dentro de una molcula3 y, por tanto, puede variar ligeramente
cuando vara el "entorno"4 de un mismo tomo en distintos enlaces de distintas molculas. La
propiedad equivalente de la electronegatividad para un tomo aislado sera la afinidad
electrnica o electroafinidad.
Dos tomos con electronegatividades muy diferentes forman un enlace inico. Pares de
tomos con diferencias pequeas de electronegatividad forman enlaces covalentes polares
con la carga negativa en el tomo de mayor electronegatividad.
Propiedades y Caractersticas de los metales alcalinos
Los metales alcalinos son aquellos que estn situados en la primera columna de la tabla
peridica. Son siete y se llaman: Hidrgeno, Litio, Sodio, Potasio, Rubidio Cesio y Francio.
Empecemos por las propiedades generales:
Al reaccionar con agua, estos metales forman hidrxidos.
Son metales blandos.
Al cortarlos o fundirlos se observa su color plateado y su brillo metlico.
Los metales alcalinos son de baja densidad.
Son blanco-plateados, con puntos de fusin bajos
(debido a las fuerzas de enlace dbiles que unen sus tomos) que decrecen segn se
desciende en el grupo y blandos, siendo el litio el ms duro.
Estos metales son los ms reactivos qumicamente, por ello, esta clase de metales
no se encuentran en estado libre en la naturaleza, sino en forma de compuestos,
generalmente sales.
Su configuracin electrnica muestra un electrn en su capa de valencia
Son muy electropositivos: baja energa de ionizacin. Por tanto, pierden este
electrn fcilmente (nmero de oxidacin +1) y se unen mediante enlace inico con
otros elementos.
En estado slido forman redes cbicas
Como el resto de los metales, los metales alcalinos son maleables, dctiles y buenos
conductores del calor y la electricidad.
Presentan efecto fotoelctrico con radiacin de baja energa, siendo ms fcil de
ionizar el cesio. La reactividad aumenta hacia abajo, siendo el cesio y el francio los
ms reactivos del grupo.
Los metales alcalinos se recubren rpidamente de una capa de hidrxido en contacto
con el aire y reaccionan violentamente en contacto con el agua, liberando hidrgeno
que, debido al calor desprendido, arde (con rubidio y cesio la reaccin es explosiva, ya
que al ser ms densos que el agua, la reaccin la producen en el fondo y el hidrgeno
formado arde produciendo una onda de choque que puede romper el recipiente).
Tambin reaccionan con el vapor de agua del aire o con la humedad de la piel.
Son reductores poderosos, sus xidos son bsicos as como sus hidrxidos.
Reaccionan directamente con los halgenos, el hidrgeno, el azufre y el fsforo
originando los haluros, hidruros, sulfuros y fosfuros correspondientes.
Casi todas las sales son solubles en agua, siendo menos solubles las de litio.
Se emplean como refrigerantes lquidos en centrales nucleares (litio, sodio, potasio) y
como conductores de corriente dentro de un revestimiento plstico.
Sus compuestos tienen un gran nmero de aplicaciones.
Todos ellos son metales excepto el hidrgeno que es un no metal.
Todos ellos tienen como nmero de oxidacin +1, excepto el hidrgeno que tiene +1 y
-1.
Los metaloides son unos elementos qumicos que no se encuentran
clasificados entre los metales ni entre los no metales; esto es
debido a que cuentan con cualidades propias de los dos anteriores
y se encuentran en un punto intermedio entre los dos elementos
antes mencionados.
Estos elementos tienen cualidades qumicas intermedias que son
muy utilizadas en la qumica, sobre todo en la electrnica y
microelectrnica para producir reacciones, tal como sucede con los
semiconductores, circuitos integrados y los condensadores,
las caractersticas de los metaloides son aprovechadas
ampliamente en la industria y sobre todo en la industria electonica.
Caractersticas y usos de los metaloides:
Elemento.- Los metaloides son una serie de elementos qumicos
que como ya mencionamos tienen cualidades tanto propias de los
metales como de los no metales.
Apariencia.- Su apariencia suele variar entre la brillante propia del
metal o la opacidad que caracteriza a los no metales.
Conduccin.- Este tipo de elementos vara ampliamente en su
conduccin de energa y temperatura lo que permite una gama
amplia de aplicaciones mdicas e industriales.
Clasificacin.- Estos elementos se encuentran clasificados en la
tabla peridica de los elementos; en sta ocupa un distintivo que
es el color distintivo que puede ser verde o rojo segn el formato
de la tabla.
La lista de elementos no metales es la siguiente:
1. Boro = (B)
2. Silicio = (Si)
3. Germanio = (Ge)
4. Arsnico = (As)
5. Antimonio = (Sb)
6. Telurio = (Te)
7. Polonio = (Po)
Esta pequea clasificacin de elementos se encuentra ubicada en
una lnea diagonal de izquierda a derecha y se convierte en una
lnea divisoria entre los no-metales y los metales que se encuentra
a la derecha e izquierda respectivamente.
As a la izquierda se encuentran los metales que suelen estar en un
color amarillo dentro de la clasificacin y a la derecha los nometales que suelen estar en un color verde claro.
Usos.- Los metaloides son utilizados como semiconductores,
debido a sus cualidades qumicas, y estos se pueden apreciar
fsicamente en los ordenadores, radios, televisores e incluso en las
tabletas y telfonos celulares.
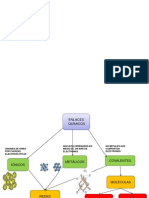
Representacin de Lewis del enlace covalente
El enlace covalente se puede representar de dos formas, o
colocando el par de electrones compartidos en medio de ambas
sustancias, el cual es la representacin ms comn en las
temticas de las estructuras de Lewis, o representando al par de
electrones como una lnea. Esto se debe a que el par de
electrones el medio fsico que mantiene a los dos ncleos
unidos, en trminos ms actualizados diramos que es el orbital
molecular generado por la superposicin de las ondas de ambos
electrones lo que mantiene unido a ambos ncleos.
Вам также может понравиться
- Características de Los MetalesДокумент6 страницCaracterísticas de Los MetalesYovanny Sanchez71% (7)
- Elementos de La Tabla Periodica: MetalesДокумент6 страницElementos de La Tabla Periodica: MetalesRonny Recalde MerchanОценок пока нет
- Metales y No Metales (Elementos de La Tabla Periodica)Документ6 страницMetales y No Metales (Elementos de La Tabla Periodica)FabrizioLeonelDelgadoGómezОценок пока нет
- Funciones de Los MetalesДокумент6 страницFunciones de Los MetalesBrithani MeraОценок пока нет
- Características de los metales y elementos con mayor carácter metálicoДокумент23 страницыCaracterísticas de los metales y elementos con mayor carácter metálicosantiagoОценок пока нет
- Tema 2: Elementos y Compuestos: I. Los Elementos: La Tabla PeriodicaДокумент6 страницTema 2: Elementos y Compuestos: I. Los Elementos: La Tabla PeriodicaJavier Ruiz PerezОценок пока нет
- Investigacion Metales y No MetalesДокумент6 страницInvestigacion Metales y No MetalesEMILIO ALEJANDROОценок пока нет
- Diferencia Entre Metales y No MetalesДокумент12 страницDiferencia Entre Metales y No MetalesZuleima Gonzalez RuizОценок пока нет
- Propiedades de Los Metales y de Los No MetalesДокумент5 страницPropiedades de Los Metales y de Los No MetalesValentina vОценок пока нет
- 2.1 Clasificasion de Los Elementos de Acuerdo A Su Relaccion CuanticaДокумент9 страниц2.1 Clasificasion de Los Elementos de Acuerdo A Su Relaccion CuanticaMAX PEAОценок пока нет
- Solucionario de Preguntas Química General IiДокумент11 страницSolucionario de Preguntas Química General IiDilmer Alexis Delgado HerreraОценок пока нет
- 4 Libro 2010 CorregidoДокумент49 страниц4 Libro 2010 CorregidoMaximiliano PortilloОценок пока нет
- Trabajo de Quimica Los ElementosДокумент12 страницTrabajo de Quimica Los ElementosCarlosBravoОценок пока нет
- Clasificación de Los Elementos QuímicosДокумент23 страницыClasificación de Los Elementos QuímicosZuleima Gonzalez RuizОценок пока нет
- Trabajo de YulianyДокумент8 страницTrabajo de Yulianyyesenia carolinaОценок пока нет
- Qui MicaДокумент5 страницQui Micamayerling velasquezОценок пока нет
- Enlace QuímicoДокумент34 страницыEnlace QuímicoMaría José OyolaОценок пока нет
- QuimicaДокумент6 страницQuimicaMario AriasОценок пока нет
- Propiedades y usos de los metales alcalinosДокумент5 страницPropiedades y usos de los metales alcalinosjunior TV lujanoОценок пока нет
- Enlaces Atómicos: Química Tercero 2020Документ24 страницыEnlaces Atómicos: Química Tercero 2020logokillaОценок пока нет
- Unidad III Química IДокумент8 страницUnidad III Química IGracielaОценок пока нет
- Unidad IIIДокумент8 страницUnidad IIIRonanОценок пока нет
- Propiedades y características de los elementos de la tabla periódicaДокумент5 страницPropiedades y características de los elementos de la tabla periódicaEssaú C.Оценок пока нет
- Elementos y enlaces químicosДокумент4 страницыElementos y enlaces químicosblueknowОценок пока нет
- Características Metales de TransiciónДокумент3 страницыCaracterísticas Metales de TransiciónDelverОценок пока нет
- QuímicaДокумент24 страницыQuímicaღLucyღОценок пока нет
- BIOINORGÁNICA. Práctica 3Документ5 страницBIOINORGÁNICA. Práctica 3Enny StrifeОценок пока нет
- LMyT EvA 3Документ9 страницLMyT EvA 3gera zuñigaОценок пока нет
- Clase de Propiedades Periodicas-2019Документ21 страницаClase de Propiedades Periodicas-2019David Juárez JiménezОценок пока нет
- Trabajo Recuperar Clases 3°4 y 3°5° F.Q14Документ12 страницTrabajo Recuperar Clases 3°4 y 3°5° F.Q14Jessica SantillanОценок пока нет
- Metales Puros PDFДокумент8 страницMetales Puros PDFnandoОценок пока нет
- Tarea 1Документ2 страницыTarea 1LUIS FRANCISCO MENDOZA REYESОценок пока нет
- Repartido D QuimicaДокумент4 страницыRepartido D Quimicaflor_1493Оценок пока нет
- InformeДокумент5 страницInformeSthef Gutierrez0% (1)
- Actividad 6Документ7 страницActividad 6eduar nicolas cabiativa hernadezОценок пока нет
- Conductividad eléctrica de compuestosДокумент3 страницыConductividad eléctrica de compuestosingjosebravoОценок пока нет
- Ficha 6 - Tabla Periodica IiДокумент9 страницFicha 6 - Tabla Periodica IiManuel Diaz EstradaОценок пока нет
- ACTIVIDAD 3 NaturalesДокумент8 страницACTIVIDAD 3 NaturalesYenny Andrea Garcia AlvarezОценок пока нет
- Estructura Quimica ConductoresДокумент7 страницEstructura Quimica ConductoresMauricio Petri RuizОценок пока нет
- Uniones QuímicasДокумент5 страницUniones QuímicasBryan BordaОценок пока нет
- Estructura AtómicaДокумент34 страницыEstructura AtómicaAndrea Carolina Duarte NavarroОценок пока нет
- Apuntes de Quimica Inorgánica Unidad 2Документ33 страницыApuntes de Quimica Inorgánica Unidad 2Isidoro Valente Torres DiazОценок пока нет
- El Enlace QuímicoДокумент11 страницEl Enlace QuímicoThiffany Sherlyn OrtizОценок пока нет
- Aula Tabla PeriodicaДокумент34 страницыAula Tabla PeriodicayamilemОценок пока нет
- Elementos QuimicosДокумент19 страницElementos QuimicosEmilly Guns100% (1)
- Tabla PeriodicaДокумент29 страницTabla PeriodicaLuz Anel SarayaОценок пока нет
- Como Se Organizan Los Elementos en La Tabla PeriódicaДокумент7 страницComo Se Organizan Los Elementos en La Tabla PeriódicaKraus Ni100% (2)
- PROPIEDADES QUIMICAS (Transicion, Semimetales, No Metales, Lantanidos y Actinidos)Документ2 страницыPROPIEDADES QUIMICAS (Transicion, Semimetales, No Metales, Lantanidos y Actinidos)Abraham SánchezОценок пока нет
- Historia de la tabla periódicaДокумент7 страницHistoria de la tabla periódicaLuis SomeraОценок пока нет
- Guia 2 Tabla Per P2Документ3 страницыGuia 2 Tabla Per P2Samuel SuarezОценок пока нет
- El Enlace Químico: ObjetivosДокумент12 страницEl Enlace Químico: ObjetivosMiranda MorenoОценок пока нет
- Práctica #3 - Quimica InorganicaДокумент17 страницPráctica #3 - Quimica InorganicaJoseОценок пока нет
- 1ro Bgu Texto Quimica Unidad 2Документ8 страниц1ro Bgu Texto Quimica Unidad 2jedaymc27Оценок пока нет
- Propiedades de Los Enlaces QuímicosДокумент10 страницPropiedades de Los Enlaces QuímicosyamilaОценок пока нет
- 2 - No MetalДокумент3 страницы2 - No MetalDennisAlexanderPérezRobinsonОценок пока нет
- Ciencias NaturalesДокумент25 страницCiencias NaturalesAle GrindelackОценок пока нет
- Enlaces Químicos - Número de OxidaciónДокумент21 страницаEnlaces Químicos - Número de OxidaciónXavy LeoОценок пока нет
- Fundamento TeoricoДокумент2 страницыFundamento TeoricoJean Piere Cholán LlamogaОценок пока нет
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaОт EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaРейтинг: 5 из 5 звезд5/5 (1)
- CohesionДокумент5 страницCohesionEzeq Morales MartiОценок пока нет
- Razonamiento AlgebraicoДокумент6 страницRazonamiento AlgebraicoEzeq Morales MartiОценок пока нет
- Aprende A Aprender Tecnicas de EstudioДокумент22 страницыAprende A Aprender Tecnicas de EstudioMirsha Emilk Theo Ayala ApazaОценок пока нет
- Ejercicio de LectoescrituraДокумент20 страницEjercicio de LectoescrituraAdriEchegoynОценок пока нет
- Manual Razonamiento Verbal PDFДокумент22 страницыManual Razonamiento Verbal PDFmayitonrОценок пока нет
- Cálculo II - Longitud de Curvas PlanasДокумент5 страницCálculo II - Longitud de Curvas PlanasCarmenОценок пока нет
- El Estudio Del Desarrollo HumanoДокумент15 страницEl Estudio Del Desarrollo Humanocanekin100% (8)
- Trazabilidad PorcinosДокумент43 страницыTrazabilidad Porcinosralapubs100% (1)
- 1 Evaluar Condiciones de Operación Minera de Acuerdo Con Normativa de Seguridad en Labores SubterráneasДокумент4 страницы1 Evaluar Condiciones de Operación Minera de Acuerdo Con Normativa de Seguridad en Labores SubterráneasDidier AlejandroОценок пока нет
- Contaminacion AmbientalДокумент5 страницContaminacion AmbientalKaticsa Ramirez PerezОценок пока нет
- Eutanasia: análisis de la complejidad del conceptoДокумент10 страницEutanasia: análisis de la complejidad del conceptoPedro Gallego MartínezОценок пока нет
- Mujerícolas del marДокумент182 страницыMujerícolas del marunitedkarinaОценок пока нет
- Presentación PerfettiДокумент24 страницыPresentación PerfettiMaria Valentina Rodriguez DiazОценок пока нет
- Funciones de Circulación en Las Especies de AnimalesДокумент17 страницFunciones de Circulación en Las Especies de AnimalesmabyОценок пока нет
- Estados de Agregación de La MateriaДокумент3 страницыEstados de Agregación de La MateriaSantiago CuellattОценок пока нет
- Análisis de seguridad en el trabajo ASTДокумент2 страницыAnálisis de seguridad en el trabajo ASTLuis SumireОценок пока нет
- Actividad de Aprendizaje II EJERCICIO TECNICAS DE CONTABILIDADДокумент3 страницыActividad de Aprendizaje II EJERCICIO TECNICAS DE CONTABILIDADYAMIL RODRIGUEZОценок пока нет
- AbortoДокумент5 страницAbortoKatherine Mio DelgadoОценок пока нет
- Parásitos humanos y sus características morfológicasДокумент33 страницыParásitos humanos y sus características morfológicaseorgalionОценок пока нет
- Cuestionario de NutriciónДокумент8 страницCuestionario de NutriciónMelissa PomaОценок пока нет
- Proceso para Purificacion de PropanoДокумент4 страницыProceso para Purificacion de PropanoAlbert Aguilar ContrerasОценок пока нет
- Biología 3er Año A y BДокумент10 страницBiología 3er Año A y BJohanna PerezОценок пока нет
- Adolescencia, madurez y vejezДокумент11 страницAdolescencia, madurez y vejezLuis JaraОценок пока нет
- Memoria Descriptiva de ProgramacionДокумент3 страницыMemoria Descriptiva de ProgramacionLizseth AguirreОценок пока нет
- HotPro ManualДокумент12 страницHotPro ManualRicardo VargasОценок пока нет
- Fallo BazterricaДокумент4 страницыFallo BazterricaGermán Balbuena100% (1)
- Las EmocionesДокумент9 страницLas EmocioneswillyballОценок пока нет
- Proyecto - BiolДокумент21 страницаProyecto - BiolAbimael Sinche Ramos80% (15)
- Fundamentos Teóricos y Cuidados Básicos de Enfermería (Enfermería, Fisioterapia y Podología. Serie Enfermería) (Spanish... (Carmina Prado Laguna (Editora) )Документ334 страницыFundamentos Teóricos y Cuidados Básicos de Enfermería (Enfermería, Fisioterapia y Podología. Serie Enfermería) (Spanish... (Carmina Prado Laguna (Editora) )mariana alvarezОценок пока нет
- VPO - SAFE.3.1.13.3. Ultima Revision - Last CheckДокумент2 страницыVPO - SAFE.3.1.13.3. Ultima Revision - Last CheckBrayan CamiloОценок пока нет
- Flujo de condimentosДокумент11 страницFlujo de condimentosLinaPatarroyoRamosОценок пока нет
- Guia Rapida Cama Noa MedicalДокумент6 страницGuia Rapida Cama Noa MedicalOficina de Comunicaciones HUNОценок пока нет
- PrimerAmorNovelaValleCaucaДокумент1 страницаPrimerAmorNovelaValleCaucastefany leonОценок пока нет
- Guia de Trabajo Informacion ExplicitaДокумент4 страницыGuia de Trabajo Informacion ExplicitaJennifer Torres Valenzuela100% (1)
- La belleza de Arequipa vista a través de la cultura campesinaДокумент10 страницLa belleza de Arequipa vista a través de la cultura campesinaLuisAldoОценок пока нет