Академический Документы
Профессиональный Документы
Культура Документы
El Átomo
Загружено:
Jose Angel Morales TinedoИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
El Átomo
Загружено:
Jose Angel Morales TinedoАвторское право:
Доступные форматы
EL TOMO
El tomo es la parte ms pequea en la que se puede obtener materia de
forma estable, ya que las partculas subatmicas que lo componen no pueden
existir aisladamente salvo en condiciones muy especiales. A pesar de que
"tomo" significa "indivisible", hoy da se sabe que el tomo est formado por
partculas ms pequeas, las llamadas partculas subatmicas.
El tomo posee un ncleo que es su parte central y tiene carga positiva, y en
l se concentra casi toda la masa del mismo. Sin embargo, ocupa una fraccin
muy pequea del volumen del tomo: su radio es unas diez mil veces ms
pequeo. El ncleo est formado por protones y neutrones.
Alrededor del ncleo se encuentran los electrones, partculas de carga
negativa y masa muy pequea comparada con la de los protones y neutrones: un
0,05% aproximadamente. Los electrones se encuentran alrededor del ncleo,
ligados por la fuerza electromagntica que ste ejerce sobre ellos, y ocupando la
mayor parte del tamao del tomo, en la llamada nube de electrones.
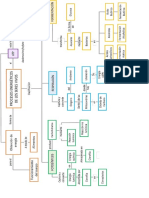
CONFIGURACION ELECTRNICA.
Al referirnos a la configuracin electrnica (o peridica) estamos hablando
de la descripcin de la ubicacin de los electrones en los distintos niveles (con
subniveles y orbitales) de un determinado tomo. Configurar significa "ordenar" o
"acomodar", y electrnico deriva de "electrn"; as, configuracin electrnica es la
manera ordenada de repartir los electrones en los niveles y subniveles de energa.
Cientficamente, diremos que es la representacin del modelo atmico de
Schrdinger o modelo de la mecnica cuntica. En esta representacin se indican
los niveles, subniveles y los orbitales que ocupan los electrones.
Debemos acotar que aunque el modelo de Schrdinger es exacto slo para el
tomo de hidrgeno, para otros tomos es aplicable el mismo modelo mediante
aproximaciones muy buenas.
PARA ESCRIBIR LA CONFIGURACIN ELECTRNICA DE UN TOMO ES
NECESARIO:
Saber el nmero de electrones que el tomo tiene; basta conocer
el nmero atmico (Z) del tomo en la tabla peridica. Recuerda que el
nmero de electrones en un tomo neutro es igual al nmero atmico (Z =
P+).
Ubicar los electrones en cada uno de los niveles de energa, comenzando
desde el nivel ms cercano al ncleo (n = 1).
s = 2ep = 6eRespetar la capacidad mxima de cada subnivel
d = 10ef = 14e-
Se debe tener en cuenta los siguientes principios:
a) Principio
de
Incertidumbre
de
Heisenberg:
Es
imposible
determinar simultneamente la posicin exacta y el momento exacto
del electrn
b) Principio de Exclusin de Pauli: un orbital no puede tener ms de
dos electrones.
TIPOS DE CONFIGURACIONES ELECTRNICAS
1.- CONFIGURACIN ESTNDAR
Se representa la configuracin electrnica que se obtiene usando el cuadro de las
diagonales (una de sus formas grficas se muestra en la imagen de la izquierda).
Es importante recordar que los orbitales se van llenando en el orden en que
aparecen, siguiendo esas diagonales, empezando siempre por el 1s.
1s2
2s2
2p6
3s2
3p6
4s2
3d10
4p6
5s2
4d10
5p6
6s2
4f14
6d10
MTODO DE LAS DIAGONALES
ORBITALES:
5d10
6p6
7s2
5f14
2.- CONFIGURACIN DESARROLLADA
Consiste en representar todos los electrones de un tomo empleando
flechas para simbolizar el spin de cada uno. El llenado se realiza respetando el
principio de exclusin de Pauli y la Regla de mxima multiplicidad de Hund.
RELACIN
DE
LA
CONFIGURACIN
ELECTRNICA
CON
LA
TABLA
PERIDICA
De modo inverso, si tenemos o conocemos la configuracin electrnica de
un elemento podemos predecir exactamente el nmero atmico, el grupo y
el perodo en que se encuentra el elemento en la tabla peridica.
Por ejemplo, si la configuracin electrnica de un elemento es:
1s2 2s2 2p6 3s2 3p5
Podemos hacer el siguiente anlisis:
Para un tomo la suma total de los electrones es igual al nmero de
protones; es decir, corresponde a su nmero atmico, que en este caso es
17.
El perodo en que se ubica el elemento est dado por el mximo nivel
energtico de la configuracin, en este caso corresponde al perodo 3
El grupo est dado por la suma de los electrones en los subniveles s y p del
ltimo nivel; es decir, corresponde al grupo 7.
Hibridacin del tomo de carbono, tipos de enlaces carbono-carbono.
Estructura y modelos.
Las diferencias principales entre los compuestos orgnicos e inorgnicos se deben
a variaciones en la composicin, el tipo de
enlace y las polaridades moleculares. Los compuestos orgnicos estn formados
por tomos de carbono con enlaces covalentes entre s y con tomos de
hidrgeno, oxgeno, nitrgeno, azufre y halgenos.
Comparacin general entre compuestos orgnicos e inorgnicos
CARACTERSTICAS
COMPUESTOS
ORGANICOS
COMPUESTOS
INORGNICOS
Nmero de compuestos
conocidos
Ms de 2,000,000
Aprox. 80,000
Elementos que intervienen C H O N S P F Cl Br I
en su formacin
Todos los de la tabla
peridica
Velocidad de reaccin
Reaccionan lentamente
Reaccionan rpidamente
Tipo de enlace
Covalente
Inico y covalente
Combustin
Son combustibles
No son combustibles
Altas temperaturas
No resisten altas
temperaturas
Resisten altas
temperaturas
Solubilidad
Generalmente son
Generalmente son
solubles en disolventes no solubles en disolventes
polares.
polares (agua).
Isomera
Si. Existen compuestos
No se presenta.
con igual nmero de
tomos de cada elemento
pero con estructuras
diferentes.
Вам также может понравиться
- Átomos, Electrones y OrbitalesДокумент20 страницÁtomos, Electrones y OrbitalesJ Alberto Garcés100% (1)
- ÁTOMOДокумент33 страницыÁTOMOAlfredo Hernandez OrtizОценок пока нет
- Trabajo Practico de Quimica 6Документ11 страницTrabajo Practico de Quimica 6AxelMartinОценок пока нет
- El ÁtomoДокумент4 страницыEl ÁtomoMarianaGarcíaОценок пока нет
- Quimica FinalДокумент43 страницыQuimica FinalRocio GodoyОценок пока нет
- Que Es El AtomoДокумент10 страницQue Es El AtomoDavidCovicОценок пока нет
- Apuntes de BioquímicaДокумент485 страницApuntes de Bioquímicalucina arredondoОценок пока нет
- CienciasДокумент10 страницCienciasJosé SandovalОценок пока нет
- QUIMICAДокумент15 страницQUIMICAlizzy amadorОценок пока нет
- El Átomo. Estructura. Número Atómico y Masa Atómica. Isotopos. Modelos Atómicos. Radiación Electromagnética. Problemas de Aplicación.Документ55 страницEl Átomo. Estructura. Número Atómico y Masa Atómica. Isotopos. Modelos Atómicos. Radiación Electromagnética. Problemas de Aplicación.waldir marcelinoОценок пока нет
- Tarea Del BaboДокумент5 страницTarea Del BaboJess SuzukiОценок пока нет
- Estructura AtómicaДокумент9 страницEstructura AtómicaPatricia BalcazarОценок пока нет
- C. 1cm2 A. Guía 1p. 2024-1 Buena. Alumno.Документ13 страницC. 1cm2 A. Guía 1p. 2024-1 Buena. Alumno.zaiddurbn030809Оценок пока нет
- Quimica 1.Документ28 страницQuimica 1.Miguel ACOSTAОценок пока нет
- 2 Estructura AtómicaДокумент11 страниц2 Estructura Atómicablas.snblasОценок пока нет
- El ÁtomoДокумент10 страницEl ÁtomobenalemanОценок пока нет
- Unidad 2Документ11 страницUnidad 2julietaaleromero629Оценок пока нет
- El Átomo y Sus Partículas SubatómicasДокумент10 страницEl Átomo y Sus Partículas SubatómicasSommer Avila TonyОценок пока нет
- Estructira Del AtomoДокумент11 страницEstructira Del AtomoCristhian Yaranga ÑañaОценок пока нет
- COEVALUACIÓNДокумент4 страницыCOEVALUACIÓNMicaa FariasОценок пока нет
- Qué Es La Estructura AtómicaДокумент8 страницQué Es La Estructura AtómicaAbner LucasОценок пока нет
- 1 1 Estructura Materia AДокумент42 страницы1 1 Estructura Materia AToni Vives BalaguerОценок пока нет
- Cálculo de ProtonesДокумент5 страницCálculo de ProtonesJose Quiterio HernadezОценок пока нет
- Guía 3 El ÁtomoДокумент10 страницGuía 3 El ÁtomoNini Johana OspinaОценок пока нет
- Semana02 ESTRUCTURA ATOMICA Y LA TABLA PERIODICAДокумент33 страницыSemana02 ESTRUCTURA ATOMICA Y LA TABLA PERIODICAAraceli Raquel Cordova MaytaОценок пока нет
- El Átomo y Los Isótopos 3º ESOДокумент3 страницыEl Átomo y Los Isótopos 3º ESOISAОценок пока нет
- YANNIДокумент15 страницYANNIGonzalo Yanni MartínezОценок пока нет
- Bioquimica GuiaДокумент21 страницаBioquimica GuiaValeria Rivera MartellОценок пока нет
- CUADERNO DE REFUERZO QUÍMICA 4to AÑOДокумент52 страницыCUADERNO DE REFUERZO QUÍMICA 4to AÑOClaribel LinaresОценок пока нет
- Atomo para 3º EsoДокумент3 страницыAtomo para 3º Esomaria mmОценок пока нет
- Cuadernillo QcaДокумент28 страницCuadernillo QcaclaudiaОценок пока нет
- Mapa Mental QuimicaДокумент26 страницMapa Mental QuimicaMaria CorinaОценок пока нет
- Guía 2 QuimicaДокумент5 страницGuía 2 QuimicaJorge EnriqueОценок пока нет
- Física Física Moderna Estructura Del ÁtomoДокумент5 страницFísica Física Moderna Estructura Del ÁtomoluceroОценок пока нет
- Diapositivas-Estructura AtomicaДокумент19 страницDiapositivas-Estructura AtomicaEdgar DezaОценок пока нет
- MATERIAL DE APOYO - CLASE No 2Документ87 страницMATERIAL DE APOYO - CLASE No 2luis sandovalОценок пока нет
- CONCEPTOS GENERALES MatematicaДокумент13 страницCONCEPTOS GENERALES MatematicaDebora Benitez SuarezОценок пока нет
- Teoria Atomica y Enlaces AtomicosДокумент9 страницTeoria Atomica y Enlaces AtomicosEDWARD JOSEPH DOMINICK CORONADO CASTELLANOSОценок пока нет
- Tema 1 El ÁtomoДокумент7 страницTema 1 El ÁtomoMauri RosetОценок пока нет
- Actividad 3°2fisicoquímicaДокумент4 страницыActividad 3°2fisicoquímicaVania DavalosОценок пока нет
- Configuración Electrónica. Sistema Periódico. Propiedades PeriódicasДокумент64 страницыConfiguración Electrónica. Sistema Periódico. Propiedades PeriódicasIgnacio Vidal VergaraОценок пока нет
- Origen de La Teoría AtómicaДокумент10 страницOrigen de La Teoría Atómicamaria bayonaОценок пока нет
- Proyecto Primera Evaluación-1Документ4 страницыProyecto Primera Evaluación-1Esther Benito JuezОценок пока нет
- Tema 2 El Átomo y Sus UnionesДокумент10 страницTema 2 El Átomo y Sus UnionesNatalia Ricoy CallejaОценок пока нет
- ATOMOДокумент31 страницаATOMOKristofer Antony Cuzcano CalderónОценок пока нет
- Teoria y Estructura AtomicaДокумент96 страницTeoria y Estructura AtomicaAlejandro de la RosaОценок пока нет
- La Teoría Atómica y Los Enlaces AtómicosДокумент10 страницLa Teoría Atómica y Los Enlaces AtómicosMax IDОценок пока нет
- Estructura Básica Del ÁtomoДокумент14 страницEstructura Básica Del ÁtomoMolly TresanОценок пока нет
- Modelos Atomicos ResumenДокумент43 страницыModelos Atomicos Resumensocorrovergaraa86% (71)
- Resumen Capitulo 2Документ18 страницResumen Capitulo 2Mery Isabel Delgado EduardoОценок пока нет
- Composicion Quimica de Los Seres Vivos1Документ57 страницComposicion Quimica de Los Seres Vivos1MairaОценок пока нет
- ÁtomoДокумент11 страницÁtomoivanjcm85Оценок пока нет
- Tema 1 (David Quimica)Документ15 страницTema 1 (David Quimica)David Gsus VilОценок пока нет
- Estructura Atomica y La Tabla Periodica Todo de QuimicaДокумент29 страницEstructura Atomica y La Tabla Periodica Todo de QuimicaHenry ̶̵̶͙̬͇̩̰͈ͦ̿̉̅̏̇͗̈́̏̚͡ͅṋ̷̴͔̗̯͓̘̘̖̪ͥ̿ͣ̍ͬa̡͓̳̬̣̘̲̗͎͍̟̝̪͂̆̏̆̑ͪ̽͛ͯͨ̉̐ͦ̓̂̉̐̊̆͢l̡͉̥̼̟̗̳͎̘̮̟͈͓͍͕̰̻̩͉͇̈͛͛̒ͫ̔ͧ́̋̈́͆̂̎̀̀͠ At'The RootsОценок пока нет
- Unidad 1. Fisica de SemiconductoresДокумент20 страницUnidad 1. Fisica de SemiconductoresFortinoОценок пока нет
- Estructura AtomicaДокумент13 страницEstructura AtomicaHologranmaОценок пока нет
- Teoría Atómica de La MateriaДокумент7 страницTeoría Atómica de La Materiamaria moyano caleroОценок пока нет
- INVESTIGACIONДокумент9 страницINVESTIGACIONFatima A Martinez FelixОценок пока нет
- Triptico Esequibo - Aviación Militar BolivarianaДокумент2 страницыTriptico Esequibo - Aviación Militar BolivarianaJose Angel Morales TinedoОценок пока нет
- Procesos Energéticos en Los Seres VivosДокумент21 страницаProcesos Energéticos en Los Seres VivosJose Angel Morales Tinedo71% (7)
- Saque Del TenisДокумент9 страницSaque Del TenisJose Angel Morales TinedoОценок пока нет
- Poblamiento Indígena AmericanoДокумент4 страницыPoblamiento Indígena AmericanoJose Angel Morales TinedoОценок пока нет
- Saque Del TenisДокумент9 страницSaque Del TenisJose Angel Morales TinedoОценок пока нет
- Pila LimonДокумент6 страницPila LimonJose Angel Morales TinedoОценок пока нет
- Quimica Organica HeterociclicaДокумент23 страницыQuimica Organica HeterociclicaJose Angel Morales Tinedo50% (2)
- El Segundo Periodo Presidencial HUGO CHAVEZДокумент4 страницыEl Segundo Periodo Presidencial HUGO CHAVEZJose Angel Morales Tinedo100% (2)
- 1.-Secciones Cónicas: Ax + 2hxy + by + 2gx + 2fy + C 0Документ8 страниц1.-Secciones Cónicas: Ax + 2hxy + by + 2gx + 2fy + C 0Jose Angel Morales TinedoОценок пока нет
- Razones, Proporciones y PorcentajesДокумент24 страницыRazones, Proporciones y PorcentajesRosaury Castro De LunaОценок пока нет
- Guia de Nivelacion Matematicas 101 JTДокумент16 страницGuia de Nivelacion Matematicas 101 JTBRIYIDT VANESSA CARDENAS MUÑOZОценок пока нет
- Analisis de Capitulos Del Libro de RigauДокумент6 страницAnalisis de Capitulos Del Libro de RigauShandé YetzelОценок пока нет
- Deber de ConversionesДокумент4 страницыDeber de ConversionesFranchesca RobalinoОценок пока нет
- Manual para Elaborar Cerveza en Casa A NivelДокумент15 страницManual para Elaborar Cerveza en Casa A NivelchristianОценок пока нет
- Tabla de Datos, Resultados, y Cuestionario Informe de Laboratorio CrudosДокумент8 страницTabla de Datos, Resultados, y Cuestionario Informe de Laboratorio CrudosnicolasОценок пока нет
- Actividad de GeometriaДокумент10 страницActividad de GeometriaDeisy NayiveОценок пока нет
- Análisis de Carne y Productos CárnicosДокумент14 страницAnálisis de Carne y Productos CárnicosGenesis Fajardo Igotseven0% (1)
- Taller Semejanza de TriángulosДокумент2 страницыTaller Semejanza de TriángulosClaudia Patricia Perez CondeОценок пока нет
- S Sem14 Ses28 Prueba de HomogeneidadДокумент4 страницыS Sem14 Ses28 Prueba de HomogeneidadfredyОценок пока нет
- Actividad6 Tecnologia de Materiales1Документ5 страницActividad6 Tecnologia de Materiales1Franklyn SierraОценок пока нет
- Movimiento Uniformemente AceleradoДокумент4 страницыMovimiento Uniformemente AceleradoHarrinson Gutierrez CoronadoОценок пока нет
- ALGEBRA - 3° POLINOMIOS Clase 2Документ14 страницALGEBRA - 3° POLINOMIOS Clase 2Ismael Anaya VillosladaОценок пока нет
- Mesa de Analogia de StokesДокумент4 страницыMesa de Analogia de StokesConstantino Guevara BОценок пока нет
- Ejercicios SolucionesДокумент3 страницыEjercicios SolucionesSebas 03100% (1)
- Espectro A La FlamaДокумент3 страницыEspectro A La FlamaCristopherОценок пока нет
- 2 Tema BiologiaДокумент10 страниц2 Tema BiologiaGio BrancoОценок пока нет
- MATERIALES Y METODOS EmbriologiaДокумент12 страницMATERIALES Y METODOS EmbriologiaKarla VásquezОценок пока нет
- MS 5 - 1 Establecimiento Del Registro de RedДокумент5 страницMS 5 - 1 Establecimiento Del Registro de RedMario Carmelo Gamarra MendozaОценок пока нет
- Azufre y MagnetitaДокумент11 страницAzufre y MagnetitaBasago Minas Lo MejorОценок пока нет
- Sopa de LetrasДокумент1 страницаSopa de LetrasNICOL TELLEZОценок пока нет
- Mnual de UsuarioДокумент38 страницMnual de UsuarioLuis Castro33% (3)
- Semana 9 - Media, Mediana y ModaДокумент8 страницSemana 9 - Media, Mediana y ModaLiliana AlcantaraОценок пока нет
- Ficha Interdisciplinaria Semana 18Документ21 страницаFicha Interdisciplinaria Semana 18Bety enid Cueva jaraОценок пока нет
- Frecuencimetro Digital LCDДокумент12 страницFrecuencimetro Digital LCDricky081Оценок пока нет
- Carga PuntualДокумент12 страницCarga PuntualCristian IgnacioОценок пока нет
- Semana 15.2 - SEMINARIOДокумент40 страницSemana 15.2 - SEMINARIOMartin Sachun PonceОценок пока нет
- Carbón Activado Exponer 2Документ45 страницCarbón Activado Exponer 2Jesus De La Cruz Efus100% (1)
- DesventajasДокумент2 страницыDesventajasDaniel AstudilloОценок пока нет
- Politécnico Grancolombiano - Facultad de Ingeniería, Diseño e Innovación Trabajo Colaborativo de Fundamentos de Química - 2021Документ7 страницPolitécnico Grancolombiano - Facultad de Ingeniería, Diseño e Innovación Trabajo Colaborativo de Fundamentos de Química - 2021ANA SOFIA PEDRAZA SUAZA0% (1)