Академический Документы
Профессиональный Документы
Культура Документы
Influencia de La Temp en El Equilibrio
Загружено:
Miguel Coriolano0 оценок0% нашли этот документ полезным (0 голосов)
40 просмотров3 страницыUna práctica de general 2 para determinar la variación de energías a distintas temperaturas, así como sus cambios.
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документUna práctica de general 2 para determinar la variación de energías a distintas temperaturas, así como sus cambios.
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
40 просмотров3 страницыInfluencia de La Temp en El Equilibrio
Загружено:
Miguel CoriolanoUna práctica de general 2 para determinar la variación de energías a distintas temperaturas, así como sus cambios.
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 3
UNIVERSIDADNACIONALAUTNOMADE
MXICO
FACULTADDEQUMICA
LaboratoriodeQumicaInorgnica.
Prctica8:Influenciadelatemperaturaenel
equilibrioqumico.
ParedesJimnezMiguelngel
Profesora:FabiolaGonzlezOlgun.
Grupo3.
07/octubre/2014
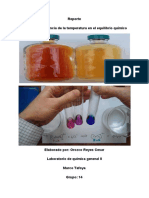
EXPERIMENTO 1.
6. El tubo nmero 1 se calienta en un bao Mara, al sumergirlo presionar el tapn del
tubo con el pulgar. Mantenerlo as hasta que ocurra un cambio en el color, describirlo,
comparndolo con el tubo 3:
El color del NO2 en el tubo 1 fue ms caf, por lo tanto el equilibrio se desplaz hacia los
reactivos.
7. Mientras tanto colocar el tubo nmero 2 en un bao de hielo y describir el cambio
de color, comparndolo con el tubo testigo:
El color del gas (NO2) se puso un poco incoloro aunque an se lograba apreciar muy poco
el color del gas, por lo tanto el equilibrio se desplaz hacia los productos.
8. Despus de la comparacin deje los tubos reposar unos minutos hasta que todos
tengan la misma temperatura, compararlos y anotar las observaciones.
Los dos tubos 1 y 2 regresaron al equilibrio, es decir el color de ambos se torn caf-rojizo
(NO2), tomaron nuevamente el color que tenan al principio.
9. Posteriormente poner el tubo 1 en un bao de hielo y el tubo 2 en un bao Mara.
Sacarlos al ocurrir el cambio de color y compararlos con el testigo. Anotar las
observaciones.
*Tuvo 1. El equilibrio cambia, al formarse enlaces el gas cambia a un color ms claro, es
decir, el equilibrio se desplaza hacia los productos (N2O4).
*Tuvo 2. Se rompen enlaces y el equilibrio se desplaza hacia los reactivos (NO2). El color
es ms oscuro. Ocurre lo mismo que en los puntos 6 y 7 pero en viceversa.
Cuestionario
1. Tomando en cuenta que la formacin de dimerizacin del NO2 para formar N2O4
implica nicamente la formacin de un enlace, indicar si la siguiente reaccin es
endotrmica o exotrmica, incluyendo al calor (Q) como un producto o un reactivo:
2 NO2 N2O4 +Q
Al aumentar la temperatura el equilibrio fue desplazado hacia los reactivos por lo tanto la
reaccin fue exotrmica
2. Escribir la reaccin de disociacin del N2O4. Esta reaccin es endotrmica o
exotrmica? Por qu puede saberse esto con seguridad?
N2O4 +Q 2 NO2
La reaccin es endotrmica pues se necesita energa para romper los dobles enlaces del
tetra xido de di nitrgeno para descomponerlo en dixido de nitrgeno.
3. Completar los siguientes enunciados:
*Si la reaccin A + B C es endotrmica, un aumento en la temperatura provocar que el
equilibrio se desplace hacia: los productos
*Si el equilibrio A + B C se desplaza hacia la izquierda cuando se aumenta la temperatura,
la reaccin es: exotermica
Experimento 2.
En esta parte de la prctica no se utiliz la silica gel.
3. Calentar el tubo nmero 1 en el mechero hasta que ocurra un cambio notorio en el
color de la slica gel. Anotar el color.
El color de la reaccin fue azul, por lo tanto el equilibrio se desplaz a los reactivos.
Mientras se calentaba en el mechero la coloracin fue lila, morado y termino por ponerse
azul.
4. Despus de calentar, dejar reposar el tubo nmero 1 durante 10 minutos hasta que
alcance la temperatura del ambiente. Anotar las observaciones.
El color de la reaccin regreso al equilibrio y al compararlo con el tubo testigo tenan el
mismo color rosita.
Cuestionario
Los colores que, en sus dos posibles formas, la slica gel con indicador de humedad
adquiere, son debidos a los compuestos de cobalto [CoCl4]2- o [Co(H2O)6]2+ ya que la
slica gel por s sola es incolora.
1. Indicar el color de la slica gel con indicador de humedad cuando el indicador de
humedad se encuentra como cloruro de cobalto hexahidratado [Co(H2O)6]2+.
El color es rosa claro
2. Indicar el color de la slica gel con indicador de humedad cuando el indicador de
humedad se encuentra como tetracloro cobaltato [CoCl4]2-.
Toma una coloracin entre azul turquesa y azul tornasol.
3.-Escribir la ecuacin de disociacin de HCL en agua, Se encuentra presente algn
in que produzca color a la disolucin?
HCl + H2O H3O + Cl- , El in Cl se encuentra presente en los productos, sin embargo
ste no provoca ninguna coloracin.
4.-Escribir la ecuacin del [Co(H2O)6]Cl2 en el agua, Qu especie es la que provoca el
color en la disolucin?
[Co(H2O)6]Cl2 +H2O Co(H2O)62- + 2Cl2- + H2O
La especie es Co(H2O)625.- Cuando se hace reaccionar a temperatura ambiente la slica gel con el indicador en
forma de [Co(H2O)6]2+ con una disolucin concentrada de HCl, se establece un
equilibrio entre los iones complejos Co(H2O)62+ y CoCl42- Qu color tiene esta
disolucin?
Es incolora.
De acuerdo con el equilibrio establecido en la introduccin,
[Co(H2O)6]2+ (ac) + Cl- (exceso) [CoCl4]2- (ac) + 6H2O
6.-A qu temperatura predomina la especie [Co(H2O)6]2+?
A temperatura Fra.
7.-A qu temperatura predomina la especie [CoCl4]2-?
A temperatura caliente.
8.- Al suministrar calor, el equilibrio se desplaza hacia la izquierda y podemos decir
que la reaccin en ese sentido es exotrmica.
9.- Las siguientes dos reacciones (hipotticas) seran endotrmicas o exotrmicas?
Co(H2O)62+
Co2+ + 6H20
endotrmica
22+
CoCl4
Co + 4Cl
exotrmica
10.- En la reaccin de formacin del in [Co(H2O)62+] a partir de la especie CoCl42-,
indicar si la reaccin requiere calentarse o enfriarse para ser ms cuantitativa (que
haya una mayor cantidad de productos presente).
Si aumento la temperatura, la reaccin se va a desplazar hacia los productos, entonces es
necesario calentarse.
11.- Esta reaccin es exotrmica o endotrmica?
Exotrmica
Вам также может понравиться
- Manual de Operación Teodolito South ET-02-Español - ESTOPOSAC PDFДокумент37 страницManual de Operación Teodolito South ET-02-Español - ESTOPOSAC PDFDauid Justiniano Quispe Apaza100% (1)
- Reporte Practica 8Документ6 страницReporte Practica 8ANDREA MARTINEZ BECERRILОценок пока нет
- Sistemas de Climatizacion NaturalДокумент40 страницSistemas de Climatizacion NaturalEd PM100% (1)
- Difusión-Transferencia de MasasДокумент42 страницыDifusión-Transferencia de MasasGabriela G. ChОценок пока нет
- Pruebas TransformadoresДокумент60 страницPruebas Transformadoresmirock65Оценок пока нет
- Óxidos de NitrógenoДокумент7 страницÓxidos de NitrógenoF.Melisa Rulfo BeltránОценок пока нет
- Fotografías de pruebas de resistencia de morteroДокумент79 страницFotografías de pruebas de resistencia de morteroRudy Ernesto Alegria Rodriguez100% (1)
- Pract 2. Determinación de La Presión de Vapor y Entalpia de Vaporización Del AguaДокумент13 страницPract 2. Determinación de La Presión de Vapor y Entalpia de Vaporización Del AguaIsabel Francisco Rivera100% (1)
- Vieytes, Rut - Metodologias de La Investigacion Social en Organizaciones Mercado y Sociedad Cap4Документ65 страницVieytes, Rut - Metodologias de La Investigacion Social en Organizaciones Mercado y Sociedad Cap4Lilian Muñoz55% (29)
- Fisica Politecnica Parte 3Документ51 страницаFisica Politecnica Parte 3Lc OjdaОценок пока нет
- Pulfer, Unicef. Cuader 4 La Capacidad de Resolución de Problemas 2010Документ116 страницPulfer, Unicef. Cuader 4 La Capacidad de Resolución de Problemas 2010Cachela CaironiОценок пока нет
- El Techo Bioclimático Tropical. Bruno StagnoДокумент28 страницEl Techo Bioclimático Tropical. Bruno StagnoPaola Marie Alvarez100% (1)
- Viscosidad Copa FORD PDFДокумент16 страницViscosidad Copa FORD PDFurielmiranda1Оценок пока нет
- Practica 8 Quimica General IIДокумент11 страницPractica 8 Quimica General IIusuarin9575% (4)
- Práctica 08 REPORTE.Документ7 страницPráctica 08 REPORTE.Wendy JoselineОценок пока нет
- Practica 8 PDFДокумент7 страницPractica 8 PDFCesar OrozcoОценок пока нет
- Equilibrio químico de complejos de cobalto y su relación con la temperaturaДокумент6 страницEquilibrio químico de complejos de cobalto y su relación con la temperaturajimenaОценок пока нет
- Práctica 08. Influencia de la temperatura en el equilibrio quÃ_mico (10)Документ7 страницPráctica 08. Influencia de la temperatura en el equilibrio quÃ_mico (10)iarjcrashОценок пока нет
- Influencia de La Temperatura en El Equilibrio Químico: Experimento 1 ProblemaДокумент4 страницыInfluencia de La Temperatura en El Equilibrio Químico: Experimento 1 Problemaelias2222Оценок пока нет
- Práctica 8 QG2Документ4 страницыPráctica 8 QG2Dianne VanОценок пока нет
- Equilibrio NO2-N2O4Документ4 страницыEquilibrio NO2-N2O4ALEXIS GAEL REBOLLEDO VALENCIAОценок пока нет
- Practica 8Документ7 страницPractica 8Eduardo TrejoОценок пока нет
- Informe 8Документ5 страницInforme 8Ale GaskarthОценок пока нет
- Reporte Práctica 8Документ3 страницыReporte Práctica 8arturo saltivañeОценок пока нет
- Equilibrio químico temperatura NO2 N2O4Документ5 страницEquilibrio químico temperatura NO2 N2O4Luis Piruca MorenoОценок пока нет
- Practica 8Документ4 страницыPractica 8Fernando PilónОценок пока нет
- Práctica 8.SДокумент7 страницPráctica 8.SDaniel MeloОценок пока нет
- Equilibrio QuimicoДокумент3 страницыEquilibrio QuimicoTeresa Cifuentes⃝⃤0% (2)
- Informe 2 QG2Документ10 страницInforme 2 QG2Carlos Cesar Lopez SuarezОценок пока нет
- Trabajo de Laboratoria 7 y 8Документ20 страницTrabajo de Laboratoria 7 y 8Correa Asencios WilliamsОценок пока нет
- Reporte 8 Influencia de La Tem.Документ3 страницыReporte 8 Influencia de La Tem.Andres ImmorminoОценок пока нет
- Practica 6 ReportДокумент3 страницыPractica 6 ReportMayra Janette Jane SkłodowskaОценок пока нет
- Reporte 082Документ10 страницReporte 082Gab OCОценок пока нет
- Reporte Práctica 13. Equilibrio de SolubilidadДокумент14 страницReporte Práctica 13. Equilibrio de SolubilidadAllison VRОценок пока нет
- Informe Quimica Lab 2Документ12 страницInforme Quimica Lab 2Bryan Ronald Beltran QuispeОценок пока нет
- 2023-4-12 - Colegio Universitario Central - TAP 2 - TAM. UNIDAD I. QCAДокумент5 страниц2023-4-12 - Colegio Universitario Central - TAP 2 - TAM. UNIDAD I. QCAsilvina dominguezОценок пока нет
- HGJGHJGHJHJGGДокумент14 страницHGJGHJGHJHJGGLIZBETH AGUILARОценок пока нет
- Repor Práctica 8 Influencia de La TemДокумент3 страницыRepor Práctica 8 Influencia de La TemAlexia LunaОценок пока нет
- INFOQI7Документ3 страницыINFOQI7Roxana MendozaОценок пока нет
- Practica 7 QuimicaДокумент3 страницыPractica 7 Quimicagabrielrs0505Оценок пока нет
- Analisis Cuanti Reporte 2Документ21 страницаAnalisis Cuanti Reporte 2JENIFER NICOLE CATALÁN BARILLASОценок пока нет
- Practica AldehídosДокумент8 страницPractica AldehídosLi ArrataОценок пока нет
- Equilibrio QuimicoДокумент4 страницыEquilibrio QuimicoErwiin DiazОценок пока нет
- QGII Equilibrio QuímicoДокумент4 страницыQGII Equilibrio QuímicoGreys ChuquimarcaОценок пока нет
- Reacciones Redox Laboratorio QuímicaДокумент7 страницReacciones Redox Laboratorio QuímicaJordan OrtizОценок пока нет
- Equilibrio Químico InformeДокумент5 страницEquilibrio Químico InformeIsa BerronesОценок пока нет
- Informe 9Документ16 страницInforme 9Darwin Tapia IzaguirreОценок пока нет
- Informe Lab 5Документ11 страницInforme Lab 5Katherynne Rey AriasОценок пока нет
- Práctica 08. Influencia de La Temperatura en El Equilibrio Químico PDFДокумент7 страницPráctica 08. Influencia de La Temperatura en El Equilibrio Químico PDFAngel PinachoОценок пока нет
- Reporte de Quimica 3Документ8 страницReporte de Quimica 3ClaudiaPalominoZelayaОценок пока нет
- Propiedades Quimicas de La MateriaДокумент10 страницPropiedades Quimicas de La MateriaAdrianaОценок пока нет
- Reacciones Quimicas IДокумент10 страницReacciones Quimicas Iangelito290167% (3)
- Practica de Laboratorio FCQ 2019Документ9 страницPractica de Laboratorio FCQ 2019luis RobertoОценок пока нет
- Informe 7Документ12 страницInforme 7John Fredy TorresОценок пока нет
- Oxidos de NitrogenoДокумент2 страницыOxidos de NitrogenoYorch MonroyОценок пока нет
- Reacciones Químicas Alex 2.0Документ11 страницReacciones Químicas Alex 2.0Alex PerezОценок пока нет
- Lab. Equilibrio Químico..Документ8 страницLab. Equilibrio Químico..Shadia Peña RojasОценок пока нет
- Óxidos de NitrógenoДокумент3 страницыÓxidos de NitrógenoMaddie AvalosОценок пока нет
- Informe de Laboratorio 2Документ7 страницInforme de Laboratorio 2maria rodriguezОценок пока нет
- Practica 08-1Документ45 страницPractica 08-1Nestor SanchezОценок пока нет
- Laboratorio 7Документ17 страницLaboratorio 7Julio Alexander Jimenes MoralesОценок пока нет
- Reacciones Químicas LaboratorioДокумент3 страницыReacciones Químicas LaboratorioLeydy Sullcaray HОценок пока нет
- Laboratorio #6 de Inorganica IДокумент10 страницLaboratorio #6 de Inorganica IJuan Diego TrujilloОценок пока нет
- Reporte 1Документ9 страницReporte 1Henrry QuisocalaОценок пока нет
- Laboratorio EquilibrioДокумент9 страницLaboratorio EquilibrioLuis Angel Trujillo MendozaОценок пока нет
- Propiedades químicasДокумент6 страницPropiedades químicasDANIELA GARCIA POSADAОценок пока нет
- Influencia temperatura equilibrio químicoДокумент11 страницInfluencia temperatura equilibrio químicoAlfre Contreras RamírezОценок пока нет
- Informe de Organica 7Документ11 страницInforme de Organica 7edmundoОценок пока нет
- Solución SólidaДокумент7 страницSolución SólidaMiguel CoriolanoОценок пока нет
- Cap8 Dureza y TemplabiidadДокумент21 страницаCap8 Dureza y TemplabiidadJorge NiñoОценок пока нет
- Compuestos de Coordinación y Algunas de Sus Reacciones en Disolución PREVIOДокумент5 страницCompuestos de Coordinación y Algunas de Sus Reacciones en Disolución PREVIOMiguel Coriolano0% (1)
- Quimica Analítica Práctica 4 Muestra ComercialДокумент5 страницQuimica Analítica Práctica 4 Muestra ComercialMiguel CoriolanoОценок пока нет
- 7-Tecnicas para La Caracterizacion de Materiales 2013-2Документ50 страниц7-Tecnicas para La Caracterizacion de Materiales 2013-2Miguel CoriolanoОценок пока нет
- Determinación de Las Constantes de ResistividadДокумент4 страницыDeterminación de Las Constantes de ResistividadMiguel CoriolanoОценок пока нет
- Migración Iónica (FPE#1)Документ3 страницыMigración Iónica (FPE#1)Miguel CoriolanoОценок пока нет
- Aceros de Distintas ComposicionesДокумент1 страницаAceros de Distintas ComposicionesMiguel CoriolanoОценок пока нет
- Crónica de Le Práctica EyC EspectrofotometríaДокумент1 страницаCrónica de Le Práctica EyC EspectrofotometríaMiguel CoriolanoОценок пока нет
- Quimica Analítica Práctica 4 Muestra ComercialДокумент5 страницQuimica Analítica Práctica 4 Muestra ComercialMiguel CoriolanoОценок пока нет
- Determinaciones Cuantitativas REDOXДокумент5 страницDeterminaciones Cuantitativas REDOXMiguel CoriolanoОценок пока нет
- Practica Enlace Quimico eДокумент9 страницPractica Enlace Quimico eMiguel CoriolanoОценок пока нет
- FMyM Serie 4 2015-2Документ2 страницыFMyM Serie 4 2015-2Miguel CoriolanoОценок пока нет
- Ley de Propagación de IncertidumbreДокумент13 страницLey de Propagación de IncertidumbreMiguel CoriolanoОценок пока нет
- Cuestionario DERECHOДокумент4 страницыCuestionario DERECHOMiguel CoriolanoОценок пока нет
- Efectos Inmediatos Del Paso de La Corriente Eléctrica Sobre El Ser HumanoДокумент3 страницыEfectos Inmediatos Del Paso de La Corriente Eléctrica Sobre El Ser HumanoMiguel CoriolanoОценок пока нет
- Determinación Experimental de Un Conjunto de ResistenciasДокумент5 страницDeterminación Experimental de Un Conjunto de ResistenciasMiguel CoriolanoОценок пока нет
- Práctica PsicologíaДокумент3 страницыPráctica PsicologíaMiguel CoriolanoОценок пока нет
- Determinacià N Experimental de Un Conjunto de ResistenciasДокумент6 страницDeterminacià N Experimental de Un Conjunto de ResistenciasMiguel CoriolanoОценок пока нет
- 005+poesíДокумент6 страниц005+poesíMiguel CoriolanoОценок пока нет
- Prac Reac QuimДокумент10 страницPrac Reac QuimMiguel CoriolanoОценок пока нет
- Estructura de La Materia II EJERCICIOS (Mi Parte)Документ1 страницаEstructura de La Materia II EJERCICIOS (Mi Parte)Miguel CoriolanoОценок пока нет
- USIGLI Rodolfo - El GesticuladorДокумент90 страницUSIGLI Rodolfo - El GesticuladorMiguel Coriolano100% (1)
- Prac - Leyconservacion ChecДокумент6 страницPrac - Leyconservacion ChecMiguel CoriolanoОценок пока нет
- Cuestionario DERECHOДокумент4 страницыCuestionario DERECHOMiguel CoriolanoОценок пока нет
- Prac - Masasrelat CorrMДокумент7 страницPrac - Masasrelat CorrMMiguel CoriolanoОценок пока нет
- Facultad de MedicinaДокумент6 страницFacultad de MedicinaMiguel CoriolanoОценок пока нет
- T2 2009 2 Efectos Termicos Parte 4 Carta de HumedadДокумент14 страницT2 2009 2 Efectos Termicos Parte 4 Carta de HumedadEduardoLalo Mamani0% (1)
- Butilglicol PDFДокумент104 страницыButilglicol PDFClaudia GonzalesОценок пока нет
- Guia Practica para Calcular La Carga Termica de Aire AcondicionadoДокумент10 страницGuia Practica para Calcular La Carga Termica de Aire AcondicionadoJuan Yto MontenegroОценок пока нет
- Capitulo I Conceptos FundamentalesДокумент10 страницCapitulo I Conceptos FundamentalesmarielvabarrosoОценок пока нет
- Práctica 1 Calor Diferencial de SoluciónДокумент7 страницPráctica 1 Calor Diferencial de SoluciónDaniel Ortiz LealОценок пока нет
- Quemador de GasДокумент3 страницыQuemador de GaszkcompОценок пока нет
- Los secretos de El BulliДокумент76 страницLos secretos de El Bullijcrc1972Оценок пока нет
- Un Dispositivo de Cilindro Émbolo Contiene 2Документ2 страницыUn Dispositivo de Cilindro Émbolo Contiene 2Diego JimenezОценок пока нет
- Ley de Enfriamiento de NewtonДокумент11 страницLey de Enfriamiento de NewtonkiloponseОценок пока нет
- Reciclado asfalto guía especificaciónДокумент14 страницReciclado asfalto guía especificaciónoxigeno2010Оценок пока нет
- Bromuro de MetiloДокумент56 страницBromuro de MetiloTomas Ignacio Scagliotti100% (1)
- Apuntes de Fisicoquimica UtemДокумент110 страницApuntes de Fisicoquimica UtemAlan Cereceda EscalonaОценок пока нет
- Y Sin Embargo Se MueveДокумент2 страницыY Sin Embargo Se MueveItzelCariОценок пока нет
- Proyecto Datacenter. GuiaДокумент51 страницаProyecto Datacenter. GuiaEduardo LopezОценок пока нет
- Manual Frecuencimetro Pce fc27 PDFДокумент10 страницManual Frecuencimetro Pce fc27 PDFrosemberg_trujilloОценок пока нет
- Estados de Agregación, Sustancias y Modelos AtómicosДокумент9 страницEstados de Agregación, Sustancias y Modelos AtómicosBarack LeónОценок пока нет
- Manual I StatДокумент144 страницыManual I StatManuel ConchaОценок пока нет
- Arboles Submarinos en Aguas ProfundasДокумент4 страницыArboles Submarinos en Aguas ProfundasLaura Haydee MuñozОценок пока нет
- Códigos de Defecto: Montadora Sistema Nombre BMW Climatización A/C Ihkr 6Документ3 страницыCódigos de Defecto: Montadora Sistema Nombre BMW Climatización A/C Ihkr 6AutoTotal Nafta Y DieselОценок пока нет