Академический Документы
Профессиональный Документы
Культура Документы
Solubilidade Das Substâncias Orgânicas
Загружено:
Dayse MoreiraАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Solubilidade Das Substâncias Orgânicas
Загружено:
Dayse MoreiraАвторское право:
Доступные форматы
Quim. Nova, Vol. 36, No.
8, 1248-1255, 2013
Educao
SOLUBILIDADE DAS SUBSTNCIAS ORGNICAS
Cludia Rocha Martins*, Wilson Arajo Lopes e Jailson Bittencourt de Andrade
Instituto de Qumica, Universidade Federal da Bahia, Campus Universitrio de Ondina, 40170-115 Salvador BA, Brasil
Recebido em 5/12/12; aceito em 13/5/13; publicado na web em 1/7/13
ORGANIC COMPOUND SOLUBILITY. The solubility of organic compounds is a topic of great importance in chemistry and of
interest in several areas, such as materials, drugs and the environment. In this paper, the solubility of these species is discussed in
terms of their properties, such as the predominant type of chemical bond, molecular structure, polarity and types of intermolecular
interactions. Examples of biological processes fundamental for sustainability of life and related with the solubility of chemical species
are presented and discussed.
Keywords: solubility; organic species; polarity.
INTRODUO
A solubilidade um dos temas mais relevantes da rea da qumica, tanto pela sua importncia intrnseca quanto pela variedade de
fenmenos e propriedades qumicas envolvidas no seu entendimento.
Entretanto, os livros texto de Qumica geralmente abordam o tema
de forma superficial ou incompleta, especialmente a solubilidade de
compostos orgnicos. Em artigos anteriores1,2 so feitas consideraes
sobre os princpios relacionados com o processo de solubilizao de
compostos em geral, sendo feita uma discusso detalhada da solubilidade de alguns compostos inorgnicos. O texto a seguir discute as
principais caractersticas das ligaes e estruturas moleculares em
diversas funes orgnicas que tm influncia direta no processo de
dissoluo. Dados quantitativos sobre a solubilidade de compostos orgnicos podem ser encontrados em handbooks3,4 e sites de referncia.5,6
O processo de solubilizao de uma substncia qumica resulta da
interao entre a espcie que se deseja solubilizar (soluto) e a substncia
que a dissolve (solvente), e pode ser definida como a quantidade de
soluto que dissolve em uma determinada quantidade de solvente, em
condies de equilbrio. Solubilidade , portanto, um termo quantitativo. uma propriedade fsica (molecular) importante que desempenha
um papel fundamental no comportamento das substncias qumicas,
especialmente dos compostos orgnicos. A solubilidade de interesse
em diversas reas, por exemplo: materiais, farmacutica e ambiental.
Em particular, na concepo de frmacos, essencial considerar a
solubilidade aquosa, a qual influencia fortemente as propriedades
farmacocinticas, tais como absoro, distribuio, metabolismo e
excreo. Alm disso, o conhecimento da solubilidade necessrio para
a previso do destino ambiental de contaminantes e poluentes, processos de adsoro no solo e fatores de bioconcentrao de agrotxicos.7
A solubilidade de uma substncia orgnica est diretamente
relacionada com a estrutura molecular, especialmente com a polaridade das ligaes e da espcie qumica como um todo (momento de
dipolo). Geralmente, os compostos apolares ou fracamente polares
so solveis em solventes apolares ou de baixa polaridade, enquanto
que compostos de alta polaridade so solveis em solventes tambm
polares, o que est de acordo com a regra emprica de grande utilidade: polar dissolve polar, apolar dissolve apolar ou o semelhante
dissolve o semelhante. A solubilidade depende, portanto, das foras
de atrao intermoleculares que foram documentadas pela primeira
vez por Van der Waals, prmio Nobel de Fsica de 1910.
*e-mail: claudia@ufba.br
Na realidade, bem conhecido que a dissoluo de um slido
ou de um lquido em outro lquido um processo que requer energia
necessria para vencer as atraes existentes entre as molculas que
constituem o soluto, bem como vencer as foras existentes entre
as prprias molculas do solvente. Ou seja, as foras de atrao
entre as molculas do soluto e do solvente devem ser intensas o
suficiente para compensar o rompimento das foras de atrao
entre as molculas do soluto e entre as molculas do solvente.
Assim, o processo de dissoluo de qualquer espcie explicado
de maneira adequada atravs da anlise da energia que surge do
estabelecimento de novas interaes entre soluto e solvente, alm
dos fatores relacionados variao de entropia (DS). Como o fator
entropia favorece a formao das solues, estas sero formadas
se a variao da entalpia que acompanha o processo for negativa,
zero ou fracamente positiva. No entanto, se a variao de entalpia
for muito positiva, a variao da entropia no ser suficiente para
resultar uma variao de energia livre menor que zero, sendo o
processo de dissoluo no espontneo.8
Diversos compostos orgnicos como o etano, C2H6, ou o tetracloreto de carbono, CCl4, apresentam-se comumente como espcies
insolveis em gua e outros solventes polares, uma vez que so espcies apolares. As molculas de gua, fortemente polares, esto unidas
umas s outras por fortes interaes dipolo-dipolo, e as novas foras
atrativas que poderiam se estabelecer entre as molculas de gua e
as molculas de etano ou de tetracloreto de carbono so fracas, no
compensando energeticamente o processo de dissoluo. Por outro
lado, o etanol, C2H5OH, um composto polar, muito solvel em gua,
uma vez que as interaes dipolo-dipolo que se estabelecem entre
as molculas de gua e as de etanol (ligaes de hidrognio) so da
mesma ordem de grandeza das atraes do mesmo tipo existentes
entre as molculas do etanol, bem como entre as molculas de gua.
Em alguns casos, a solubilidade de compostos orgnicos pode
estar relacionada com a ocorrncia de uma reao qumica. Assim,
essa propriedade pode ser dividida em duas categorias: a solubilidade
em que uma reao qumica a fora determinante (por exemplo,
na reao cido-base) e a solubilidade na qual esto envolvidas
somente as foras intermoleculares. O estudo semiquantitativo da
solubilidade de uma substncia em determinados solventes (gua,
ter etlico, soluo diluda de hidrxido de sdio, cido clordrico
diludo, soluo de bicarbonato de sdio, cido fosfrico concentrado
e cido sulfrico concentrado), fornece valiosa informao sobre a
presena ou ausncia de determinados grupamentos funcionais ou
classes de compostos orgnicos.9,10
Vol. 36, No. 8
Solubilidade das substncias orgnicas
Contudo, a solubilidade uma propriedade do sistema soluto/
solvente que admite graus e muito dependente da temperatura.
Assim, para se utilizar o ensaio de solubilidade como um elemento
de corte para obter-se informaes sobre grupamentos funcionais,
necessrio observar um valor (padro) acima do qual a substncia
considerada solvel e, abaixo do qual, considerada insolvel
(valor de corte). Para fins de classificao em esquemas de Anlise
Orgnica Sistemtica, esse valor foi definido como sendo 3% pv (trs
partes em peso do substrato por cem partes em volume de solvente).
Os ensaios de solubilidade so extremamente teis para se verificar
a polaridade relativa de substncias orgnicas, identificar a classe
funcional e, tambm, para determinar os solventes (ou mistura de
solventes) apropriados nas recristalizaes, reaes qumicas, anlises
espectrais e anlises cromatogrficas.9,11,12
CARACTERSTICAS GERAIS DAS MOLCULAS
ORGNICAS
As estruturas tridimensionais das molculas orgnicas desempenham papel fundamental na determinao de suas propriedades
qumicas e fsicas. Tendo o carbono quatro eltrons de valncia
([He]2s22p2), ele forma quatro ligaes em seus compostos, podendo
ser ligaes simples, onde os pares de eltrons so dispostos em um
arranjo tetradrico segundo o modelo da repulso do par de eltrons
no nvel de valncia (RPENV).13 De acordo com o modelo da hibridizao, os orbitais 2s e 2p formam quatro orbitais hbridos do tipo
sp3, com ngulo de 109,5 e geometria tetradrica. Se ocorrer uma
ligao dupla, o arranjo espacial em torno do tomo do carbono ser
trigonal plano (hibridizao sp2), com ngulo de aproximadamente
120, e no caso de ocorrer uma tripla ou duas ligaes duplas, o
arranjo ser linear (hibridizao sp), com ngulo de 180. Modelos
moleculares com as trs geometrias comuns ao redor do tomo de
carbono podem ser vistos na Figura 1.
1249
os valores de eletronegatividade so: carbono (EN = 2,55); hidrognio (EN = 2,20); e cloro (EN = 3,16).13 Assim, as ligaes C-Cl so
polares, j que o cloro, sendo bem mais eletronegativo, atrai mais
fortemente os eltrons. Dependendo da soma vetorial dos momentos
de dipolo das ligaes individuais, uma determinada molcula poder
ser polar ou apolar. Para determinadas geometrias, o momento de
dipolo resultante ser nulo e a molcula ser apolar.
Na Tabela 1 podem ser vistos os valores de momentos de dipolo
() de alguns compostos orgnicos.14 Para efeito de comparao,
gua e amnia, substncias inorgnicas polares, bem como cloreto
de sdio (com carter de ligao predominantemente inico), foram
inseridos na tabela.
Tabela 1. Momentos de dipolo () de alguns compostos
Substncia
(D)
Substncia
(D)
NaCl
9,0
NH3
1,47
CH3Cl
1,87
CH4
H2O
1,85
CCl4
CH3OH
1,70
CH3CH3
1,50
C6H6
CH2=N =N
+
Como pode ser observado, substncias como o clorometano
(CH3Cl) e o metanol (CH3OH) possuem valores de momento de dipolo
prximos ao da gua, enquanto espcies como metano (CH4), etano
(C2H6), tetracloreto de carbono (CCl4) ou benzeno (C6H6) exibem
valores iguais a zero. Em razo da simetria das ltimas, as polaridades individuais das ligaes se cancelam, resultando em molculas
apolares, com momento de dipolo igual a zero.
Alm dos haloalcanos e dos lcoois, espcies tais como teres,
aminas, tiis e sulfetos tm tambm tomo de carbono ligado a tomo
mais eletronegativo: oxignio, nitrognio ou enxofre, o que confere
polaridade s ligaes. Os alcois possuem tomo de carbono ligado
a um oxignio do grupo hidroxila (-OH); os teres, dois tomos de
carbono ligados ao mesmo tomo de oxignio; as aminas, um, dois
ou trs tomos de carbono ligados a um tomo de nitrognio; os
tiis, um tomo de carbono ligado a um grupo S-H; e os sulfetos,
dois tomos de carbono ligados a um mesmo tomo de enxofre. As
ligaes so polares, resultando em cargas parciais positivas sobre os
tomos de carbono (+) e cargas parciais negativas (-) sobre o tomo
mais eletronegativo (Figura 2).
Figura 1. Modelos de hibridizao do tomo de carbono e geometrias
espaciais
O carbono apresenta uma propriedade excepcional de ligar-se a
outros tomos de carbono, atravs de ligaes fortes (simples, duplas
ou triplas), formando cadeias ou anis de tomos de carbono, originando uma grande variedade de molculas. Sabe-se que o nmero
de compostos orgnicos conhecidos milhares de vezes o nmero de
compostos inorgnicos. O carbono forma tambm ligaes fortes com
outros elementos qumicos, especialmente com H, O, N e halognios.
As ligaes C-C formam a espinha dorsal da molcula, enquanto que
as ligaes C-H, presentes em quase todas as molculas, se localizam
na superfcie, uma vez que o hidrognio capaz de formar apenas
uma ligao covalente. Assim, as molculas orgnicas apresentam
tanto ligaes covalentes apolares como ligaes covalentes polares,
que resultam do compartilhamento desigual de eltrons, devido
diferena de eletronegatividade entre os tomos ligantes.
As ligaes C-H, bastante comuns nessas molculas, so relativamente apolares, uma vez que carbono e hidrognio apresentam
valores muito prximos para eletronegatividade. Na escala de Pauling
Figura 2. Ligaes covalentes polares e cargas parciais
Outro tipo de ligao presente em algumas das funes mais
importantes da qumica orgnica a ligao dupla carbono-oxignio,
C=O (grupo carbonila). O tomo de carbono do grupo carbonila exibe uma carga parcial positiva (+) e o tomo de oxignio uma carga
parcial negativa (-). Na Figura 3 esto representadas as estruturas
de algumas funes caboniladas: aldedo, cetona, cido carboxlico
e ster.
Em todos os casos, a polaridade da molcula, que medida pelo
seu momento de dipolo (), vai depender da soma vetorial dos momentos relacionados com as ligaes polares individuais, estando,
portanto, relacionada tambm com a disposio espacial dos tomos
e com a presena de eltrons no ligantes.
1250
Martins et al.
Figura 3. Grupo carbonila e funes orgnicas
DISCUTINDO A SOLUBILIDADE DE SUBSTNCIAS
ORGNICAS
Solues de solutos apolares em solventes apolares representam o
processo mais simples em termos de dissoluo. As foras envolvidas
nas interaes soluto-soluto, solvente-solvente e soluto-solvente so
todas interaes relativamente fracas (foras de disperso de London),
levando a mistura formao de uma nica fase. Tais solues so
chamadas solues ideais, sendo a entalpia da soluo H = 0, e
temperatura constante a variao da energia livre ser funo do termo
relativo variao de entropia.8
G = H - TS
G = -TS (H = 0)
Equao 1
Equao 2
A explicao para a insolubilidade de espcies apolares em
solventes polares como a gua pode ser menos aparente, em funo
das fracas foras existentes geralmente entre as molculas do soluto.
No entanto, as interaes entre molculas do soluto e do solvente
tambm sero fracas, no resultando energia suficiente para separar
as prprias molculas do solvente, ou seja, as molculas do solvente
apresentaro maior tendncia a permanecer associadas, e o processo
de solubilizao no ocorre.
Hidrocarbonetos
Devido ao grande nmero de compostos orgnicos constitudos
atravs da presena de ligaes C-H (fracamente polares) e simetria dos arranjos formados em torno dos tomos de carbono, estes
formam um grande nmero de espcies, cujos momentos de dipolo
resultantes so iguais a zero ou prximos de zero. Nesse grupo
esto incluidos os hidrocarbonetos saturados (somente ligaes
C-C simples) de cadeia aberta, como os alcanos, de frmula geral
CnH2n+2, ou os cicloalcanos, que apresentam anis de carbono, de
frmula geral CnH2n (para um anel), CnH2n-2 (para sistemas cclicos
de dois anis) e assim por diante. As foras de disperso de London
que mantm as molculas unidas aumentam com o crescimento
do tamanho da molcula, o que leva, geralmente a um decrscimo
na solubilidade. Por serem apolares, os alcanos e cicloalcanos so
pouco solveis em solventes polares como a gua, sendo solveis
em solventes apolares ou de baixa polaridade como o ter. Na Tabela
2 esto apresentadas as solubilidades de alguns alcanos de cadeia
aberta nos solventes gua, etanol e ter.4
Quim. Nova
Os alcanos e cicloalcanos, sendo compostos no polares, so usados como solventes para dissoluo de outras substncias no polares,
como matria-prima na indstria para a sntese de outros compostos
orgnicos e, tambm, como combustveis. Esses hidrocarbonetos so
encontrados no petrleo e no gs natural, sendo o ltimo constitudo
principalmente de metano, CH4.
Os hidrocarbonetos insaturados, cujas molculas possuem ligaes mltiplas, como alcenos (C=C) e alcinos (CC), tambm so
compostos no polares ou levemente polares, sendo portanto pouco
solveis em solventes polares como a gua. Esse mesmo princpio se
aplica a outra classe de hidrocarbonetos chamados hidrocarbonetos
aromticos, constitudos por estruturas cclicas insaturadas, sendo o
mais simples desses o benzeno, C6H6 (Figura 4).
Figura 4. Diferentes representaes da estrutura do benzeno
Por outro lado, estudos recentes comprovaram experimentalmente
a formao de ligao entre a nuvem do benzeno (e de outros aromticos) e o hidrognio da molcula de gua, evidenciando assim a
formao de uma ligao de hidrognio do tipo .15 A converso de
uma ligao de hidrognio gua-gua (Figura 5a) em uma ligao
de hidrognio gua-benzeno (nuvem ) (Figura 5b) favorecida pela
entropia (S > 0), mas desfavorecida pela entalpia (H > 0). Apesar
de incomum, este tipo de ligao pode ter relevncia em processos
biolgicos.15 importante ressaltar que a interao eletrons - hidrognio no afeta a solubilidade do benzeno em gua (0,07g/100g
de H2O a 23oC),4 portanto, o seu comportamento o apresentado,
em geral, pelos hidrocarbonetos: pouco solveis em gua e solveis
em solventes apolares.
Figura 5. Representao da ligao de hidrognio
lcoois e fenis
Os lcoois, compostos com um grupo funcional OH ligado a
tomo de carbono saturado, apresentam-se solveis em solventes
polares, devido associao decorrente das ligaes de hidrognio.
Assim, enquanto os hidrocarbonetos tais como metano, etano e propano so pouco solveis em gua, os lcoois de cadeias menores (at
3 tomos de carbono) metanol, etanol e propanol so infinitamente
solveis em gua (totalmente miscveis), resultado da forte ligao
de hidrognio entre gua e lcool (Figuras 6 e 7).
Tabela 2. Solubilidade de alguns alcanos4
Substncia
Solubilidade (g / 100 g)
Nome
Frmula condensada
gua
lcool
ter
Hexano
CH3CH2CH2CH2CH2CH3
0,014 (15 C)
50 (33 C)
Infinito*
Heptano
CH3CH2CH2CH2CH2CH2CH3
0,005 (15 C)
pouco solvel
Infinito
Octano
CH3CH2CH2CH2CH2CH2CH2CH3
0,002 (16 C)
pouco solvel
Solvel
Nonano
CH3CH2CH2CH2CH2CH2CH2CH2CH3
Insolvel
pouco solvel
Solvel
*Infinito indica que a substncia completamente miscvel no solvente.
Solubilidade das substncias orgnicas
Vol. 36, No. 8
Figura 6. Representao do processo de solubilidade em gua
Figura 7. Representao da ligao de hidrognio entre lcoois e gua
Na Tabela 3 podem ser vistos valores de solubilidade para uma
srie de lcoois, em gua e em hexano.
1251
lcoois em hexano apresenta comportamento distinto: exceto metanol,
os demais lcoois referidos so totalmente miscveis.
A solubilidade dos lcoois depende tambm do arranjo espacial
da molcula. Por exemplo, a posio do grupo OH em lcoois
(primrio, secundrio ou tercirio) pode levar a diferenas nas foras intermoleculares e, portanto, interferir nas propriedades fsicas
(Tabela 3). Assim, o lcool n-butlico, CH3(CH2)2CH2OH, apresenta
temperatura de ebulio igual a 118 C e solubilidade de 7,9g/100g
de H2O, enquanto os ismeros, lcool s-butlico, e t-butlico apresentam temperaturas de ebulio mais baixas (respectivamente 99,5 C
e 83,0C) e solubilidades mais altas (respectivamente 12,5g/100g
de H2O e completamente miscvel).16
Os fenis tem o grupo OH ligado a um tomo de carbono de um
anel aromtico e apresentam propriedades distintas dos lcoois. Da
mesma forma que os lcoois, os fenis formam ligao de hidrognio com a gua. Contudo, devido ao nmero elevado de tomos de
carbono, os fenis tm solubilidade limitada em gua, mas maior do
que a solubilidade de lcoois alifticos de tamanho/massa molecular
similar. Por exemplo, o fenol tem a solubilidade de 8,0 g/100g de
H2O enquanto o hexanol tem a solubilidade de 0,6g/100g de H2O
(Figura 9).5 A explicao para esse fato est relacionada com a maior
acidez dos fenis (pKa ~ 10) quando comparada com a acidez dos
lcoois (pKa ~16).
Tabela 3. Solubilidade de alguns lcoois em gua e hexano13,16
Substncia
Solubilidade
(g/100g de solvente)
Nome
Frmula condensada
gua*
Hexano
Metanol
CH3OH
Infinito
3,8
Etanol
CH3CH2OH
Infinito
Infinito
Propanol
CH3CH2CH2OH
Infinito
Infinito
n-Butanol
CH3CH2CH2CH2OH
7,9
Infinito
s-Butanol
CH3CH(OH)CH2CH3
12,5
Infinito
t-Butanol
(CH3)3COH
Infinito
Infinito
n-Pentanol
CH3CH2CH2CH2CH2OH
2,3
Infinito
n-Hexanol
CH3CH2CH2CH2CH2CH2OH
0,6
Infinito
0,2
Infinito
n-Heptanol CH3CH2CH2CH2CH2CH2CH2OH
Figura 9. Representao da ligao de hidrognio entre gua e fenol e solubilidades de fenol e hexanol em gua
Em alguns fenis orto-substitudos (como por exemplo, com o
grupo nitro) possvel ocorrer a formao de ligao de hidrognio
intramolecular. A presena desta ligao dificulta o processo de
solubilizao em gua uma vez que reduz a possibilidade de formao
de ligao de hidrognio intermolecular do tipo gua-fenol. Por outro
lado, a ligao de hidrognio intramolecular contribui para o aumento
da volatilidade do ismero orto que, assim, apresenta temperatura de
ebulio mais baixa que o ismero para (Figura 10). 5
* em g de lcool / 100 g de solvente a 20 C; Infinito indica que a substncia
completamente miscvel no solvente.
A solubilidade de lcoois em gua diminui com o aumento da cadeia carbnica. Quando a cadeia carbnica (hidrofbica) aumenta, ela
se torna a parte mais significativa da molcula e a substncia qumica
se torna cada vez menos solvel, ou seja, tende a se comportar, cada
vez mais, como um hidrocarboneto. Nesse caso, a formao de ligaes de hidrognio lcool-gua no consegue compensar as ligaes
de hidrognio gua-gua, que precisam ser rompidas para que ocorra
o processo de dissoluo (Figura 8). Por outro lado, a solubilidade dos
Figura 8. Ligao de hidrognio entre butanol e gua
Figura 10. Representao da ligao de hidrognio intramolecular em fenis
teres, aldedos e cetonas
Os teres (R-O-R), os aldedos (R-CO-H) e as cetonas (R-CO-R)
constituem compostos nos quais no h possibilidade da formao das
ligaes de hidrognio, quando puros. No entanto, essas interaes
intermoleculares so formadas quando um composto adicionado
a um solvente como a gua. Devido formao das ligaes de hidrognio durante o processo de dissoluo, as solubilidades dessas
classes de compostos so comparveis s solubilidades dos lcoois:
compostos com massas moleculares baixas podem ser completamente
miscveis em gua, sendo bastante solveis aqueles com at 4 tomos
de carbono (Tabela 4). De maneira similar aos demais compostos, a
solubilidade tambm diminui com o aumento da cadeia carbnica.
1252
Martins et al.
Quim. Nova
Tabela 4. Solubilidade de algumas espcies em gua5
Funo
Substncia
Estrutrura
N de tomos de C
lcool
Butanol
CH3CH2CH2CH2OH
8,0 (20 C)
ter
ter etlico
CH3CH2OCH2CH3
6,9 (20 C)
Aldedo
Butanal
CH3CH2CH2CHO
7,1 (25 C)
Cetona
Butanona
CH3COCH2CH3
29,0 (20C)
O ter dietlico e o ter cclico tetraidrofurano (Figura 11) so
usados comumente como solventes em reaes orgnicas. As cetonas
tambm so muito utilizadas como solventes, sendo a propanona
CH3COCH3, tambm chamada acetona, a mais utilizada. A propanona
uma espcie completamente miscvel em gua e dissolve uma grande
variedade de compostos orgncos.
Solubilidade (g/100mL H2O)
sua menor acidez (pKa ~ 10) quando comparada com os cidos carboxlicos (Figura 13b). J os lcoois insolveis em gua, por serem
menos cidos (pKa ~16), no se dissolvem em soluo aquosa de
bicarbonato de sdio nem de hidrxido de sdio.19,20
Figura 13. Formao de sal solvel em gua
Figura 11. Estruturas de teres e representao da ligao de hidrognio
steres
cidos carboxlicos
Os cidos carboxlicos, de frmula R-CO2H, tambm contendo
grupo carbonila, so altamente associados no estado lquido, uma vez
que, nesse caso, as ligaes de hidrognio se formam no composto
puro. Devido formao das ligaes de hidrognio tambm quando
misturados gua, as solubilidades dos cidos de cadeia curta em gua
so altas. cidos com at quatro tomos de carbono so miscveis
com a gua em qualquer proporo,17 enquanto que, para os cidos de
cadeia maior, a solubilidade decresce devido ao fato da cadeia carbnica se tornar a parte mais significativa da molcula. Assim, o cido
pentanico CH3(CH2)3CO2H apresenta uma solubilidade de 1g/30g
de H2O, enquanto o cido decanico CH3(CH2)8CO2H apresenta uma
solubilidade de apenas 0,015g/100g de H2O.18,19
interessante observar que os cidos carboxlicos so tambm
relativamente solveis em solventes imiscveis em gua, como clorofrmio, porque se dissolvem como dmeros (Figura 12).
Os steres, de frmula geral R-CO-OR, tambm apresentam o
grupo carbonila, sendo que os steres formiato de metila (HCO2CH3)
e formiato de etila (HCO2CH2CH3) so solveis em gua, resultado
da ligao intermolecular entre o hidrognio da gua e o oxignio
carbonlico.17 De maneira semelhante aos demais compostos, a solubilidade diminui medida que a massa molecular aumenta.
As gorduras animais e leos vegetais so constituidas de estres
de cidos carboxlicos com cadeias carbnicas longas e o lcool
1,2,3-propanotriol, tambm chamado de glicerol. Na Figura 14 est
representada a molcula do ster (triacilglicerol) formado a partir
de cido esterico e glicerol. As gorduras e leos, sendo compostos
com cadeias carbnicas longas e, por isso de natureza apolar, so
insolveis em gua e solveis em solventes apolares.
Figura 14. Molcula do ster do cido esterico e glicerol
Figura 12. Representao da estrutura do dmero do cido etanico
A maioria dos cidos carboxlicos no substituidos tem valores de
Ka na faixa de 10-4 a 10-5 (pKa = 4 a 5) e so cidos moderadamente
fortes.19,20 Devido a essa propriedade cida, a solubilidade dessa classe
de compostos pode ser fortemente modificada ao reagir com uma
base. Por exemplo, o cido benzico, um cido carboxlico pouco
solvel em gua, ao reagir com bicarbonato de sdio transformado
em um carboxilato (uma espcie inica) que muito solvel em gua
(Figura 13a). Os fenis insolveis em gua dissolvem-se em soluo
aquosa de hidrxido de sdio, mas (exceto alguns nitrofenis) no
se dissolvem em soluo aquosa de bicarbonato de sdio devido a
A hidrlise de um triacilglicerol em presena de uma base chamada comumente de reao de saponificao, pois um dos produtos
um sabo (que sal de cido graxo). Os sabes mais comuns so sais de
sdio ou potssio, como por exemplo o estearato de sdio (Figura 15).
A extremidade carboxlica do sabo altamente hidroflica e por
isso tende a interagir com a gua enquanto a cadeia carbnica longa
(hidrofbica) tende a interagir com substncias de natureza apolar.
Essa estrutura permite a estabilizao de gotas de leo em gua,
que normalmente se separariam formando uma camada oleosa na
superfcie (Figura 16).
Aminas
As aminas podem ser consideradas como derivadas da amnia,
Vol. 36, No. 8
Solubilidade das substncias orgnicas
1253
Por outro lado, um maior nmero de grupos OH em uma cadeia
carbnica implica no incremento das ligaes de hidrognio entre o
soluto e a gua, aumentando a solubilidade. Assim, a alta solubilidade
da sacarose e de outros acares em gua resultado do maior nmero
de ligaes de hidrognio do tipo soluto-solvente. Na Figura 18 pode
ser observada a representao de unidades moleculares da glicose e
da frutose, cada uma contendo cinco grupos OH, o que faz com que
as molculas apresentem alta solubilidade em gua (glicose: 83 g/100
mL de H2O a 17,5oC).13
Figura 15. Reao de saponificao
Figura 18. Estruturas da sacarose, glicose e frutose
Um cristal de acar (sacarose) contm muitas molculas que so
mantidas unidas pelas ligaes de hidrognio. Em gua, as molculas
de sacarose estabelecem novas ligaes de hidrognio (soluto solvente) desfazendo as ligaes com as outras molculas de sacarose
(Figura 19). O resultado a dissoluo da sacarose em gua, formando uma soluo. A solubilidade s possvel devido s ligaes de
hidrognio formadas entre o soluto (sacarose) e o solvente (gua).
Figura 16. Representao do processo de estabilizao leo gua
NH3, pela substituio de um ou mais tomos de hidrognio por
grupos alquila, originando aminas primrias, secundrias e tercirias.
Como o tomo de nitrognio menos eletronegativo que o oxignio,
as ligaes de hidrognio nas aminas primrias e secundrias so
mais fracas do que nos lcoois de massa molecular comparvel e,
portanto, a tendncia apresentarem pontos de ebulio mais baixos
do que esses. No entanto, aminas de todos os tipos podem se ligar
gua por ligao de hidrognio. As aminas de massa molecular menor
so, portanto, espcies altamente solveis em gua. Por exemplo, a
etilamina CH3CH2NH2 completamente miscvel em gua e a trietilamina (CH3CH2)3N tem uma solubilidade igual a 13,3 g/100mL
de H2O a 20C.5
Aminas da alta massa molecular so geralmente insolveis em
gua. Contudo, devido ao seu carter bsico, podem ser convertidas
em sais solveis em gua pela reao com cidos (Figura 17). Esta
propriedade muito importante na concepo de frmacos pois a
solubilidade em gua um fator primordial na absoro, distribuio
no organismo e excreo urinria.
Figura 19. Representao simplificada da dissoluo de sacarose em gua
SOLUBILIDADE E PROCESSOS BIOLGICOS
Outros compostos
As diversas funes orgnicas originam um vasto conjunto de
molculas complexas, as quais esto presentes nos organismos vivos.
Para que a vida se mantenha, tais molculas participam de diversos
processos, muitas vezes governados pelas solubilidades das espcies envolvidas. A seguir so citados alguns exemplos de processos
qumicos diretamente relacionados solubilidade de substncias em
lquidos biolgicos.
O colesterol uma biomolcula muito importante e pode, funcionalmente, ser classificada como um lcool (Figura 20). Por tratar-se
de uma molcula relativamente grande, com apenas um grupo OH,
o colesterol, ao contrrio de compostos como o metanol e o etanol,
apenas pouco solvel em gua (0,26 g/100 mL),13 podendo depositar nas paredes de veias e artrias, contribuindo para problemas
cardiovasculares nos seres vivos. Por outro lado, o colesterol uma
substncia imprescindvel vida, sendo um importante constituinte
Nos processos de solubilizao de solutos polares em gua, a ligao de hidrognio entre soluto e solvente um fator determinante na
solubilidade e a regra geral o semelhante dissolve o semelhantedeve
ser usada com cuidado. Assim, o etanol (C2H5OH) mistura-se com
gua em todas as propores enquanto o cloreto de etila (C2H5Cl), que
possui quase o mesmo momento dipolar, praticamente insolvel em
gua.17 Dessa forma, a maior parte dos haloalcanos tendem a ser pouco
solveis em gua e mais solveis em solventes de baixa polaridade.
Figura 20. Diferentes representaes da estrutura do colesterol
Figura 17. Formao de sal solvel em gua
1254
Martins et al.
das paredes celulares e precursor de hormnios esterides.
A solubilidade das vitaminas em diferentes partes do corpo humano est diretamente relacionada com suas respectivas estruturas
qumicas. As vitaminas B e C so solveis em gua (hidrosolveis)
e as vitaminas A, D, E e K so solveis nos tecidos adiposos (liposolveis). Por serem solveis em gua, as vitaminas B e C no
so armazenadas no organismo e, portanto, devem ser ingeridas
diariamente. Ao contrrio, as vitaminas liposolveis (A, D, E e K)
so armazenadas nos tecidos, permanecendo no organismo mesmo
aps um longo perodo sem a ingesto das mesmas. As diferenas
nas solubilidades podem ser explicadas pelas estruturas moleculares
e pelo nmero de grupos OH. A vitamina A (retinol) um lcool com
uma cadeia carbnica longa, massa molar = 286,45 g/mol e somente
um grupo OH. Como o grupo OH constitui uma parte muito pequena
da molcula, o retinol pode ser considerado como uma substncia
pouco polar. J a vitamina C pode ser considerada com uma substncia polar, pois possui uma estrutura menor e um maior nmero
de grupos OH. Esses e os outros tomos de oxignio na molcula
podem interagir com as molculas da gua, atravs das ligaes de
hidrognio, contribuindo para aumentar a solubilidade (Figura 21).13
Quim. Nova
veiculares e outros processos) e apresentam potencial atividade
mutagnica e cancergena.21,22
Figura 23. Representao simplificada do metabolismo do BaP
A anemia falciforme, uma doena gentica, caracterizada pela
malformao das hemcias, que assumem forma semelhante a foices (de onde vem o nome da doena). A deformao das hemcias
causada por molculas de hemoglobina presentes no sangue que
apresentam uma variao em suas estruturas. As molculas de hemoglobina normais apresentam em sua constituio um aminocido, cuja
cadeia lateral termina com um grupo polar (hidroflico), permitindo a
sua estabilizao no meio aquoso na forma coloidal. Nas molculas
de hemoglobina de portadores deste tipo de anemia, a cadeia lateral
apolar (hidrofbica), o que faz com que essas molculas defeituosas
se agreguem, formando estruturas maiores que cristalizam no interior
das hemcias, provocando a distoro das clulas que passam a ter
a forma de foice (Figura 24).13
Figura 21. Representao das estruturas da vitamina A e da vitamina C
Para que as vitaminas lipossolveis sejam absorvidas durante o
processo de digesto, a vescula biliar produz substncias que tm
estrutura qumica semelhante ao estearato de sdio, ou seja, uma extremidade polar (hidroflica) e outra extremidade apolar (hidrofbica).
Essas espcies interagem com as gorduras presentes no intestino,
formando uma emulso, e permitindo a digesto e a absoro das
vitaminas lipossolveis.
Muitas substncias apolares e insolveis ou pouco solveis em
gua, quando absorvidos pelo organismo geralmente so transformadas (metabolizadas) em compostos mais polares visando a excreo
renal. O benzeno, um composto reconhecidamente carcinognico
e que causa efeitos prejudiciais sade humana, uma substncia
onipresente na atmosfera devido s contribuies de emisses biognicas e, principalmente, antrpicas. O metabolismo do benzeno,
um composto lipossolvel, ocorre principalmente no fgado. O
benzeno (apolar) transformado em benzeno epxido e a partir
deste intermedirio so formados diversos compostos hidrossolveis,
principalmente o fenol (mais polar), que so excretados pela urina21
(Figura 22).
Figura 24. Representao de parte da estrutura de molculas de hemoglobina
CONCLUSES
A solubilidade das espcies orgnicas em solventes polares ou
apolares, de uma maneira geral, est relacionada com a polaridade
do soluto e do solvente em questo. Solutos apolares em solventes
tambm apolares formam as solues chamadas ideais, uma vez que
todas as interaes envolvidas no processo so interaes fracas e
possuem a mesma ordem de grandeza (foras de London).
A anlise dos coeficientes de solubilidade de solutos polares em
solventes tambm polares, levando em conta o valor do momento
de dipolo das espcies, deve ser feita com cautela. Compostos apresentando valores iguais para o momento de dipolo podem exibir
solubilidades bem distintas em solventes como a gua, em funo da
possibilidade ou no, da formao de ligaes de hidrognio entre o
soluto e o solvente, o que afeta fortemente a solubilidade.
Muitos processos biolgicos podem estar diretamente relacionados com a solubilidade das substncias orgnicas, uma vez que essas
podem ser apolares ou fracamente polares e portanto liposolveis, ou
se apresentar polares - com possibilidade de formao das ligaes
de hidrognio - o que as tornam altamente solveis na fase aquosa.
AGRADECIMENTOS
Figura 22. Representao simplificada do metabolismo do benzeno
Em outro exemplo, a eliminao do Benzo[a]pireno (BaP) pelo
corpo humano envolve formao de epxidos e, posteriormente, de
compostos poliidroxilados (mais solveis em gua) que so mais
facilmente eliminados pela via urinria (Figura 23). O BaP e outros
hidrocarbonetos policclicos aromticos (HPA) esto presentes na
atmosfera principalmente de grandes cidades, so formados em
processo de combusto incompleta da matria orgnica (emisses
Os autores agradecem aos professores S. do D. Cunha e P. A.
de P. Pereira pelas valiosas sugestes, FAPESB e CNPq (INCT de
Energia e Ambiente) pelo apoio financeiro.
REFERNCIAS
1. Silva, L. A.; Martins, C. R.; de Andrade, J. B.; Quim. Nova 2004, 27,
1016.
Vol. 36, No. 8
Solubilidade das substncias orgnicas
2. Martins, C. R.; Silva, L. A.; de Andrade, J. B.; Quim. Nova 2010, 33,
2283.
3. Haynes, W. M. (Editor). CRC Handbook of Chemistry and Physics, 91st
ed., CRC Press: Cleveland, 2010-2011.
4. Perry, R. H.; Chilton, C. H.; Chemical Engineers Handbook, 7th ed.,
McGraw-Hill: EUA, 1997.
5. http://www.chemicalbook.com/, acessada em Junho 2013.
6. http://srdata.nist.gov/solubility/, acessada em Junho 2013.
7. Katritzky, A. R.; Kuanar, M.; Slavov, S.; Hall, C. D.; Chem. Rev. 2010,
110, 5714.
8. Huheey, J. E.; Kelter, E. A.; Kelter, R. L.; Inorganic Chemistry: Principles of Struture and Reactivity, 4th ed., Harper Collins College Publishers: New York, 1993.
9. Costa Neto, C.; Anlise Orgnica: Mtodos e Procedimentos para a
Caracterizao de Organoqumios, Editora UFRJ: Rio de Janeiro, 2004.
10. Pavia, D. L.; Lampman, G. M.; Kriz, G. S.; Engel. R. G.; Qumica
Orgnica Experimental, 3a ed., Cengage Learning: So Paulo, 2012.
11. Vogel, A. I.; Qumica Orgnica: anlise orgnica qualitativa, 1a ed., Ao
Livro Tcnico: Rio de Janeiro, 1983.
12. Shriner, R. L.; Fuson, R. C.; Curtin, D. Y.; Morrill, T. C.; Identificao
Sistemtica dos Compostos Orgnicos, 6a ed., Guanabara Dois: Rio de
Janeiro, 1983.
1255
13. Bronw, L. S.; LeMay, H. E..; Bursten, B. E.; Qumica A Cincia Central,
9a ed., Pearson Education do Brasil: So Paulo, 2007.
14. McMurry, J.; Qumica Orgnica, 7a ed., Cengage Learning: So Paulo,
2011.
15. Gierszal, K. P.; Davis, J. G.; Hands, M. D.; Wilcox, D. S.; Slipchenko,
L. V.; Ben-Amotaz, D.; J. Phys. Chem. Lett. 2011, 2, 2940.
16. Morrison, R.; Boyd, R.; Qumica Orgnica, 13a ed., Fundao Calouste
Gulbenkian: Lisboa, 1996.
17. Russel, J. B.; Qumica Geral, 2a ed., Makron Books: So Paulo, 1994.
18. Constantino, M. G.; Qumica Orgnica - Curso Bsico Universitrio,
LTC: Rio de Janeiro, 2012.
19. Bruice, P. Y.; Qumica Orgnica, 4a ed., Prentice Hall: So Paulo, 2006.
20. Solomons, T. W. G.; Fryhle, C. B.; Qumica Orgnica, 10a ed., LTC: Rio
de Janeiro, 2012.
21. Coutrim, M. X.; de Carvalho, L. R. F.; Arcuri, A. S. A.; Quim. Nova
2000, 23, 653.
22. Lopes, W. A.; de Andrade, J. B; Quim. Nova 1996, 19, 497.
Вам также может понравиться
- Teorias BehavioristasДокумент12 страницTeorias BehavioristasCornélio Eugénio MarqueleОценок пока нет
- 3-RenascimentoCultural e CientificoДокумент21 страница3-RenascimentoCultural e CientificoPaulo AndradeОценок пока нет
- Folheto Crisma 1Документ2 страницыFolheto Crisma 1Murilo Vilas BoasОценок пока нет
- O Guardador de Rebanhos IiДокумент2 страницыO Guardador de Rebanhos IiAna PaivaОценок пока нет
- Catalogo Tecnico-Ecoline 2.5 e SGT-Ed 05 Junho23 01 RD 1111Документ174 страницыCatalogo Tecnico-Ecoline 2.5 e SGT-Ed 05 Junho23 01 RD 1111vendasОценок пока нет
- JW1 - Projeto Executivos - Pontos Elétricos e Hidráulicos WilkeДокумент6 страницJW1 - Projeto Executivos - Pontos Elétricos e Hidráulicos WilkeJean silvaОценок пока нет
- Patologias Do Sistema Cardio Vascular - ResumoДокумент21 страницаPatologias Do Sistema Cardio Vascular - ResumoGuilherme Oliveira Bjj100% (1)
- Medieval - IIДокумент199 страницMedieval - IIDaniel RodrigueОценок пока нет
- Questo Es - Qui Mica Ba Sica - Parte 1Документ8 страницQuesto Es - Qui Mica Ba Sica - Parte 1Manoele DominicОценок пока нет
- Montando Um Descarregador de CapacitoresДокумент4 страницыMontando Um Descarregador de CapacitoresriofelizОценок пока нет
- 6P PDFДокумент9 страниц6P PDFChristian RafaelОценок пока нет
- 20 Hábitos para Desenvolvimento Pessoal e ProfissionalДокумент23 страницы20 Hábitos para Desenvolvimento Pessoal e Profissionalanon_38127560100% (3)
- O Patrimônio Da Arquitetura Vernacular de Povos CaiçarasДокумент2 страницыO Patrimônio Da Arquitetura Vernacular de Povos CaiçarasLucas ViniciusОценок пока нет
- 73 78Документ6 страниц73 78Thiago AguiarОценок пока нет
- Referencial de Competências-Chave NS STCДокумент21 страницаReferencial de Competências-Chave NS STCnuno.jose.duarte100% (1)
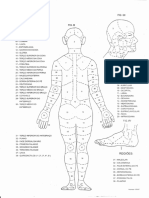
- Topografia Corpo HumanoДокумент2 страницыTopografia Corpo Humanoestevaocanan100% (9)
- A Importância Do Sódio No Manejo Nutricional de Cães e Gatos CardiopatasДокумент7 страницA Importância Do Sódio No Manejo Nutricional de Cães e Gatos CardiopatasGláucia LunaОценок пока нет
- Historia e Geografia de GoiasДокумент103 страницыHistoria e Geografia de GoiasMichel Merelles100% (2)
- Capital SocialДокумент45 страницCapital SocialFocoОценок пока нет
- FolderДокумент2 страницыFoldertirsi mabelОценок пока нет
- ESTRUTURAДокумент9 страницESTRUTURACarlos Felipe Bezerra De LimaОценок пока нет
- Fichamento: MARTELOTTA. M, E. (Org.) - Manual de Linguística. São Paulo: Contexto, 2009, p.177 - 192Документ2 страницыFichamento: MARTELOTTA. M, E. (Org.) - Manual de Linguística. São Paulo: Contexto, 2009, p.177 - 192Jason FelipeОценок пока нет
- TJ Ba Aula 1Документ27 страницTJ Ba Aula 1Lopes PublicidadeОценок пока нет
- EDITAL PRODIC-UNEAL No 030-2020 - TURMA 6 - 2021Документ21 страницаEDITAL PRODIC-UNEAL No 030-2020 - TURMA 6 - 2021jorgeОценок пока нет
- BAUBEROT, Jean. A Favor de Uma Sociologia Intercultural e Histórica Da LaicidadeДокумент20 страницBAUBEROT, Jean. A Favor de Uma Sociologia Intercultural e Histórica Da LaicidadePaulimDОценок пока нет
- 170 Motivos para Te Amar PituxinhoooДокумент4 страницы170 Motivos para Te Amar PituxinhoooSilvia Aros100% (1)
- Prova Pism 2020 Dia - 1 Módulo - Iii SaúdeДокумент20 страницProva Pism 2020 Dia - 1 Módulo - Iii SaúdeGuilherme BaumgratzОценок пока нет
- Tabela Cnu Pme Ma-1Документ13 страницTabela Cnu Pme Ma-1Sullivan SuadОценок пока нет
- Máquina Envasadora de CremeДокумент33 страницыMáquina Envasadora de CremefabriniОценок пока нет
- Afasia de ConduçãoДокумент55 страницAfasia de ConduçãopatriciasusckingОценок пока нет