Академический Документы
Профессиональный Документы
Культура Документы
Determinacion de La Constante de Equilibrio Quimico
Загружено:
Alejandro Ramirez AlpizarОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Determinacion de La Constante de Equilibrio Quimico
Загружено:
Alejandro Ramirez AlpizarАвторское право:
Доступные форматы
DETERMINACIN DE LA CONSTANTE DE EQUILIBRIO
QUMICO
OBJETIVO:
Determinar la constante de equilibrio de a reaccin de esterificacin del
cido actico con etanol para producir acetato de etilo y agua :
CH 3 COOH + C2 H 5 OH HCl 3 N CH 3 COOC 2 H 5 + H 2 O
A partir del anlisis qumico de la mezcla de reactivos y productos en
equilibrio.
RESUMEN:
En esta prctica se definirn algunas de las constantes de equilibrio para
algunos sistemas, su funcin, y el comportamiento que tiene la constante
de equilibrio en algunos sistemas homogneos que contienen una reaccin
en comn, as como la utilidad que tiene la densidad y la titulacin para
calcular dicha constante.
FUNDAMENTO TERICO:
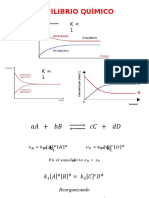
EQUILIBRIO QUMICO:
Es el estado al que se llega al final de cualquier sistema qumico. La
expresin matemtica que representa al equilibrio qumico, se conoce como
Ley de Accin de Masas y se enuncia como: La relacin del producto de las
actividades (actividad igual a concentracin en soluciones diluidas) elevadas
los coeficientes estequiomtricos en la reaccin de productos y reactivos
permanece constante al equilibrio.
Para cualquier reaccin: K = cte. de cada reaccin en el equilibrio.
C
[C ] . [D]
K=
a
b
[ A] .[B]
Las letras entre parntesis rectangular indican concentracin molar de
reactivo o producto y los exponentes son los coeficientes estequiomtricos
respectivos en la reaccin. De acuerdo con estas expresiones matemticas:
Si K <1, entonces la reaccin es muy reversible y se dice que se encuentra
desplazada a la izquierda.
Si K = 1, es una reaccin en la que se obtiene 50% de reactivos y 50% de
productos.
Si K > 1, la reaccin tiene un rendimiento alto y se dice que esta
desplazada a la derecha.
EFECTO DE UN CAMBIO DE LAS CONDICIONES DE EQUILIBRIO:
Existen diversos factores capaces de modificar el estado de equilibrio en un
proceso qumico, como son la temperatura, la presin, y el efecto de la
concentracin. La influencia de estos tres factores se puede predecir, de
una manera cualitativa por el Principio de Le Chatelier, que dice lo
siguiente: si en un sistema en equilibrio se modifica alguno de los factores
que influyen en el mismo (temperatura, presin o concentracin), el sistema
evoluciona de forma que se desplaza en el sentido que tienda a
contrarrestar dicha variacin.
Efecto de la temperatura: si una vez alcanzado el equilibrio, se aumenta
la temperatura, el equilibrio se
opone a dicho aumento desplazndose en el sentido en el que la reaccin
absorbe calor, es decir, sea
endotrmica.
Efecto de la presin: si aumenta la presin se desplazar hacia donde
existan menor nmero de moles
gaseosos, para as contrarrestar el efecto de disminucin de V, y viceversa.
Efecto de las concentraciones: un aumento de la concentracin de uno de
los reactivos, hace que el
equilibrio se desplace hacia la formacin de productos, y a la inversa en el
caso de que se disminuya dicha concentracin. Y un aumento en la
concentracin de los productos hace que el equilibrio se desplace hacia la
formacin de reactivos, y viceversa en el caso de que se disminuya.
Factores que no modifican el valor de la constante de equilibrio
termodinmica:
Actividad del disolvente
Fuerza inica
Reacciones laterales
El clculo de las concentraciones en el equilibrio requiere el planteamiento
de un sistema de ecuaciones con tantas ecuaciones como especies existan
en el equilibrio. Las ecuaciones del sistema proceden de:
Las constantes de equilibrio.
Los balances de masas.
El balance de cargas si es necesario.
PROCEDIMIENTO EXPERIMENTAL:
Para determinar el valor de la constante de equilibrio por anlisis qumico se
preparan una serie de mezclas de reaccin que contienen distintas
cantidades de los reactivos y productos, algunas con exceso de reactivos,
otras con exceso de productos. De este modo, la reaccin se desplazar
hacia uno u otro lado para alcanzar el equilibrio. En la mezcla de reaccin se
aadir tambin una cantidad conocida de cido clorhdrico, que acta
como catalizador y reduce el tiempo necesario para que se establezca el
equilibrio.
-En la siguiente tabla se muestran las cantidades de reactivos utilizados:
Muestra
1
2
3
4
5
6
7
8
9
10
CH3COOH
1.00mL
2.00mL
3.00mL
4.00mL
1.00mL
C2H5OH
HCl
4.05mL
3.10mL
2.00mL
1.00mL
5.00mL
5.00mL
5.00mL
5.20mL
5.10mL
5.00mL
5.00mL
5.00mL
5.00mL
5.00mL
1.80mL
1.00mL
CH3COOC2
H5
5.00mL
3.00mL
2.10mL
H2O
2.00mL
3.00mL
4.00mL
4.00mL
4.00mL
-En la siguiente tabla se muestra la cantidad de sustancia utilizada en
moles:
Muestra
1
2
3
4
5
6
7
8
9
10
CH3COOH
0.0175
0.0350
0.0520
0.0699
0.0175
C2H5OH
HCl
0.0694
0.0531
0.0343
0.0171
0.1364
0.1364
0.1364
0.1419
0.1392
0.1364
0.1364
0.1364
0.1364
0.1364
0.0310
0.0171
CH3COOC2
H5
0.0511
0.0307
0.0215
H2O
0.1110
0.1665
0.0409
0.0409
0.0409
-En la siguiente tabla se muestran las cantidades de las sustancias puras
(separando Agua de HCl)
Muestra
1
2
3
4
5
6
7
8
9
CH3COOH
0.0175
0.0350
0.0520
0.0699
0.0175
C2H5OH
0.0694
0.0531
0.0343
0.0171
0.0310
HCl
0.0150
0.0150
0.0150
0.0156
0.0153
0.0150
0.0150
0.0150
0.0150
CH3COOC2
H5
0.0511
0.0307
0.0215
0.0409
0.0409
H2O
0.2458
0.3568
0.4123
0.2556
0.2507
0.2458
0.2458
0.2458
0.2458
10
0.0171
0.0150
0.0409
0.2458
-Cmo Proseguir?:
Pipetear las cantidades indicadas e introducirlas en frascos provistos de
tapn. Tapar los frascos inmediatamente, asegurndose de que cierran bien.
Determinar el nmero de moles de cada sustancia que se introduce
inicialmente en cada frasco. Para ello debe tenerse en cuenta que:
Los nmeros de moles de cido actico, etanol y ster se
calculan empleando las densidades de las sustancias facilitadas
en el laboratorio.
El nmero de moles de agua se calcula suponiendo que la
densidad del agua es 1 gr mL-1.
El nmero de moles de cido clorhdrico se calcula a partir de
la concentracin de la disolucin.
El nmero de moles de agua aadidos con la disolucin de cido
clorhdrico se calcula a partir de la concentracin del cido.
Dejar los frascos a temperatura ambiente, agitando de vez en cuando,
durante una semana.
Valorar las mezclas en equilibrio utilizando una disolucin de NaOH 0.5 M.
Resolucion:
Como determinar la cantidad de Agua en HCl:
1)Hallamos la cantidad de HCl
HCl3 N =
3 moles
x 5 ml=0.015 0.015 moles es la cantidad de HCl que existe en 5 mL de S olucion
1000 mL
0.015 molesx
36.461 gr .
=0.547 gr . de HCl
1 mol de HCl
2)Hallamos el peso de la Soluciion usando su densidad:
5 mLx
0.9949 gr .
=4.9745 g de solucion total ..
mL
3)Al peso de la solucin total le quitamos el HCl puro y lo que quede ser
Agua:
Masa de Agua=4.97450.547=4.4275
4)esta cantidad se pasa a moles dividiendo entre su peso molecular y luego
se debern realizar los clculos respectivos.
Como determinar
reacciono
el
Ac.Actico
Que
no
#meq NaOH = #meq CH3COOH
N.V
=
W/P MEQ
(0.5)(gasto respectivo de NaOH) (Pmeq) =WAcido Acetico
(0.5)(gasto de NaOH) (Peso Molecolar/1000j)=W Acido Acetico
-La cantida resultante saldr en gramos;se deber pasar a moles, esta ser
la cantidad en equilibrio de NaOH.
Muestra 1:
CH 3 COO C2 H 5+ H 2 O HCl3 N CH 3 COOH + C2 H 5 OH
5 mL
0.02555 0.1229 0 0
0.0189 0.0189 0.0189 0.0189
0.00665 0.104 0.0189 0.0189
0.0189 0.0189
x
0.005 0.005
K=
=0.52
0.00665 0.104
x
0.005 0.005
Muestra 2:
CH 3 COO C2 H 5+ H 2 O HCl3 N CH 3 COOH + C2 H 5 OH
5 mL
0.0151 0.01510.0151 0.0151
0.00025 0.1633 0.01510.0151
0.0151 0 .0151
x
0.005
0.005
K=
=5.48
0.1633 0.00025
x
0.005
0.005
Muestra 3:
0.01535 0.1784 0 0
CH 3 COO C2 H 5+ H 2 O HCl3 N CH 3 COOH + C2 H 5 OH
5 .05mL
0.01075 0.20615 0 0
0.01075 0.01075 0.01075 0.01075
0 0.1954 0.01075 0.01075
0 .01075 0.01 075
x
0.005 05 0.005 05
K=
=0.117
0.1 954
0.005 05
Muestra 4:
CH 3 COOH + C2 H 5 OH HC l 3 N CH 3 COO C 2 H 5 + H 2 O
5.125
0.0027 0.0027 0.0027 0.0027
0.00605 0.032 0.0027 0.1305
0.1305
0.0027
x
0.005125 0.005125
K=
=1.819
0.00605
0.032
x
0.005125 0.005125
Muestra 5:
CH 3 COOH + C2 H 5 OH HC l 3 N CH 3 COO C 2 H 5 + H 2 O
5.1
0.0 175 0.0 26550 0.12 535
0.0037 0.0037 0.0037 0.0037
0.0138 0.02285 0.0037 0.12905
0.0037 0.12905
x
0.0051 0.0051
K=
=1 .514
0.0138 0.02285
x
0.0051 0.0051
0.00875 0.0347 0 0.1278
Muestra 6:
CH 3 COOH + C2 H 5 OH HC l 3 N CH 3 COO C 2 H 5 + H 2 O
5
0.026 0.01715 0 0.122885
0.004175 0.004175 0.0041750.004175
0.021825 0.012975 0.0041750.12706
0.12706 0. 004175
x
0.005
0.0051
K=
=1 .87
0.021825 0.012975
x
0.005
0.005
Muestra 7:
CH 3 COOH + C2 H 5 OH HC l 3 N CH 3 COO C 2 H 5 + H 2 O
5
0.035 0.00855 0 0.122885
0 .0026 0.0026 0.0026 0.0026
0.0324 0.00595 0.0026 0.1489
0.0026 0.1489
x
0.005 0.005
K=
=2.01
0.0324 0.0 0595
x
0.005
0.005
Muestra 8:
CH 3 COO C2 H 5+ H 2 O HCl3 N CH 3 COOH + C2 H 5 OH
5 mL
0.02045 0.1229 0.00875 0
0.01 350.01 35 0.01 350.01 35
0.022 0.0135
x
0.005 0.005
K=
=0. 39
0.00695 0.1 1
x
0.005 0.005
Muestra 9:
0.00695 0.11 0.022 0.0135
CH 3 COO C2 H 5+ H 2 O HCl3 N CH 3 COOH + C2 H 5 OH
5.4 mL
0.02045 0.1229 0 0.0155
0.0129 0.0129 0.0129 0.0129
0.00755 0.11 0.0129 0.0284
0.0129 0.0284
x
0.005 0.005
K=
=0. 44
0.00755 0.11
x
0.005 0.005
Muestra 10:
CH 3 COO C2 H 5+ H 2 O HCl3 N CH 3 COOH + C2 H 5 OH
5 .mL
0.02045 0.1229 0 0.00855
0.015 0.015 0.015 0.015
0.00545 0.1079 0.015 0.02355
0.015 0.02355
x
0.005 0.005
K=
=0.601
0.00545 0.1079
x
0.005
0.005
K=1.48
Conclusiones:
Para determinar la constante de equilibrio en la esterificacin del acetato de
etilo, deberemos determinar primero para donde se desplaza la reaccin.
Analizamos las cantidades de reactivos insertadas en la muestra, y asi
obtendremos la constante de equilibrio.
Bibliografa:
Analisis QUijmico Cuantitativo-Daniel C. Harris 6 Edicion(3Original)Editorial Reverte
Вам также может понравиться
- Operaciones unitarias y proceso químico. QUIE0108От EverandOperaciones unitarias y proceso químico. QUIE0108Рейтинг: 3.5 из 5 звезд3.5/5 (5)
- Manual de Operacion Ingersoll Ran DD90Документ170 страницManual de Operacion Ingersoll Ran DD90Promotora Pavimentos MalagonОценок пока нет
- Modelamiento y casos especiales de la cinética química heterogéneaОт EverandModelamiento y casos especiales de la cinética química heterogéneaРейтинг: 3 из 5 звезд3/5 (1)
- Examen de Liquidos Penetrantes Nivel IIДокумент11 страницExamen de Liquidos Penetrantes Nivel IIGerardoYanezОценок пока нет
- Determinación de La Constante de Equilibrio QuímicoДокумент8 страницDeterminación de La Constante de Equilibrio QuímicoMarlon Alarcon50% (2)
- Titulacion ConducДокумент11 страницTitulacion ConducRick RodriguezОценок пока нет
- Geodesia FisicaДокумент113 страницGeodesia FisicaJuan Ibarra Granda0% (1)
- Obtencion de La Ecuacion de ChezyДокумент12 страницObtencion de La Ecuacion de Chezyjoe vladimirОценок пока нет
- Cinetica Quimica Magnesio y HCLДокумент6 страницCinetica Quimica Magnesio y HCLJuanDa R. RuedaОценок пока нет
- Equilibrio Químico Homogéneo en Fase LíquidaДокумент20 страницEquilibrio Químico Homogéneo en Fase LíquidaRosa100% (1)
- Procesos de Transferencia de Calor - Kern 31 Ed - 897-952Документ56 страницProcesos de Transferencia de Calor - Kern 31 Ed - 897-952Alejandro Ramirez AlpizarОценок пока нет
- Practica 5Документ12 страницPractica 5JesusOswaldoHolguinFloresОценок пока нет
- Ionización de Ácidos y Bases DébilesДокумент7 страницIonización de Ácidos y Bases DébilesYuriko Castro100% (1)
- Modo de Control Proporcional - InvestigacionДокумент5 страницModo de Control Proporcional - InvestigacionDaniel GSОценок пока нет
- Destilacion EnglerДокумент45 страницDestilacion EnglerLuis Alfonso Torrez Camacho100% (3)
- Equilibrio químico etanol-ácido acéticoДокумент9 страницEquilibrio químico etanol-ácido acéticosupertokyОценок пока нет
- Equilibrio Químico Homogéneo en La Fase LíquidaДокумент10 страницEquilibrio Químico Homogéneo en La Fase LíquidaJUNIORОценок пока нет
- Equilibrio Quimico LabДокумент6 страницEquilibrio Quimico LabJose Fernandez100% (1)
- Practica 9Документ5 страницPractica 9javier100% (1)
- Práctica #5 - Equipo 4Документ11 страницPráctica #5 - Equipo 4Renata Beatríz Castillo RuizОценок пока нет
- Preinforme QuimicaДокумент13 страницPreinforme QuimicaIsis Dalefh Leonel HernandezОценок пока нет
- Informe de Laboratorio 3Документ6 страницInforme de Laboratorio 3Geraldine ReyesОценок пока нет
- Manual de Practicas Lab - Qa1 Iq 2023Документ40 страницManual de Practicas Lab - Qa1 Iq 2023Luis Fernando Morales CastañedaОценок пока нет
- p5 QuimicaДокумент11 страницp5 QuimicaBrandon Daniel Bobadilla LopezОценок пока нет
- Equilibrio QuimicoДокумент19 страницEquilibrio Quimicosimon j ochoa aОценок пока нет
- Laboratorio 5 - Quim. ExpДокумент7 страницLaboratorio 5 - Quim. ExpDavid Alejandro RamirezОценок пока нет
- Informe Estequiometria de Las Reacciones QuimicasДокумент10 страницInforme Estequiometria de Las Reacciones QuimicasJUAN PAULO OSPINA DIAZОценок пока нет
- Determinación de la constante de equilibrio químicoДокумент8 страницDeterminación de la constante de equilibrio químicomyratrespalaciosОценок пока нет
- Equilibro Quimico - Quimica 2Документ14 страницEquilibro Quimico - Quimica 2Jose Antonio Carreyo IIОценок пока нет
- Calculos y Cuestionario Practica 5Документ9 страницCalculos y Cuestionario Practica 5Evelyn CelisОценок пока нет
- Reaccion de KIДокумент11 страницReaccion de KIBerioskaRosasCartolínОценок пока нет
- Determinación de Una Constante de Equilibrio Por Analisis QuímicoДокумент2 страницыDeterminación de Una Constante de Equilibrio Por Analisis QuímicoCarla selena Acevedo rinconОценок пока нет
- Practica 05 Equilibrio QuimicoДокумент15 страницPractica 05 Equilibrio QuimicoGabriela RamírezОценок пока нет
- Cuestionario ChidoДокумент4 страницыCuestionario ChidoSergioОценок пока нет
- Guía de Autoaprendizaje N°3 Equilibrio Ácido-Base y PH y pOHДокумент5 страницGuía de Autoaprendizaje N°3 Equilibrio Ácido-Base y PH y pOHfrancisco muñoz quintanaОценок пока нет
- Determinación de La Constante de Equilibrio QuímicoДокумент8 страницDeterminación de La Constante de Equilibrio QuímicoMarlon AlarconОценок пока нет
- Práctica 13 Equilibrio QuímicoДокумент4 страницыPráctica 13 Equilibrio QuímicoCarlos “Charly” Gómez LópezОценок пока нет
- Equilibrio Quimico Homogeneo en La Fase LiquidaДокумент9 страницEquilibrio Quimico Homogeneo en La Fase LiquidaMelissa RivaОценок пока нет
- Constante de EquilibrioДокумент8 страницConstante de EquilibrioMaggyBalcazarОценок пока нет
- Práctica 9 - Equilibrio QuimicoДокумент10 страницPráctica 9 - Equilibrio QuimicoANDRES GUTIERREZ VILLAGRANAОценок пока нет
- Equilibrio QuimicoДокумент8 страницEquilibrio QuimicoKarlo FernandoОценок пока нет
- Practica 1 CineticaДокумент6 страницPractica 1 CineticaMaximiliano Tapia VazquezОценок пока нет
- Taller 5 - Equilibrio Químico - 2021-20Документ4 страницыTaller 5 - Equilibrio Químico - 2021-20Diego Alejandro CastilloОценок пока нет
- Material de Clase Presentacion Sistemas ReaccionantesДокумент33 страницыMaterial de Clase Presentacion Sistemas ReaccionantesBrayam Stalyn Bonifacio AyalaОценок пока нет
- Laboratorio N - 1 FisicoquimicaДокумент28 страницLaboratorio N - 1 FisicoquimicaLoi Lewis Velasquez RamirezОценок пока нет
- Equilibrio Quimico Fico IIДокумент10 страницEquilibrio Quimico Fico IIMarcUsZavaОценок пока нет
- Equilibrio Quimico Unlam MielДокумент19 страницEquilibrio Quimico Unlam MielBaez GastónОценок пока нет
- Informe Laboratorio QuimicaДокумент6 страницInforme Laboratorio QuimicafacuszimerОценок пока нет
- Laboratorio 01 Fisico QuimicaДокумент20 страницLaboratorio 01 Fisico QuimicaMiguel Ángel Mejía BenitoОценок пока нет
- Principio de Le ChatelierДокумент12 страницPrincipio de Le ChatelierSergio De la HozОценок пока нет
- Guía Nº7 Química IVº MedioДокумент5 страницGuía Nº7 Química IVº Mediovicky SaavedraОценок пока нет
- Guia de Laboratorio 12-QuimicaДокумент16 страницGuia de Laboratorio 12-QuimicaGianella Miranda0% (1)
- Practica 8Документ12 страницPractica 8diego muñoz arellanoОценок пока нет
- Fundamentos teóricos de equilibrio químico y reaccionesДокумент12 страницFundamentos teóricos de equilibrio químico y reaccionesMaríaОценок пока нет
- INFORME 6 y 7 FisicoquimicaДокумент16 страницINFORME 6 y 7 FisicoquimicaMayli Martinez AñancaОценок пока нет
- Paper RELACIONES ESTEQUIOMÉTRICASДокумент8 страницPaper RELACIONES ESTEQUIOMÉTRICASHeider MendezОценок пока нет
- Practica VII Det. Constante de EquilibrioДокумент16 страницPractica VII Det. Constante de EquilibrioAdrian Lopez MОценок пока нет
- Equilibrio Gaseoso 2013-1Документ20 страницEquilibrio Gaseoso 2013-1Josias Cueto MendozaОценок пока нет
- SolubilidadДокумент6 страницSolubilidadYourladys ElenaОценок пока нет
- 3.estequiometria y Reacciones Quimicas PDFДокумент16 страниц3.estequiometria y Reacciones Quimicas PDFJORGE PACHECOОценок пока нет
- Practica 1 Lab Analisis QuimicoДокумент6 страницPractica 1 Lab Analisis QuimicoMichael Marquez CamouОценок пока нет
- Equilibrio QuimicoДокумент26 страницEquilibrio Quimicogacv0925Оценок пока нет
- Determinación de constante de equilibrio por análisis químicoДокумент13 страницDeterminación de constante de equilibrio por análisis químicoSebastianNavarroJuarezОценок пока нет
- Preparar y acondicionar elementos y máquinas de la planta química. QUIE0108От EverandPreparar y acondicionar elementos y máquinas de la planta química. QUIE0108Оценок пока нет
- Tabla Maestra 7Документ1 страницаTabla Maestra 7Alejandro Ramirez AlpizarОценок пока нет
- Capítulo II Estudio de MercadoДокумент7 страницCapítulo II Estudio de MercadoAlejandro Ramirez AlpizarОценок пока нет
- Mi Querido CapitánДокумент1 страницаMi Querido CapitánAlejandro Ramirez Alpizar100% (1)
- Condensador VerticalДокумент4 страницыCondensador VerticalAlejandro Ramirez Alpizar100% (1)
- MP-FE010 Criterios Aplicacion 17j025 InvestigacionДокумент55 страницMP-FE010 Criterios Aplicacion 17j025 InvestigacionAlejandro Ramirez AlpizarОценок пока нет
- Transmisores y ReseptoresДокумент7 страницTransmisores y ReseptoresAlejandro Ramirez AlpizarОценок пока нет
- Practica 5 Fuel CellsДокумент1 страницаPractica 5 Fuel CellsAlejandro Ramirez AlpizarОценок пока нет
- Optimizacion de ProyectoДокумент11 страницOptimizacion de ProyectoAlejandro Ramirez AlpizarОценок пока нет
- Control de Personal PLABIDДокумент1 страницаControl de Personal PLABIDAlejandro Ramirez AlpizarОценок пока нет
- KERNДокумент5 страницKERNAlejandro Ramirez AlpizarОценок пока нет
- Practica 5 Fuel CellsДокумент7 страницPractica 5 Fuel CellsAlejandro Ramirez AlpizarОценок пока нет
- TermoparesДокумент2 страницыTermoparesAlejandro Ramirez AlpizarОценок пока нет
- Isa-5 1Документ16 страницIsa-5 1Alejandro Ramirez AlpizarОценок пока нет
- Diseño de Intercambiador de CalorДокумент16 страницDiseño de Intercambiador de CalorAlejandro Ramirez AlpizarОценок пока нет
- Corrosión Pract 7Документ13 страницCorrosión Pract 7Alejandro Ramirez AlpizarОценок пока нет
- TermoparesДокумент2 страницыTermoparesAlejandro Ramirez AlpizarОценок пока нет
- PRÁCTICA N1 HPLCДокумент5 страницPRÁCTICA N1 HPLCAlejandro Ramirez AlpizarОценок пока нет
- Propiedades de GasesДокумент2 страницыPropiedades de GasesAlejandro Ramirez AlpizarОценок пока нет
- Practica 3 ElectroquimicaДокумент9 страницPractica 3 ElectroquimicaAlejandro Ramirez AlpizarОценок пока нет
- Apagado Del EquipoДокумент2 страницыApagado Del EquipoAlejandro Ramirez AlpizarОценок пока нет
- El Calentamiento GlobalДокумент12 страницEl Calentamiento GlobalAlejandro Ramirez AlpizarОценок пока нет
- Expo. FID. Cromatografia de GasesДокумент8 страницExpo. FID. Cromatografia de GasesAlejandro Ramirez AlpizarОценок пока нет
- Balance molar y másico del proceso de producción de anhídrido maléico a partir de o-xileno y n-butanoДокумент29 страницBalance molar y másico del proceso de producción de anhídrido maléico a partir de o-xileno y n-butanoGhostface ScreamОценок пока нет
- Transmisores y ReseptoresДокумент7 страницTransmisores y ReseptoresAlejandro Ramirez AlpizarОценок пока нет
- Practica 5 Fuel CellsДокумент7 страницPractica 5 Fuel CellsAlejandro Ramirez AlpizarОценок пока нет
- Practica 3 ElectroquimicaДокумент9 страницPractica 3 ElectroquimicaAlejandro Ramirez AlpizarОценок пока нет
- 3.1 Recipientes Sujetos A PresiónДокумент29 страниц3.1 Recipientes Sujetos A PresiónfranciscoОценок пока нет
- GraficasДокумент10 страницGraficasAlejandro Ramirez AlpizarОценок пока нет
- Propiedades de Los SolidosДокумент2 страницыPropiedades de Los SolidosLuis GonzОценок пока нет
- SICROMETYROQДокумент10 страницSICROMETYROQS.G.S. S.TОценок пока нет
- Enzimologia ClinicaДокумент33 страницыEnzimologia ClinicakcaceresmaОценок пока нет
- Examen de Fisiología Vegetal. Temas 9 10 11Документ3 страницыExamen de Fisiología Vegetal. Temas 9 10 11alvaroledesma5Оценок пока нет
- Jose María Sequeira Arguedas Carnet: B16250Документ191 страницаJose María Sequeira Arguedas Carnet: B16250giselle kennedyОценок пока нет
- Problemario Media Superior FisicaДокумент10 страницProblemario Media Superior FisicaAdriana CruzОценок пока нет
- FIS4°6Документ2 страницыFIS4°6Felix PalominoОценок пока нет
- Fisica de La Materia VivaДокумент9 страницFisica de La Materia VivaColquier Coronado Roberto100% (1)
- Introducción A La ÓpticaДокумент2 страницыIntroducción A La ÓpticaJorge CaviedesОценок пока нет
- GlosarioQuímico40Документ22 страницыGlosarioQuímico40Katt MartinezОценок пока нет
- Yacimientos MineralesДокумент59 страницYacimientos MineralesHans Wladimir Castro VillalobosОценок пока нет
- Lubricantes X Maquinaria.Документ94 страницыLubricantes X Maquinaria.henryОценок пока нет
- C8 Cantidad de Mto Lineal-Colisiones PDFДокумент31 страницаC8 Cantidad de Mto Lineal-Colisiones PDFjohn100% (1)
- Introducción a la química analítica y volumetría por neutralizaciónДокумент8 страницIntroducción a la química analítica y volumetría por neutralizaciónl0% (1)
- Bases Teoricas FinalesДокумент4 страницыBases Teoricas FinalesRoberto MendozaОценок пока нет
- 02 Clasificación de ArcillasДокумент50 страниц02 Clasificación de ArcillasROMINA ROSA SARAVIA �AVEZОценок пока нет
- Problemas Resueltos Paso A Paso de SolubilidadДокумент6 страницProblemas Resueltos Paso A Paso de SolubilidadAnderson JuarezОценок пока нет
- Laboratorio 3Документ11 страницLaboratorio 3Javier MichaelОценок пока нет
- Expo 2 - Pectina FormatoДокумент3 страницыExpo 2 - Pectina FormatoCristian Alonso Cornejo RodriguezОценок пока нет
- Lab 1 Pre TrabajoДокумент3 страницыLab 1 Pre TrabajoisaacОценок пока нет
- Regla de Fases 10Документ21 страницаRegla de Fases 10Eleazar CastroОценок пока нет
- Actividad 5. BioelementosДокумент1 страницаActividad 5. BioelementosHanna Daniela Hernández VargasОценок пока нет
- 05 - Principio de ArquimedesДокумент5 страниц05 - Principio de Arquimedesanon_536705588Оценок пока нет
- Residuos Generados en La Industria TextilДокумент7 страницResiduos Generados en La Industria TextilJonnathan Paul Valdez SolisОценок пока нет