Академический Документы
Профессиональный Документы
Культура Документы
Libro de Química Terminado y Corregido
Загружено:
gonzales994Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Libro de Química Terminado y Corregido
Загружено:
gonzales994Авторское право:
Доступные форматы
Teora de Qumica
CAPTULO 1: MATERIA Y ENERGA
Con masa o condensada. Ej: cuaderno, lpiz, etc.
Materia Forma: Definida Variable Separacin
Variablede las mezclas
Volumen: Definido Definido Variable
Sin masa o no condensada. Ej: calor, energa
Destilacin: separa lquidos miscibles
aprovechando su diferente punto de ebullicin.
Ej: agua del alcohol.
Divisin de la materia Hay una destilacin para separar los derivados
del petrleo, ella se llama destilacin
Medios Mecnicos M.Fsicos M.Qumicosfraccionada.
Bombardeo nuclear Energa Csmica
Decantacin:
p+ separa lquidos no miscibles
aprovechando
e- quarks
su diferencia de densidad.
Ej: agua
n0 con aceite.
Cuerpo Partcula Molcula tomo Partculas Subatmicas
Filtracin: separa slidos insolubles en lquido
Ej. Separar arena del agua.
Clasificacin de la materia Tamizado: separa slidos de diferente
dimetro Materia
Ej.: arena gruesa de la arena fina.
Nota: La evaporacin es un mtodo natural para
Mezclas
separar la sal del agua de mar.
M. Homognea Simple
M. Heterognea
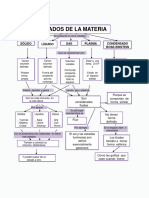
Estados de la materia
Son 4: slido, lquido, gaseoso y el plasma.
(Tienen 1 fase) Ej.: Las aleaciones latn(Cu+Zn), Son todos losacero
bronce(Cu+Sn), elementos
(Fe+C);qumicos, Adems
aguardiente estn
;vinagre los altropos
;el petrleo
(Tienen ms de FOCA
y todos 1sus
fase)(F.
Ej.:rojo
derivados y F. blanco
concreto,
(gasolina,k
agua
Tie
Slido Lquido. Gaseoso
FA>FR FA=FR FA<FR
Los slidos y lquidos no se pueden comprimir por
ello se le llaman estados condensados.
Los gases si se pueden comprimir y expandir,
adems sus molculas se mueven en forma
Estimado alumnos es muy importante que sepas
desordenada por ello tiene una alta entropa y una
que:
alta energa cintica.
Una mezcla tiene composicin variada y se
conservan las propiedades.
Nota: entropa es el desorden molecular.
Una sustancia tiene composicin definida y no
se conservan las propiedades. El plasma es el estado ms energtico y el ms
abundante del universo, supera los 20 000 C, Ej.:
El sol, las estrellas.
Exclusivo para postulantes a la UNP 1
Teora de Qumica
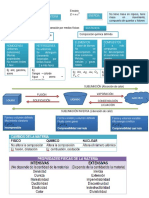
Cambios
Endotrmicos
Cambios de estado Propiedades intensivas o intrnsecas o
particulares
Sublimacin directa
(No depende de la masa)
Cambios
Fusin
Exotrmicos Para lquidos: Temperatura, Densidad,
Vaporizacin
Viscosidad, Tensin superficial.
SLIDO LQUIDO GAS Para Slidos: Dureza (resistencia a ser
rayado), maleabilidad (lminas), ductibilidad
Solidificacin Licuacin (hilos); Tenacidad (resistencia a ser roto)
Otras: color, olor sabor, conductividad elctrica,
elasticidad.
Sublimacin inversa o deposicin
Fenmenos
Fenmenos fsicos: Es cuando slo cambia la
forma y el tamao.
Recuerda: Hay sustancias que se evaporan Ej.: Romper un huevo, una toalla secada al sol,
fcilmente a ellos se les denomina voltilesEj: dilucin del azcar en agua.
Hielo seco CO2(S), alcanfor, naftalina.
Recuerda: todos los cambios de estado
Fases y Componentes son fenmenos fsicos, en el ejemplo de la
toalla secada al sol el agua lquida se
Fase: es lo que t puedes ver. evapora (cambio de estado).
Componente: son los ingredientes de la
mezcla Fenmenos qumicos: Cambia la estructura
interna de la materia, es decir cambia su
Ej.: En un recipiente cerrado se tiene agua, aceite composicin.
un cubo de hielo. El nmero de fases y Ej. Cocin, combustin, crecimiento, oxidacin,
componentes es? electrlisis, infeccin de una herida, corrosin,
fermentacin, putrefaccin de la carne,
oscurecimiento de la plata, fotosntesis,
Vapor del hielo
Fases=4 (agua, aceite, hielo, vapor) coagulacin de la sangre, herrumbre del hierro.
Componentes=2 (agua, aceite)
Nota: todas las propiedades qumicas como la
Aceite combustin, oxidacin, etc. Son propiedades
intensivas.
Agua Fenmeno nuclear: Hay una gran liberacin
de energa, l ncleo de un tomo se
Nota: Como hay 4 fases es tetrafsico y como hay transforma en otro.
2 componentes es binario.
Teora de la relatividad de Einstein
Propiedades de la materia Dijo que todo es relativo, todo cambia excepto la
velocidad de la luz.
Propiedades extensivas o generales
(Dependen de la masa) A medida que aumenta la velocidad de un
cuerpo su masa aumenta:
Peso
Inercia
Calor ganado o perdido
Atraccin
Longitud
Masa rea
Exclusivo
Extensinpara postulantes
Volumen a la UNP 2
Teora de Qumica
mi Exa (E) 1018
mf
MLTIPLOS
2 Peta (P) 1015
v
1 Tera (T) 1012
C
Giga (G) 109
Dnde: Mega (M) 106
mi: masa inicial en reposo Kilo (K) 103
mf :masa final en movimiento
v: velocidad del cuerpo
C: velocidad de la luz
3 108 m/s
3 1010 cm/s
En procesos nucleares
E m C 2
Dnde: m es la masa que se transforma en
energa
Si la energa est en Joule la masa debe de
estar en Kg y la velocidad en m/s.
Si la energa est en Ergios la masa debe de
estar en g y la velocidad en cm/s
Equivalencias:
1J 107 ergios
1J 0.24cal
CAPTULO 2: SISTEMA DE UNIDADES
Exclusivo para postulantes a la UNP 3
Teora de Qumica
Hecto (h) 102 C F K R
Punto de ebullicin 100 212 373 672
Deca (da) 101
SUBMLTIPLOS
deci (d) 10-1
centi (c) 10-2
mili (m) 10-3 Punto de fusin 0 32 273 492
micro () 10-6
nano (n) 10-9
pico (p) 10-12 Cero Absoluto -273 -460 0 0
fento (f) 10-15
atto (a) 10-18 Frmula para convertir de una escala a otra
Equivalencias importantes
C F 32 K 273 R 492
1kg 2.2libras
5 9 5 9
1libra 16 onz
Teorema de Thales
1pulg 2,54cm Se utiliza para comparar dos escalas.
1pi 12pulg 0.3048m
1yarda 3pie Ej.: El punto de ebullicin del agua en una escala
10 A es 200A,el punto de congelacin es 20A,
1A 10 m mientras que en otra escala B el punto de
1milla 1609m ebullicin es 500B y el punto de congelacin es
50B,a cuantos grados B equivalen 80A.
Solucin:
1 1000cm3 1000m
1m3 1000 A B
3
1pie 28.32
200 5000
USA 3,785
1galn
Ingls 4,545 80 x
1 1dm3 20 50
TEMPERATURA
Mide el grado de movimiento molecular.
Hay 4 escalas de temperatura: 2 escalas relativas 200 20 500 50
y 2 escalas absolutas. 80 20 x 50
180 450
Escalas relativas: no consideran al cero como el 60 x 50
cero absoluto, son: Celsius, Fahrenheit. x 200
Escalas absolutas: consideran al cero como el
cero absoluto, son: Kelvin y Rankine. Cuando hay un incremento y una
disminucin de la temperatura se usa:
C F K R
5 9 5 9
Exclusivo para postulantes a la UNP 4
Teora de Qumica
Las escalas absolutas consideran el
NOTA: 1mmHg= 1Torr ,adems PSI siginifica
cero como el cero absoluto. lb/pulg2.
A la escala Fahrenheit se le llama
tambin la escala relativa inglesa La presin en qumica se calcula de la siguiente
En el cero absoluto ya no se mueven manera:
las molculas P D h
DENSIDAD
m Donde D es la densidad y h es la altura.
D
V
Dagua= 1g/cm3 Ejemplo: Calcular la presin en el fondo del
Daire = 0.0013g/cm3 recipiente.
Sabemos que la densidad del agua es
1g/cm3, si la queremos en kg/m3,
bastar multiplicarla por 1000, entonces
Dagua=1000Kg/m3
5cm D=4g/cm3
Densidad relativa
Dx
DR
Dy x y Solucin:
, se lee densidad de con respecto a Como el recipiente est abierto se tiene que
considerar la presin atmosfrica (1 atm)
Densidad de una mezcla
1atm
mT
Dm
VT
PRESIN
La presin a nivel del mar es 1 atm, mientras ms
te sumerges la presin que soportars ser mayor 5cm D=4g/cm3
y mientras ms arriba ests la presin ser menor.
Su unidad en el S.I es el Pascal.
Equivalencia: 1atm =101.35KPa. P Patm D h
P 1atm(4g/cm 3 ) 5cm
P 1033 20
2
P 1053g/cm
No olvidar que:
Ptotal Patm Pman
Donde:
Ptotal presintotalo absoluta
1atm=760mmHg=1033g/cm 2=14.7PSI
Patm presinatmosfric
a o baromtric
a
pman presinmanomtric a
dfgbbngnmj
NOTA:
La presin atmosfrica se mide con el barmetro.
Exclusivo para postulantes a la UNP 5
Teora de Qumica
La presin manomtrica se mide con el Niels Bohr: discpulo de Rutherford, habl
manmetro. sobre la energa en los niveles, pero slo
trabaja con el tomo de hidrgeno.
Tiene 3 postulados
1. Fuerza centrpeta igual a la fuerza
elctrica. Fc=Fe
Fc Fe
CAPTULO 3: ESTRUCTURA ATMICA
2. Radio
Teoras Atmicas
Dalton: Dijo que el tomo es indivisible y que
un elemento est formado por tomos iguales. r1
r2
Elemento
El radioenla capa "n": rn 0.53n2 A
Thompson: Dijo que el tomo es con un budn
de pasas, las pasas son los electrones.
Descubre los electrones. Ej. : Calcularelradioenla capa 4
n 4
r4 0.53(4)2 A
r4 8.48A
Rutherford: El tomo es como un sistema 3. Excitacin:
planetario en miniatura, donde los electrones Cuando un electrn salta a un nivel mayor gana
giran alrededor del ncleo en rbitas circulares, energa (absorbe energa).
adems dijo que el tomo era hueco. Cuando un electrn salta a un nivel inferior
pierde energa (libera energa).
l descubre el ncleo del tomo al bombardear Gana Energa
con rayos alfa una lmina de oro.
Pierde Energa
La energa en el nivel n se calcula:
313.6 13.6
En kcal/mol o En ev
n2 n2
NOTA: El ncleo concentra el 99,9% de la masa.
Ej.:Calcular la energa en ev que pierde un
electrn cuando salta del segundo nivel al
primer nivel.
Exclusivo para postulantes a la UNP 6
Teora de Qumica
13.6 13.6
E 2 E1
22 12 Ncleo: aqu estn los protones y neutrones.
Enega 3.4 13.6 Envoltura o nube electrnica: aqu
Energa 10.2ev encontramos a los electrones.
e-
e-
p+ e-
ev 1.6 1019J
e-
n
Recuerda: e-
e-
Cuando un electrn salta de un nivel a otro
( )
Representacin de un tomo:
describe una longitud de onda
A q
pX
A masaatmica
p nmeroatmico
q carga
1 1 1
R Un tomo puede ser:
2 2
nint next
Neutro: cuando el tomo no tiene carga, aqu
Donde: R constante
deRydberg el tomo est en su estado basal.
R 1.1 105 1.Ej :
nint nivel interior X(tomo neutro)
next nivel exterior
In: cuando el tomo tiene carga, si la carga es
+ (se llama catin), si la carga es (se llama
( ) anin).
1.Ej :
NOTA: Al aplicar la frmula la longitud de onda
quedar en cm. X 1(catin monovalent
e)
X 2(catin divalente)
Ej.: Hallar la longitud de onda de un electrn
cuando salta del primer al cuarto nivel. X 3(catin trivalente)
X -1(anin monovalent
e)
1 1 1
R 2 2
1 4
1 15R 16 Tipos de tomos
16 15R
16 Istopos o Hlidos: fueron descubiertos por
15(1.1 105 ) Soddy, tienen igual protones, sus propiedades
1 16
qumicas son iguales.
nint 105
16.5 20 50
10 X 10X
0.97 105 cm
4
next El hidrgeno tiene 3 istopos naturales:
1 2 3
1H 1H 1H
Principio de incertidumbre de Heisemberg Protio Deuterio Tritio
Es imposible conocer la velocidad y la posicin del
electrn simultneamente.
Isbaros: tienen igual masa, sus propiedades
TOMO fsicas son iguales.
Tiene dos partes:
Exclusivo para postulantes a la UNP 7
Teora de Qumica
1.Ej: 20
12X
40 40
15 X 20Y p e 12
n 8
A nucleones 20
Istonos: tienen igual neutrones. carga nuclear p 12
carga nuclearabsoluta 12(1.6 1019c)
80 70
30X 20Y carga nuclearabsoluta 1.92 1018c
n 50 n 50
Nota: comoeltomoes neutrolos protones
sonigualesa los electrones
Isoeletrnicos: tiene igual electrones.
2 -3
12 X 7Y 40 3
2.Ej.: 8X
e 10 e 10 p 8
n 32
e 8- 3 5
Nota: Para hallar los electrones se resta los
protones y la carga. A nucleones
40
2
e 10 2 e 8 carga nuclear p 8
10 X
4 carga nuclearabsoluta 8 (1.6 1019c) 1.28 1018c
20 Y e 20 ( 4) e 24
Nmeros cunticos: son 4 (n,, m, s)
Para que te acuerdes y nunca se te olvide aprende
Peso atmico (P.A) la nemotecnia neli masa.
m1a1 m2a2 ....
P.A Nmero cuntico principal(n): es el nivel o
100% capa de energa, indica el tamao.
Donde:
m masa atmica
a abundancia
Ej.: Hallar el peso atmico de un elemento que
tiene 2 istopos uno tiene una masa de 30 u.m.a Nivel
y el otro 40 u.m.a, si la abundancia del ms ligero
es del 80%.
Solucin:
1 2
La suma de abundancias es el 100%
K L 3 4 5
Si a1 80% a2 20% M N 6
m a m2a2 O 7
PA 1 1 P
Q
100%
30 80% 40 20% Nmero cuntico secundario o
PA azimutal(): Es el subnivel de energa,
100%
PA 32 indica la forma del orbital
s p d f (sopa de fideo)
Nota: u.m.a es unidadde masaatmica. 0 1 2 3
u.m.a 1.66 10-24g
s: shard, tiene forma esfrica
p: principal, tiene forma bilobular
En los problemas tipo admisin, preguntan lo d: difuso, tiene forma tetra lobular
siguiente: f: fundamental.
Exclusivo para postulantes a la UNP 8
Teora de Qumica
Nota: La cantidad de electrones de cada 4.Ej. : Hacerla C.E del tomo40X
s 2 p6 d10 f 14 C.E : 1s2 2s2 2p6 3s23p6 4s23d104p6 5s2 4d2
subnivel es:
Nmero cuntico magntico (m): indica la Nota: A veces para no estar escribiendo toda la
orientacin. configuracin se abrevia con la configuracin de
2He 10Ne 18Ar 36Kr.
los gases nobles
Nmero cuntico spin(s): indica el giro.
5.Ej. : Hacer la C.E del tomo15X
1/2( )
s C.E : 1s2 2s2 2p6 3s23p3 o
1/2( )
C.E : 10Ne 3s23p3
Configuracin electrnica (C.E)
Hay una memotcnia para hacer la C.E: Orbital o REEMPE: regin espacial energtica de
si sopa sopa se da pensin se da pensin mxima probabilidad electrnica.
s s p s p s dp s dp
OrbitalOrbital Orbital
lleno semilleno
1s 2 2
2s 2p 6 2
3s 3p 6 2
4s 3d 4p 10 6 2 10
5s 4d 5 p 6
(Saturado) Vaco
tomo paramagntico: tiene electrones
Nota: Los nmeros se ponen de bloque en desapareados.
bloque y el d no lo cojas, luego el nmero que va 1.Ej:14 X
en el d es uno menos de los que has puesto a los C.E : 1s2 2s2 2p6 3s2 3p2
costados.
Si es que te faltan electrones completas la C.E -1 0 +1
Se fue de paseo se fue de paseo 3p
Paramagnetismo =2
6s 2 4f14 5d10 6p6 7s 2 5f14 6d10 7p6
1.Ej. : Hacerla C.E del tomo23X
Nota: paramagnetismo es la cantidad de
e 23 C.E : 1s2 2s2 2p6 3s2 3p6 4s23d3 electrones desapareados.
2.Ej. : Hacerla C.E del tomo24X tomo diamagntico: no tiene electrones
e 24 C.E : 1s2 2s2 2p6 3s2 3p6 4s23d4(NO) desapareados.
(NO puedeterminaren d4 ni en d9,porque son 1.Ej:18 X
inestables) C.E : 1s2 2s2 2p6 3s2 3p6
Hay que quitarle un electrnal 4s2 y pasrselo
al 3d, eso se llama"TRASLAPE".
-1 0 +1
C.E : 1s2 2s2 2p6 3s23p6 4s13d5 3p
2.Ej.: Hallarlos 4 nmeroscunticosdel ltimo
2 electrndel tomo15X..
3.Ej.: Hacer la C.E del in 28X
C.E : 1s2 2s2 2p6 3s23p3
primerohaces la configurac in normaldel 28X
C.E : 1s2 2s2 2p6 3s23p6 4s2 3d8
luegola carga 2 quieredecirquepierde dos -1 0 +1
electrones(e 28- 2 26), se los quito de la 3p
capa ms externa. n l m s
C.E : 1s2 2s2 2p6 3s23p6 4s03d8 3 1 +1 +1/2
Exclusivo para postulantes a la UNP 9
Teora de Qumica
2.Ej. : Hallar los 4 nmeroscunticos del ltimo
electrn del tomo26X
C.E : 1s2 2s2 2p6 3s23p6 4s23d6
-2 -1 0 +1 +2
3d
n l m s
3 2 -2 -1/2
1.Ej: Un istopoAz X es bombardead o conpartculas
RADIOACTIVIDAD originndo se la reaccinnuclear:
A
zX 19879Au neutrn
Es cuando una sustancia emite energa en forma A Z
de rayos, al emitir estos rayos se descompone su Cul es el valorde ?
2
ncleo y se transforma en otra. Existe Solucin:
radioactividad natural y artificial.
La reaccines : Az X 4 198 1
2He 79Au 0n
A 4 198 1 A 195
Z 2 79 0 Z 77
A Z 195 77
2 2
A Z
136
2
Fue descubierta accidentalmente por Becquerel,
pero estudiada por los esposos cur.
2.Ej : El ncleo inestable 238
92U emite dos partculas
4
2 He dandolugar a un ncleoA.Hallar la carga nuclearde A.
Rayos alfa ( ): son , estos rayos son Solucin:
238 b
positivos y su velocidad es de 20 000 km/s. 92U 2 a A
238 4 b
0
92U 2( 2 He) a A
-1e 238 2(4) b 92 2(2) a
Rayos beta (): Son , estos rayos son 230 b 88 a
negativos su velocidad es de 270 000 km/s. 238
El elementoes 88A La carga nucleares 88.
0
0 LONGITUD DE ONDA ()
Rayos gamma ( ): son , estos rayos son Una antena de movistar emite energa que se propaga
neutros y su velocidad es casi igual a la de la en forma ondulatoria, donde la distancia entre cresta y
luz 300 000 km/s. cresta se llama longitud de onda.
Hay otros tipos de rayos :
neutrones: 01n Cresta
Deutern : 21H
Canales : descubiertos por Goldstein
Penetracin de los rayos
Exclusivo para postulantes a la UNP 10
Teora de Qumica
*Dicha energa est conformada por pequeas
partculas llamadas fotones. 2.Ej. : Una emisora localse encuentraa 850 m de la
UNP , conuna seal de radio de 6 MHz
Cuntos( ) hay entrela emisoray la UNP?
UNP - 2014II.
Fotn Solucin:
1
UNP Emisora
Energa de un fotn 850m
ch
E 1f c
f ,reemplazan do
c velocidadde la luz 3 108m/s
6 106Hz
h constante de planck
h 6.62 10-27 erg.s h 6.62 10-34 J.s 6 106 3 108
longitud de onda 50m
E 1f Energa de 1 fotn
Regla de tres:
1.Ej.: Calcularla energade unrayode luz queesta 1 50m
conformadapor200fotones, sila longitud
de x 850m
ondadeunfotnde 331nm. 50x 850 x 17
Solucin:
Calculamosla energadeun fotn:
ch
E1f
3 108m/s 6.62 10-34J.s CAPTULO 4: TABLA PERIDICA
E1f
331 10 9m
19 Primeros intentos de formacin.
E1f 6 10 J
Berzelius: clasific a los elementos en
1fotn 6 10-19J
electropositivos y electronegativos.
200fotones X
200 6 10-19 Triadas de Dobereiner: clasific a los
X
1
elementos en triadas, donde el peso atmico
(PA) del elemento central es el promedio de los
X 12 10-17J
otros dos.
Nota: 1nm 10-9 m
A B C
Fr PA : 20 X 60
ecuencia 20 60
X X 40
c 1 2
f unidad: hertz
s
Octavas de Newlands: clasific a los
Por ello la energa de un fotn tambin se puede elementos en octavas que eran filas de 7 en 7.
representar por:
E1f f h Mendeleiev: ordena los elementos en forma
creciente a sus pesos atmicos, tuvo en cuenta
las propiedades qumicas y en su tabla no se
distinguen los metales de los no metales.
Exclusivo para postulantes a la UNP 11
Teora de Qumica
Moseley: Ordena los elementos en forma
creciente a su nmero atmico.
s y p: son los representativos.
Werner: modific la tabla peridica de d: elementos de transicin (todos son metales).
Mendeleiev. f: elementos de transicin interna o tierras
raras.
La tabla peridica cuenta con periodos y grupos.
Periodos: indica los niveles de energa, son Recuerda: Todos los elementos f
7(cortos, medianos y largos). (lantnidos y actnidos) estn en el grupo
IIIB, por ello es el grupo ms grande
Grupo o familia: indica el nmero de electrones Metales
de valencia (electrones en la ltima capa), son 18 Conducen el calor y la electricidad.
distribuidos en el grupo A y en el grupo B. Pierden electrones, se oxidan.
Son buenos reductores.
Los elementos que estn en el grupo A:
terminan en s o en p. No metales
No conducen el calor ni la electricidad (excepto
s1 s 2 s 2p1 s 2p2 s 2p3 s 2p4 s 2p5 s 2p6 el carbono grafito).
Ganan electrones, se reducen.
IA IIA IIIA IVA VA VIA VIIA VIIIA
Son buenos oxidantes.
Metaloides o semimetales
Los elementos que estn el grupo B: terminan A medida que se calientan conducen la
en d. electricidad.
d1 d2 d3 d4 d5 d6 d7 d8 d9 d10
IIIB IVB VB VIB VIIB VIIIB IB IIB
Ejemplo:A qu periodo y grupo pertenece el Hay una escalera que separa los metales de los
25 X. no metales.
elemento
Solucin:Se tiene que hacer su configuracin
electrnica.
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Perido =4 (el nivel ms alto)
Grupo=VIIB (porque termina en d5)
La tabla esta divida como las divisiones de una
casa .
s d p
Lantnidos (4f1-4f14)
f
Actnidos (5f1-5f14)
Exclusivo para postulantes a la UNP 12
Teora de Qumica
Electronegatividad (E.N): Fuerza para atraer
electrones.
*El elemento ms electronegativo es el cloro
y el menos electronegativo es el cesio.
E.I
Energa de ionizacin o Potencial de
ionizacin (E.I): Energa para desalojar a un
electrn.
B
Metaloides
At
SbGe Si desalojo al ltimo electrn ser la 1er E.I, si
desalojo a otro ser la 2da E.I y cada vez va
Po
TeSi
As
aumentando la energa.
Afinidad electrnica o Electroafinidad(A.E)
Metales
A.E Energa para aceptar a un electrn.
No metales
Carcter metlico (C.M): propio de los
metales.
Carcter no metlico (C.NM): propio de los no
metales.
Hay elementos:
Solidos: La mayora Variacin de las propiedades peridicas
Hg (Metal)
Br (No metal) Lquidos: hay 2
5 diatmicos (O2,H2,N2,Cl2,F2)
Gaseosos: hay 11
6 monoatmicos (gases nobles) CM
RI
Propiedades peridicas
Las dems propiedades sern lo contrario a las
Radio Atmico (R.A): es la distancia del flechas, eso es obvio.
ncleo al electrn ms externo, cuando el
tomo tiene carga se le llama radio inico. Estimado alumno tienes que aprender de memoria
lo siguiente:
Elementos del grupo A
RA
Tamao del radio
r
r
r
Catin Neutro Anin
Exclusivo para postulantes a la UNP 13
Teora de Qumica
IA IIA IIIA IVA VA VIA VIIA VIIIA Se forma entre un Metal y un no metal.
H Be B C N O F He Su diferencia de electronegatividad es mayor
Li Mg Al Si P S Cl Ne EN >1.7
a 1.7 ( ).
Na Ca Ga Ge As Se Br Ar
En el ocurre una transferencia de electrones.
K Sr In Sn Sb Te I Kr Su punto de ebullicin y de fusin son muy
Rb Ba Tl Pb Bi Po At Xe altos.
Cs Ra Rn No son verdaderas molculas, son cristales.
Fr Son los compuestos ms solubles en agua.
Ej. : NaCl,FeS; NH4Cl.
IA: Alcalinos (excepto el H) Enlace covalente
IIA: Alcalinos trreos Se forma entre un No metal y un no metal.
IIIA: Boroides Su diferencia de electronegatividad es menor.
IVA: Carbonoides EN <1.7
VA: Nitrogenoides a 1.7 ( ).
VIA: Anfgenos o calcgenos o calcoides Ej. : H2O, CO 2 .
VIIA: Halgenos
VIIIA: Gases Nobles
IB: Metales preciosos o de acuacin (Cu, Ag, Au)
IIB: Elementos puente (Zn, Cd, Hg)
VIIIB: Ferromagnticos o metal pesado (Fe,Co, Ni) Enlace covalente
Recuerda: El hidrgeno es un
no metal.
Puro o Normal Coordinado o Dativo
ENLACE QUMICO Simple
Los tomos se unen mediante fuerzas
electrostticas, con el propsito de alcanzar el
octeto obteniendo de esta manera estabilidad. Mltiple
Para poder formar los enlaces tenemos saber los
electrones de valencia que tiene un elemento,
pues estos coinciden con el grupo en el cual se
encuentra. Nota:
El enlace entre elementosiguales se llama
enlace covalente apolar A A .
VII
IA IIA IIIA IVA VA VIA El enlace entre elementos diferentes se
A
llama enlace covalente polar A B.
E E E E E E E
Regla del octeto: Es cuando el tomo central Enlace Metlico
completa 8 electrones de valencia. Se forma entre Metales, en este enlace hay un
Ej. : PH 3 flujo de electrones (mar de electrones).
H* P *H
*
H
Nota:
El PH3 cumple con la regla del octeto y el grfico que
se ha hecho se llama "Estructura de Lewis".
Tipos de enlace qumico.
Enlace inico o electrovalente:
Exclusivo para postulantes a la UNP 14
Teora de Qumica
Hay un tipo especial de fuerza Dipolo Dipolo
llamada el puente de hidrgeno que es la
fuerza ms fuerte, esta se da cuando el
hidrgeno se une al:
Flor
H Oxgeno
Nitrgeno
Ej. : HO2,HF.
Molcula Apolar: una molcula es apolar Fuerza de London o de Dispersin: se da
cuando cumple dos requisitos: entre molculas apolares.
Ej. : CO 2,N2;O2.
Tiene enlaces iguales.
El tomo central no tiene electrones libres.
Algunos conceptos:
Ej. : CO 2;PCl 5. Covalencia: Es la cantidad de pares de
electrones enlazantes.
Tambin son molculas apolares las de la forma
Electrones libres: Aquellos electrones que
A 2.
Ej : N2,O2. no estn enlazados.
Ej. : Cuntos electroneslibres tiene el CO 2?
Nota: Solucin:
Las molculas que no cumplan estos requisitos Hacemos la estructurade Lewis y buscamos
sern Molculas polares. simetria.
O C O
Molcula polar: Electrones libres: 8
Ej. : H2O, Hidrocarburos(C 6H6 )
AB
Nota: Los electrones libres siempre quedan
Las molculas de la forma tambin son de par en par y se les puede representar por
Ej. : HCl.
medio de una rayita de la siguiente manera:
polares.
Fuerzas intermoleculares O C O
Son las fuerzas que se entre molculas, entre
ellas tenemos a: Resonancia: Es cuando un compuesto se
puede representar de varias formas al
Fuerza In-Dipolo: se da cuando un
ordenar slo los enlaces qumicos.
compuesto que tiene enlace inico se disuelve
en agua.
Ej. : NaCl en agua. Nota: Basta que una molcula tenga enlace
dativo para que tenga resonancia.
Fuerza Dipolo-Dipolo: se da entre molculas
polares. Ej. : El SO3 tieneresonancia?
Ej. : HCl. Solucin: Hacemossu estructurade Lewis.
Exclusivo para postulantes a la UNP 15
Teora de Qumica
III. El oxgeno siempre acta con E.O=-2,
excepto en los perxidos que acta con -1 y
en el compuesto OF2 donde acta con +2.
O
IV. En todo compuesto la suma de sus E.O es
S igual a cero.
Ejemplo: Hallar el E.O del S en el H2SO4
O +1 x -2
H2SO4
O 2(+1)+x+4(-2)=0
x=+6
O S O O S O
O O
O S O Cuando se tenga un in se iguala a la
carga del in.
O
CO 32
: Hallar el E.O del C en
Luego molcula del SO3 se podr representar Ej.
Es lo mismo que si lo escribo as:(CO3)-2
de las siguientes formas: x -2
(CO3)-2
1(x)-2(3)=-2
Si tiene resonancia, debido a que tiene x=4
enlace dativo.
CAPTULO 5: NOMENCLATURA INORGNICA
Valencia: Es la capacidad de combinacin
tiene un tomo.
Ejemplo: el carbono es tetravalente Hallar el E.O de los elementos subrayados
HNO 3
Estado de oxidacin (E.O): Tambin se le H3 XO 5
llama nmero de oxidacin, es la carga real o SO 42
aparente que tiene un tomo. Puede ser un ClO
nmero positivo, negativo, e incluso XO 3
fraccionario.
Algunas reglas
I. Cuando el elemento esta solo su E.O es cero. Sistemas de nomenclatura
0 0 0 Son 3 nomenclaturas las que se trabajan en el
Fe , Ca,H2 banco.
Ejemplo: 1. Nomenclatura Clsica o Antigua: utiliza
el: hipo oso, oso, ico, per ico.
II. El hidrogeno siempre acta con +1 excepto
en los hidruros metlicos donde trabaja con 2. Nomenclatura Stock: Utiliza los nmeros
-1. romanos.
3. Nomenclatura IUPAC o Sistemtica
Exclusivo para postulantes a la UNP 16
Teora de Qumica
Utiliza prefijos (mono = 1,di = 2, tri = 3, etc.) O so Ico
C 2, 4 O 2
1.
Estados de oxidacin de los elementos
Si elegimos el +2 sera
C 2 O 2
C 2 O 2
Anhdridocarbnoso(Antigua)
CO xido de carbonoII (Stock)
Monxido de carbono (IUPAC)
Si elegimos el +4 sera
C 4 O 2
C 2 O 4
Anhdrido carbnico (Antigua)
CO 2 xido de carbono IV (Stock )
Dixido de carbono (IUPAC)
I.XIDOS
CO 2(s)
a) xidos Bsicos = Metal + Oxgeno NOTA: Al Se le llama hielo seco.
Ejemplo:
O s o Ico
Fe 2, 3 O 2
hipo..oso oso ico
2 , 4, 6
S O 2
Si elegimos el +2 sera 2.
Fe 2 O 2
Fe 2O 2 Si elegimos el +2 sera
xido ferroso (Antigua) S 2 O 2
S 2 O 2
FeO xido de fierro II (Stock)
monxidode fierro(IUPAC) Anhdridohiposulfuroso (Antigua)
SO xido de azufreII (Stock)
Monxido de azufre (IUPAC)
Si elegimos el +3 sera
Fe 3 O 2 hipo..oso oso ico per...ico
xido frrico (Antigua) Cl 1 , 3, 5, 7
O 2
Fe 2O 3 xido de fierro III (Stock) 3.
Trixido de difierro(IUPAC)
Si elegimos el +1 sera
NOTA: a la combinacin 2 3 se le llama Sesqui por Cl 1 O 2
Fe 2O 3 Anhdrido hipocloroso (Antigua)
ello al tambin se le llama sesquixido de Cl2O xido de cloro I (Stock)
fierro o hematita. Monxido de dicloro (IUPAC)
b) xidos cidos = No Metal + Oxgeno.
Tambin se les llama anhdridos.
Ejemplos: Si elegimos el +7 sera
Exclusivo para postulantes a la UNP 17
Teora de Qumica
Cl 7 O 2 3.Fe 2,3 O 2
Anhdrido perclrico (Antigua) (Para formar un perxido se
tiene que coger el mayor estado de
Cl 2O 7 xido de cloro VII (Stock)
Heptaxido de dicloro (IUPAC) oxidacin)
Fe 3 O 2
Fe 2O 3 O
c) xidos Dobles U xido Salino
Fe 2O 4 perxido de fierro
Son de la forma M3O4
Ejemplo:
O so Ico III.HIDRXIDOS=xido bsico + Agua
Fe 2, 3 O 2 Llevan el grupo (OH)-1
1. Regla prctica: Metal + (OH)-1
FeO....... .............xido ferroso Ejemplo:
Fe 2O 3 .................xido frrico
1.Ca+2 + (OH)-1
xido ferroso frrico Ca(OH)2
Hidrxido de calcio
Fe 3O 4 xido doble de fierro Cal apagada
xido salino de fierro
Fe 3O 4
NOTA: Al Se le llama comercialmente
magnetita.
O so Ico
2. Na+1 + (OH)-1
2, 4 2 Na(OH)
Pb O Hidrxido de sodio
2. Soda custica
2(PbO.).... .............xido plumboso
PbO 2 .................xido plmbico
xido plumboso plmbico
Pb 3O 4 xido doble de plomo
xido salino de plomo 3. K+1 + (OH)-1
K(OH) Hidrxido de potasio
Potasa custica
Nota: Se le tiene que multiplicar por 2 al PbO
para que al sumar me d la combinacin M 3O4
II. Perxido=Oxido Bsico+ oxgeno
Jams se simplifican por el enlace puente de
4. Al+3 + (OH)-1
oxgeno, estos compuestos son muy inestables y
al reaccionar con agua liberan oxgeno. Al(OH)3 Hidrxido de aluminio
Ejemplos: Milanta
1.CaO O
CaO 2 perxido de calcio
2.K 2O O
K 2O 2 perxido de potasio
Exclusivo para postulantes a la UNP 18
Teora de Qumica
5. Mg+2 + (OH)-1 Si elegimos el +2:
Mg(OH)2 Hidrxido de magnesio S 2 O 2 H2 O
Leche de magnesia S 2 O 2 H2O
SO H2O
H2SO 2 cido hiposulfuroso
Si elegimos el +4
6. Fe+2,+3 + (OH)-1 S 4 O 2 H 2O
Fe+3+ (OH)-1 S 2 O 4 H2O
Fe(OH)3
Hidrxido frrico
SO 2 H2O
H2SO 3 cido sulfuroso
Si elegimos el +6
S 6 O 2 H 2 O
CIDOS: hay 2 tipos de cidos: Los cidos
S 2 O 6 H2O
oxcidos y los cidos hidrcidos
SO 3 H2O
cidos oxcidos =anhdrido + agua
H2SO 4 cido sulfrico o aceitede vitriolo.
Regla prctica: E+O+H2O
Dnde: E es un no metal
Ejemplo: NOTA: Todo postulante debe de saber de
memoria como es el cido sulfrico
O so Ico
1.C 2, 4 O 2 H2O hipo..oso oso ico per...ico
1 , 3, 5, 7
3.Cl O 2 H2O
Si elegimos el +2
Si elegimos el +7
C 2 O 2 H 2O
C 2 O 2 H2O
Cl7 O2 H2O
Cl2O7 H2O
CO H2O
H2 Cl2 O8
H2CO 2 cido carbonoso
HClO4 cido perclrico
Si elegimos el +4 O so Ico
4.N. 3, 5 O 2 H2O
C 4 O 2 H 2O
C 2 O 4 H2O
Si elegimos el +5 :
CO 2 H2O
H2CO 3 cido carbnico N5 O2 H2O
N2O5 H2O
H2 N2 O6
hipo oso O so Ico
2 , 4, 6 HNO3 cido ntrico
2.S O 2 H2O
Exclusivo para postulantes a la UNP 19
Teora de Qumica
O so Ico Per ico
2. Formar el cido ortocarbnico
5.Mn 4,6, 7
O 2 H2O O so Ico
C 2, 4 O 2 H2O
Si elegimos el +4 Como dice ico tenemos que coger el +4 y como
es par se elige la combinacin12
Mn4 O2 H2O
Mn2 O4 H2O C 4 O 2 H 2 O
C 2 O 4 H2O
MnO2 H2O 1CO 2 2H2O
H2MnO3 cido manganoso H4CO 4 cido ortocarnico
Si elegimos el +7 3. Formar el cido ortontrico
O so Ico
N 3,5 O 2
Mn7 O2 H2O
Mn2O7 H2O Como dice ico tenemos que elegir +5 y como
H2 Mn2 O8 es impar la combinacin en 13
HMnO4 cido permangnico N 5 O 2 H2O
N 2O 5 H2 O
1N2O 5 3H2O
NOTA: cuando hay 3 estados de oxidacin la regla H6 N2 O 8
es hipooso, oso, ico; pero slo hay una
excepcin cuando se trabaja con el magnesio que H3NO 4 cido ortontrico
sera oso, ico, per ico.
4. Formar el cido ortofosfrico
O so Ico
Dentro de los cidos oxcidos estn los: P 3, 5 O 2
cidos polihidratados y los cidos policidos
Como dice ico tenemos que elegir +5
cidos polihidratados= anhdrido + n (H2O)
P 5 O 2 H2O
P2O5 H2O
Prefijo E.O impar E.O par
1P2O5 3H2O
Meta 11 11
Piro 12 21 H6 P2 O8 simplificamos
Orto 13 12 cido ortofosfrico
H3PO 4
cido fosfrico
Qu significan los nmeros?
El nmero 13 significa: 1 anhdrido y 3 aguas.
NOTA: La palabra ORTO se puede omitir slo en
Ejemplo: cuarto elementos ellos son el P, As, Sb, B
1. Forma el cido piro cloroso cido ortofosfrico=cido fosfrico
hipo..oso oso ico per...ico
1 , 3, 5, 7 2
Cl O H 2O
Como dice oso, tenemos que coger el +3 y cidos policidos=n (anhdrido) + H2O
como es impar se elige la combinacin 12 Aqu van aparecer las palabritas: di, tri, tetra,
Cl 3 O 2 H2O penta, etc.
1Cl2O 3 2H2O
H4Cl 2O 5 cido pirocloroso Ejemplos:
1. Formar el cido tetra cloroso
Exclusivo para postulantes a la UNP 20
Teora de Qumica
En este caso el cloro debe de tener 4 C+4 + O-2 + H2O
hipo..oso oso ico per...ico
1 , 3, 5, 7 2 C2O4 +H2O
Cl O H2O
CO2 + H2O
H2CO3 cido carbnico
(CO3)-2 Carbonato
Si slo quitamos la mitad de hidrgenos
NOTA: Se tuvo que multiplicar por dos, para que el aparecer la palabra bi
resultado me de cuatro cloros.
H2CO3 cido carbnico
2. Formar el cido dicrmico
Cr 3,6 O 2 H2O
6 2
O H2O
Cr
2 CrO 3 H2O
Bicarbonato
H2Cr2O 7
Carbonato cido
(HCO3)-1
3. Formar el cido decacarbnico Hidrgeno carbonato
C 2,4 O2 H2O
C 4 O 2 H2O
C 2 O4 H2O
10 CO 2 H2O
H2C10O21
3. Formar el fosfato.
El fosfato ha venido del cido fosfrico, se
Radicales: se forman si a los cidos le quitamos tiene que formar este cido
sus hidrgenos H3PO4 cido fosfrico
El oso cambia por ito (Oso bonito) (PO4)-3 fosfato
El ico cambia por ato (pico de pato)
Ejemplo:
1. Si al cido ntrico HNO3 le quitamos su hidrgeno
que radical se formar. Y si le quito slo un hidrgeno
H3PO4 cido fosfrico
HNO3 cido Ntrico
(NO3)-1 Nitrato Fosfato dicido
(H2PO4)-2Dihidrgeno fosfato
2. Formar el carbonato
El carbonato ha venido del cido carbnico 4. Formar el tetra silicato
Tienes que formar el cido carbnico. Ha venido del cido tetra silcico
Exclusivo para postulantes a la UNP 21
Teora de Qumica
1. Formar el hidruro de carbono
C 4 H1
Si+4 + O-2 + H2O CH 4(metano)
Si2O4 +H2O
SiO2 + H2O
2. Formar el hidruro de silicio
4(SiO2)+ H2O H2Si4O9 cido tetrasilcico (Si4O9)-2 Ortotetra silicato
Si4 H1
SiH4(silano)
3. Formar el hidruro de fsforo
HIDRUROS P 3 H1
Estos pueden ser hidruros metlicos o hidruros no PH3(fosfina o fosfamina)
metlicos.
1
MH 4. Formar el hidruro de Arsnico
Hidruro metlico= As3 H1
AsH3(Arsina)
(Aqu el hidrgeno trabaja con -1)
Ejemplo:
5. Formar el hidruro de antimonio
1. Formar el hidruro ferroso
O so Sb 3 H 1
2 ,3 1
Fe H SbH3(estibina)
Fe 2 H1
FeH 2
6. Formar el hidruro de boro
B3 H1
2. Formar el hidruro frrico BH3(borano)
ico
2, 3 1
Fe H
Los hidruros no metlicos que estn formados por
Fe 3 H1
FeH 3 los elementos de grupo VIA y VIIA se les llaman
anfgenuros y Halogenuros.
3. Formar el hidruro de aluminio Ellos terminan en uro si son gases
Al3 H1 Ellos son cidos si estn en solucin acuosa
AlH3
Ejemplo
4. Formar el hidruro de calcio
1. Formar el sulfuro de hidrgeno
Ca 2 H 1
H 1 S 2
CaH2
H2S g
1 2. Formar el selenuro de hidrgeno
NM H H1 Se2
Hidruro No metlico= H2Se g
Los hidruros de los elementos del IVA tienen
3. Formar el cloruro de hidrgeno
nombre especial terminado en ano.
Ejemplo:
Exclusivo para postulantes a la UNP 22
Teora de Qumica
H1 Cl1 Hay dos tipos de sales:
HCl g Sales oxisales (provienen de cidos
oxcidos) y tienen oxgeno
4. Formar el bromuro de hidrgeno Sales Haloideas (provienen de
H1 Br1 cidos hidrcidos y no tienen
HBr g oxgeno
Sales oxisales:
Ejemplos:
Los mismos compuestos son los O so Ico
cidos hidrcidos si estn en 1.Fe 2, 3 NO3 1nitrato
solucin acuosa (metidos en agua) Fe 2 (NO 3 )1
Ejemplo: Fe(NO 3 )2 nitratoferroso
H2S acu cido sulfhdrico Como esta sal no tiene hidrgenos es una sal
H Se oxisal neutra
2 acu cido selenhdrico
HCl
acu cido clorhdrico
HBr acu cidobromhdrico 2.Na1 HCO 3 1
Na(HCO 3 )bicarbonato de sodio
Si a estos cidos le quitamos sus hidrgenos,
cambiaremos la terminacin hdrico por uro Como esta sal tiene hidrgenos es una
sal oxisal cida
H2S(acu) cido sulfhdrico
S-2 Sulfuro 3.Ca2 SO4 2 sulfato
Ca 2 (SO 4 ) 2
Ca(SO 4 ) sulfato de calcio
Si le pongo agua se convierte en una sal oxisal
Pero si slo quito un hidrgeno. hidratada.
Ejemplo:
HS2(acu) cido sulfhdrico
HS-1 bisulfuro o sulfuro cido Ca(SO4 )2H2O sulfato de calcio dihidratado o yeso
Si le pongo (OH) se convierte en una sal oxisal
bsica.
Ejemplo:
HCl(acu) cido Clorhdrico
Ca+2 + (SO4)-2+ (OH)-1
Cl-1 Cloruro
Ca+2 + [(SO4)(OH)]-3
Ca3[(SO4)(OH)]2 Sulfato de calcio bsico
Sales haloideas:
M Radical
SALES= Ejemplos:
1.Na1 Cl1
Cloruro de sodio
NaCl
Sal halita
Exclusivo para postulantes a la UNP 23
Teora de Qumica
Ico
2.Fe 2, 3 S 2
Fe 2S 3 Sulfuro frrico
Algunos nombres comerciales de los
compuestos.
SiO 2
: Slice.
SiC
: Carborundun.
FeS 2
: Pirita.
Al2O 3
: Almina.
N2 O
: Gas hilarante o Gas de la risa.
HCNO
: cido cinico.
HCN
: cido cianhdrico.
Mg3Si4O10 (OH) 2
: Talco (ortotetra silicato
dibsico de magnesio)
AlK (SO 4 ). 12H2O
: Alumbre (Sulfato Alumnico
potsico dodecahidratado).
CAPTULO 6: REACCIONES
Una reaccin tiene la siguiente forma:
B C
A D
Reactivos productos
Como podemos observar los reactivos se
convierten en productos, gracias a la energa de
activacin que debe de tener la reaccin, ya que
sin esta energa no podra realizarse la reaccin.
NOTA:
En una reaccin se rompen los enlaces para
formar nuevas sustancias.
A los reactivos tambin se les llama reactantes.
En una reaccin se cumple el principio de
conservacin la masa, propuesto por Antonio
Lavoisier.
Cmo s que ha ocurrido una reaccin?
Una reaccin ha ocurrido por tres cosas:
Exclusivo para postulantes a la UNP 24
Teora de Qumica
TIPO DE REACCIONES
A B AB
Reaccin de adicin:
1. Cambio de color
Tambin se le llama composicin o sntesis.
Ejemplo:
N2 H2 NH3
(Sntesis de Haber Bosh)
AB A B
Reaccin de descomposicin:
Ejemplo:
H2O H2+O2 (Pirrlisis)
hv
3. Formacin de precipitados H2O H2+O2 (Fotlisis)
MnO2
H2O H2+O2 (Catlisis)
Corriente
Elctrica
H2O H2+O2 (Electrlisis)
Reaccin de simple desplazamiento:
2. Liberacin de
A un
BCgas
AC B
(Llamada tambin reaccin de sustitucin)
Ejemplo: al liberarse un gas.
Zn HCl ZnCl2 H2
H2
Reaccin de doble desplazamiento o
mettesis
AB CD AD BC
Ejemplo: Las reacciones de neutralizacin.
HCl Na(OH) NaCl H2O
cido Base Sal Agua
NOTA: Estas reacciones NO son redox, ms
adelante veremos cuando una reaccin es
redox.
Exclusivo para postulantes a la UNP 25
Teora de Qumica
Reaccin de desproporcin: Llamada Segn el sentido una reaccin puede ser
tambin Dismutacin o autoredox, aqu un una reaccin:
elemento se oxida y se reduce a la vez.
H 2 O 2 O 2 H2 O AB CD
Reaccin irreversible:
A B C D
Las reacciones segn su energa pueden ser: Reaccin reversible:
Cundo una reaccin es REDOX?
H es positivo Una reaccin es redox cuando hay un elemento
a) Reaccin endotrmica: ( ) que se oxida y otro que se reduce.
En esta reaccin se Gana (absorbe) calor, y si
no hay calor no se puede realizar la reaccin Un elemento se oxida, cuando pierde
A B calor C D electrones.
Ejemplo: Un elemento se reduce cuando, gana
electrones.
H es negativo
b) Reaccin exotrmica: ( ) En una reaccin REDOX existen: un agente
En esta reaccin se Pierde (libera) calor. oxidante y un agente reductor, una forma oxidada
A B C D calor y una forma reducida.
Ejemplo:
Dos tipos de reacciones exotrmicas son las Los agentes siempre van primero en una
reacciones de neutralizacin y de reaccin.
combustin. La forma oxidada y la forma reducida,
siempre van al ltimo en una reaccin.
H
NOTA: El smbolo representa a la
Ej.: En la reaccin, hallar el agente oxidante, el
entalpa, que es la energa que tiene una
agente reductor, la forma oxidada y la forma
reaccin qumica.
reducida:
NO + SO3 NO2 + SO
Una reaccin de combustin puede ser
completa o incompleta, veamos el esquema.
Completa
Hay exceso de oxgeno Solucin: Hallamos los estados de oxidacin del N
y del S, del O no porque su estado de oxidacin se
Reaccin de Ej.:C3H8+O2 CO2 + H2O
mantiene igual, debido a que slo o cambia
Combustin
O2
Incompleta
cuando est slo , cuando est el perxido
Hay deficiencia de oxgeno
Ej.:C3H8+O2 CO + H2O H2O 2
de hidrgeno .
Luego restamos los estados de oxidacin:
+2 (+4) = -2e +6 - (+2) = +4e
El resultado lo colocamos encima de las flechas,
luego observamos su signo.
Exclusivo para postulantes a la UNP 26
Teora de Qumica
+2 -2e +4 NO
N N
Agente Reductor:
+6 +4e +2
S S NO2
Forma oxidada:
SO
Forma Reducida:
NOTA: muchas veces en lugar de decir agente
oxidante se le puede decir: oxidante, lo mismo
con el agente reductor.
Si el nmero tiene signo menos se oxida, por ellos Tambin en lugar de decir forma oxidada se le
a la derecha estar la forma oxidada y el que tiene puede decir: sustancia oxidada, lo mismo con
ms se reduce por ello a la derecha estar la la forma reducida.
forma reducida.
BALANCEO DE UNA REACCIN
+2 -2e +4
N N Forma Oxidada
Se puede hacer por 3 mtodos: tanteo, redox y el
+6 +4e +2
S Forma Reducida in electrn.
S
1) Mtodo del tanteo o simple inspeccin.
Consiste en colocar a cada trmino una letra, y
se van formando ecuaciones para hallarlas
dichas letras.
Ej.: balancear por tanteo la reaccin
Fe2O3 + C Fe + CO
Los agentes se colocan adelante, el agente
reductor est en la reaccin donde he puesto a la
forma oxidada y el otro agente reductor estar en
la reaccin donde he puesto a la forma reducida.
+2 -2e +4
Agente Reductor N N Forma Oxidada
+6 +4e +2 Solucin:
Agente Oxidante S S Forma Reducida Se le colocan letras a todos los trminos.
a Fe2O3 +b C c Fe +d CO
Luego: Luego la cantidad de fierros que hay a la
derecha es la misma que hay a la izquierda y
NO + SO3 NO2 + SO as se hacen con el oxgeno y el carbono,
obtenindose las ecuaciones:
A.R A.O F.O F.R
SO3
Agente Oxidante:
Exclusivo para postulantes a la UNP 27
Teora de Qumica
2a c x 2
Fe 2 O 3 : 2x 2(3) O
3a d
x 3
b d
si al valor de " a" le asiganamosuna constantek
se tiene: a k, c 2k,d 3k Hallamos el estado de oxidacin del C en el
comob d , entoncesb 3k CO.
Reemplazamos los valores halladosen la
reaccin: x 2
C O :x 2 0
x 2
k Fe2O3 +3k C 2k Fe +3k CO
3 2 0 2 2 2
Fe 2 O 3 C Fe C O
,
Como vemos los elementos que cambian su
estado de oxidacin son el Fe y el C con ellos
Simplificamos la constante k:
k Fe2O3 +3k C 2k Fe +3k CO se trabaja.
+3 0
Fe2 Fe
0 +2
C C
La reaccin balanceada ser:
1Fe2O3 +3C 2Fe +3CO
Luego balanceamos los fierros, como hay dos Fe
a la derecha tienen que haber dos a la izquierda,
por ello colocamos un dos.
2) Mtodo Redox: +3 0
Para poder utilizar este mtodo tiene que haber Fe2 2 Fe
un elemento que se oxide y otro que se 0 +2
reduzca. C C
Este mtodo trabaja slo con los elementos
que cambien su estado de oxidacin.
Ej.: balancear por Redox la reaccin:
Fe2O3 + C Fe + CO
Calculamos la cantidad de electrones en cada
trmino, dichos electrones estn encerrados en el
crculo y los restamos, el valor de esta resta se
coloca encima de las flechas.
Solucin:
Calculamos el estado de oxidacin del Fe en el
Fe 2O 3
:
Exclusivo para postulantes a la UNP 28
Teora de Qumica
+3 +6e 0 1Fe2O3 +3C 2Fe +3CO
2(+3)=+6 Fe2 2 Fe 2(0)= 0
0
0 -2e +2
C C +2
Nota: Muchas veces estos nmeros en negrita
no son los correctos coeficientes, por ello hay
Nota: los nmeros que estn encima de las verificarlos balanceando los elementos a
flechas siempre deben de tener signos simple vista.
diferentes.
3) Mtodo del in electrn:
Este mtodo se utiliza cuando hay iones, es
El siguiente paso es tratar de eliminar los
decir trminos que tienen carga.
electrones que estn arriba de las flechas, para
El mtodo puede usarse balanceando en medio
ello multiplicamos por 3 a la reaccin que est
cido o balanceando en medio Bsico.
abajo. 1
H
+3 +6e 0 Medio cido: aqu agregamos hidrgeno ( )
Fe2 2 Fe
Medio bsico o alcalino: aqu agregamos
0 -2e +2
x 3( C C ) (OH) 1
Son dos Pasos a seguir para balancear con
el mtodo del in electrn:
1 Eliminar los electrones.
2 Balancear cargas.
La idea es que los electrones que estn arriba de
las flechas sean iguales, para que de esta manera
al sumar las reacciones se ELIMINEN los
electrones. 1.Ej.: balancear la reaccin en medio cido
-1
I2 + NO3 IO + NO2
+3 +6e 0
Fe2 2 Fe Solucin:
+ 0 -6e +2 Se tiene que Hallar los estados de oxidacin
3C 3C del I y del N, porque ellos son los elementos
que cambian sus estados de oxidacin.
Hacemos el procedimiento del redox para
eliminar los electrones:
Finalmente los nmeros en negrita son los
coeficientes de la reaccin ya balanceada, as que
los ponemos en la reaccin inicial:
Exclusivo para postulantes a la UNP 29
Teora de Qumica
0 +2 decir que en la reaccin tengo que agregar 4
I2 I
hidrgenos.
+5 +4
N N -1
I2 + 4NO3 2IO + 4NO2
0 -4e +2 0 + -4 = 0 + 0
2(0)= 0 I2 2I +4
2(+2)== -4 = 0
+5 +1e +4 +4 -4 = 0
+5 N N +4
0 = 0
Agregamos los 4hidgenos:
+11 -1
4H+I2 + 4NO3 2IO + 4NO2
Multiplicamos por 4 a la reaccin donde est el N:
0 -4e +2
I2 2I
+5 +1e +4
x 4( N N ) Como ahora hay 4 hidrgenos en la izquierda, en
) la parte derecha tambin deben de haber 4
0 +4e +2 H2 O
I2 2I
+ hidrgenos; por ello colocamos 2 Listo ya
+5 -4e +4
4N 4N est la reaccin balanceada!
+11 -1
4H+ I2 + 4NO3 2IO + 4NO2+2H2O
Luego los coeficientes los ponemos en la reaccin
inicial:
-1
I2 + 4NO3 2IO + 4NO2 NOTA: para verificar si la reaccin est bien
balanceada, se puede corroborar balanceando
mentalmente los oxgenos. Si estos son
iguales en cada lado la reaccin est bien
balanceada la reaccin.
2. Ej.: balancear la reaccin en medio bsico.
Luego balanceamos cargas, el coeficiente se -2 -1 +3 -1
multiplica por la carga que aparece arriba, los Cr2O7 + NO2 Cr + NO3
resultados se colocan debajo de la reaccin,
sumamos estas cantidades en cada miembro, al Solucin: Se hallan los estados de oxidacin del
final las cargas tienen que ser iguales, por eso Cr y del N, eso queda para el lector.
sumamos +4 a la parte izquierda, este +4 quiere
Exclusivo para postulantes a la UNP 30
Teora de Qumica
+6 +3 -2 -1 +3 -1
Cr2 Cr Cr2O7 + 3NO2 2Cr + 3NO3
+3 +5
N N -2 -3 = +6 -3
-5 = +3
-5 = +3 -8
+6 -6e +3
2(+6)=+12 Cr2 2 Cr 2(+3)==+6 -5 = -5
+3 -2e +5
+3 N N +5
8(OH) 1
Agregamos los :
-2 -1 +3 -1 -1
Cr2O7 + 3NO2 2Cr + 3NO3+ 8(OH)
Multiplicamos por 3 a la reaccin donde est el N
+6 -6e +3
Cr2 2CrCRCRC
+3 -2e +5 Para que en la parte izquierda haya 8 hidrgenos
x 3( N N )
H2O
)
.
+6 +6e +3 se le tiene que adicionar
Cr2 2 Cr
+ +3 -6e +5 -2 -1 +3 -1 -1
3N 3N 4H2O + Cr2O7 + 3NO2 2Cr + 3NO3+8(OH)
Luego los coeficientes los ponemos en la reaccin CAPTULO 7: ESTEQUIOMETRI
inicial.
Qu significa de mol?
-2 -1 +3 -1
Cr2O7 + 3NO2 2Cr + 3NO3 Imaginemos un rumo de arena, este est formado
por millones de granitos de arenas.
6.023 1023
Si en el rumo hubiera granitos de
arena, tendramos 1 mol de granitos de arena.
Balanceamos las cargas, multiplicando cada uno
de los coeficientes por las cargas que tiene arriba,
al final para que se igualen las cargas, se le tiene 1mol = 6.023x1023
que sumar -8 al lado derecho, eso quiere decir que
8(OH) 1 En qumica no se habla de granitos de arena, si
le tengo que agregar no de tomos o molculas, entonces:
Exclusivo para postulantes a la UNP 31
Teora de Qumica
6.023 1023 C 6H14
1 mol de tomos = tomos. En 1 mol de hay 6 moles de C. Luego
6.023 10 23 Hacemos una regla de tres.
1 mol de molculas = molculas.
1 mol de C6H14 6 moles de C C
H6
40 mol de C6H14 x moles de C
6.023 1023 N A H6
40 x 6
Como x=
1
x = 240 moles de C
NA
1 mol de tomos = tomos.
NA
1 mol de molculas = molculas.
NA
NOTA: se le llama nmero de Avogadro. PESO ATMICO (P.A): veamos los pesos atmicos
de algunos elementos.
Cuando tenga un compuesto: tendr molculas
Ejemplo:
H C N O S P
En 20 moles de H2O hay 20 NA molculas de H2O
1 12 14 16 32 31
En 7 moles de H2O hay 7NA molculas de H2O
En 4 moles de HNO3 hay 4NA molculas de HNO3
Na Mg Al K Ca Fe
23 24 27 39 40 56
Cuando tenga un elemento: tendr tomos
Ejemplo:
Li Cl Cu Zn Ag
En 40 moles de Fe hay 40NA tomos de Fe.
7 35.5 63.5 65 108
En 12 moles de Al hay 12NA tomos de Al.
En 3 moles de Ca hay 3NA tomos de Ca. PESO MOLECULAR (PM)
Es la suma de los pesos atmicos, se le designa
En compuestos: mol es lo mismo decir mol-g por PM o PF (peso frmula).
Ejemplo:
8 moles de H2O = 8 mol-g de H2O. 1.Ej.: Hallar el peso molecular del H2O
10 moles de CO = 10 mol-g de CO. PM=2(1)+16
PM=18
En elementos: mol es lo mismo decir atm-g
Ejemplo: 2.Ej. Hallar el peso molecular del H2SO4
4 moles de Fe = 4 atm-g de Fe. PM=2(1)+32+4(16)
2 moles de Ca = 2 atm-g de Ca. PM=98
En una reaccin qumica hay dos tipos de
IMPORTANTE: reactivos: el reactivo limitante y el reactivo en
En los ejercicios, se tiene que trabajar siempre en exceso.
base a un mol, para poder resolver los problemas. Para poder resolver los ejercicios de reacciones se
tiene que identificar al reactivo limitante.
Ej.: Cuntos moles de carbono hay en 40 moles
C 6H14 Reactivo Limitante (RL)
Es el reactivo que se acaba rpido.
de . (Con l se trabaja)
Solucin:
Se trabaja en base a un mol, decimos: Reactivo en exceso (RE)
Es el reactivo que no se acaba.
Exclusivo para postulantes a la UNP 32
Teora de Qumica
Si tenemos que frer un saco de papas y slo Segn la reaccin4: mol de Al 2 mol de Al2O3
tenemos una botella de aceite, como el aceite es H6 H6
el que se va a acabar primero es el reactivo 20 mol de Al x mol de Al2O3
limitante. H6 4 x x = 20 x 2
x = 10 moles de Al2O3
+ Aceite
Papa frita b) El reactivo en exceso es el oxgeno, primero
calculamos los moles de oxgeno que
reaccionan.
4 mol de Al 3 mol de O2
H6
20 mol de Al x mol de O2
1.Ej.: Cuando 20 moles de Al y 20 moles de H6
oxgeno reaccionan,segn la reaccin. 4 x x = 20 x 3
4 Al + 3 O2
x = 15 (reaccionan)
2 Al2O3
H6
Calcular:
Luego los moles que sobran ser la diferencia de
a) Qu cantidad de moles de Al2O3 se formar?
los moles iniciales menos los moles que
b) Cunto de reactivo en exceso queda ? reaccionan.
Moles que sobran=20-15
Solucin:
Sobran =5 moles de O2
a) Se tiene que hallar el RL.
Clculo del nmero de moles(n)
Al O Una forma rpida para calcular el nmero de
20moles= 5 20moles= 6.67 moles es:
4moles 3moles w
n
PM
Ej.: Cuntos moles de agua hay en 90g de
agua?
Solucin:
Como de las dos divisiones, 5 es el menor, el Sabemos que el PM del agua es 18, entonces
reactivo limitante es el Al. w 90
n n 5
PM 18
Hay 5 moles de agua.
Clculo del nmero de molculas y tomos
Exclusivo para postulantes a la UNP 33
Teora de Qumica
Para calcular la cantidad de molculas o la moles de C moles de H moles de O
cantidad de tomos, primero se tiene que calcular
los moles y a este se le multiplica por NA. 30 10 60
x= y= z=
12 1 16
HNO3 x = 2.5 y = 10 z = 3.75
1. Ej.: Cuntos moles de hay en 126g de ?
P.A: H=1, N=14, O=16.
Solucin:
Hallemos el PM.
PM=1+14+3(16) Dividimos ahora entre el menor valor que es 2.5
PM=63
w 126 x = 2.5/2.5 y = 10/2.5 z = 3.75/2.5
n n 2 x=1
PM 63 y=4 z = 1.5
HNO3
Hay 2NA moles de
C1H4O1.5
2.Ej.: Cuntos tomos de fierro hay en 560g de
Listo eso es todo, el compuesto es ,
fierro?
pero como los sub ndices deben de ser enteros,
Solucin:
los multiplicamos por 2 a cada uno.
PA=56
C 2H8O3
w 560
n n 10 El compuesto ser:
PA 56
Hay 10NA tomos de Fe. Pureza de una sustancia.
Es la parte que va a reaccionar.
Procedimiento para hallar la frmula de un
NOTA: En una reaccin qumica interviene slo la
compuesto. pureza.
Se trabaja en base a 100g, porque como nos van
a dar porcentajes, es fcil sacarle cualquier Ej.: Cunto de CaO se obtendr a partir de 300 g
porcentaje a 100. de CaCO3 al 60% de pureza?
w
n
PM CaCO3 CaO + CO2
Hallamos el nmero de moles ( )
Como vamos a obtener varios valores se tiene que
dividir a todos por el menor valor.
Ej: Hallar el compuesto qumico que tiene 30% de
C, 10 % de H y 60% de O.
Solucin:
C xHyOz Solucin:
Sea el compuesto , supongamos que
tenemos en total 100g. Sacamos la pureza del CaCO3
wc arbono 30g
whidgeno 10g
woxgeno 60g Pureza=60%(300)
300g Pureza=180g
Calculamos el nmero de moles de cada uno:
Exclusivo para postulantes a la UNP 34
Teora de Qumica
Segn la reaccin: 2 H2 + O2 2 H2O
O
2(2g) 2(18g)
CaCO3 CaO + CO2
100g 56g
Luego:
4g H2 36gH2O
Luego: H6 200g H2 Xg H2O
H6 4x= (200) (36)
100g CaCO3 56g CaO
x=1800g
H6
180g CaCO3 xg CaO
H6
100x=(180)(56)
x=100,8g
Finalmente decimos:
1800g 100%
Rendimiento de una reaccin H6 xg 80%
Tambin se le puede llamar eficiencia, H6
(1800)(80)=100x=1440g
Nota: estos problemas se resuelven con una regla
de tres, ms no con un montn de frmulas
innecesarias que aparecen en los libros.
Ej.: Cuntos gramos de agua se formaran si se
NOTA: Como me dicen suficiente oxgeno
tiene 200 g de hidrgeno con suficiente oxgeno, si
entonces el reactivo limitante es el hidrgeno.
la reaccin tiene un rendimiento del 80%.
H2 + O2 H2O
O
CAPTULO 8: GASES
Las molculas de un gas se mueven de manera
Solucin:
desordenada.
Primero balanceamos:
Un gas tiene una alta entropa y alta energa
cintica
NOTA: la entropa es el desorden molecular
Ecuacin de los gases
PV RTn
(Pavo igual a ratn)
Exclusivo para postulantes a la UNP 35
Teora de Qumica
Dnde: W
P.V = R.T.n, comon =
P=Presin Reemplazamos:
PM
V=Volumen(en litros) P.V = R.T. , intercambiamos
R=contante de los gases
W
T=Temperatura(en Kelvin)
n PM
=nmero de moles P.PM = R.T. , como
W W
D=
V V
NOTA: P.PM=R.T.D
Los valores de R son:
0.082atm
R 62.4mmHg
8.3kpa
*Ojo cuando la presin este en Torr se usar 1. Ej.: La densidad de un gas a 8 atm es de 2g/L.
R=62.4Torr, debido a que 1mmHg =1 Torr. Calcular su densidad, cuando su presin sea de
16 atm.
1.Ej.: ungasa 12atmdepresinocupaun volumen
Solucin:
de10litros,cual sersu volumencuandosupresin
Como son dos casos se aplica la frmula 2
seade 8 atm,considera unprocesoisotrmico
.
Solucin:
veces.
P.PM = R.T.DP.PM = R.T.D
Se aplicala frmula 2 veces
PV RT n PV RTn 8.PM = R.T.2(I)16.PM = R.T.x.(II)
12.10 RTn...I 8.x RTn...II Dividiendo (I) y (II):
8.PM R.T.2
Igualando I y II 16.PM R.T.x
12.10 8.x =
x 15litros
8 2
16 = x
Recuerda: Que enunproceso: x=4
Isotrmico: la temperatur
a es igual.
Isovolumtrico: el volumenes igual.
Isobrico: la presines igual.
Cuando en un problema intervenga densidad,
hacemos que en la frmula de P.V = R.T.n,
fm
aparezca la densidad:
Fraccin molar ( )
Ejemplo: En un baln de gas se tienen 2 moles de
un gas A y 3 moles de un gas B. Cul es la
fraccin molar de A y la fraccin molar de B?
Exclusivo para postulantes a la UNP 36
Teora de Qumica
nT = nA + nB Gas A
nT = 2+3 = 5
A nA= 2 nA 2
fmA= =
nT 5
B nB= 3 fmA = 0.4
nB 3
fmB= =
nT 5
fmB = 0.6
fmA fmB 1 PM A
PM B
t v
A B
tB v A
Dnde:
Presiones parciales: es la presin de cada gas, t = tiempo de difusin
es proporcional al nmero de moles. v
= velocidad
1.Ej.: En unamezclade tresgasesA, B y C se tienen2
moles de A, 5 molesdeB y 3 molesde C.Si la presin MASA MOLECULAR PROMEDIO
totaldela mezcla es de 20atmCules la presinparcial
de A? masatotal
MP
Solucin: molestotales
Gas a Condiciones normales CN
nA = 2 PA = 2k
Presin 1 atm
nB = 5 PB = 5k
Volumen 22,4l
A nC = 3 PC = 3k Temperatura 273K
Luego:
B N moles n 1
PT = PA + PB + PC
C 20 = 2k + 5k + 3k
20 = 10k ENERGA CINTICA PROMEDIO PARA UN GAS
k=2
PA = 2k =2(2) 3
EC a.T
PA = 4atm 2
Dnde:
EC
= Energa cintica promedio (en joule)
T= Temperatura en (Kelvin)
a= 8,3 J/K
LEY DE GRAHAM CAPTULO 9: SOLUCIONES
Son mezclas homogneas.
Toda solucin tiene soluto y solvente.
En una solucin puede haber 1 solvente mientras
que solutos pueden haber varios.
Exclusivo para postulantes a la UNP 37
Teora de Qumica
w 480
n n
PM 40
H2O Solvente n 12
Soluto Molaridad
n 12
M M
V 6
M 2
NOTA: Si la molaridad es 2 quiere decir que:
Hay 2 moles disueltos en 1 litro de solucin
Ejemplo: Si se tiene agua con sal
*La sal es el soluto. Normalidad (N)
*El agua es el solvente
#Eq gsto
Las soluciones pueden ser: N
V
Slidas: las aleaciones. w
Lquidas: agua con sal, aguardiente. #Eq gsto
Peq
Gaseosas: el aire.
M
Peq
UNIDADES DE CONCENTRACIN
Dnde:
Molaridad (M)
Es la cantidad de moles que hay en un litro de
#Eq gsto
solucin.
n : Nmero equivalente en gramo
M sto del soluto.
V
Peq: peso equivalente.
Dnde: Existe una relacin entre la molaridad y
n: nmero de moles la normalidad
V: volumen de una solucin en litros.
N M
Ej.: En 6 litros de una solucin hay 480g de
Na(OH)
.Calcular su molaridad. VALORES DE
Na(OH) 40
PM. En un cido H2SO 4 2
Solucin:
:Es el nmero de (porque hay 2 hidrgenos)
hidrgenos
Na(OH)
6
HNO3 1
En una base Al(OH) 3 3
Hallamos el nmero de moles. :Es el nmero de (OH) (porque hay 3(OH))
Fe (OH) 2 2
Exclusivo para postulantes a la UNP 38
Teora de Qumica
En una sal CaCO 3 2 Solucin:
Clculo del PM de Na(OH)
, como el Ca
PM 23 16 1
:Es el resultado de tiene carga +2 su subndice es
PM 40
multiplicar la carga
2 Datos:
del metal por el subndice. Ca1 X 20
1 se multiplican ( ) D 1.2
2 1
2 Aplicandofrmula para la molaridad
10XD
M
PM
10 20 1.2
M M 6
Partes por milln (ppm) 40
mgsto Aplicandofrmula para la molalidad
ppm 1000X
V m
(100 X )PM
1000 20
m m 6.25
Molalidad (m) (100 20) 40
nsto
m
Kg solvente EN UNA MEZCLA DE SOLUCIONES SE CUMPLE:
=
VT
Para calcular la molaridad o la molalidad se puede
aplicar una regla prctica ms fcil.
10 X D 1000X
M m M1V1 +M2V2= MTVT
PM (100 X) PM
Dnde: V1 +V2= VT
Donde.
X: porcentaje en masa. NOTA: cuando se tenga una mezcla de tres
D: densidad. soluciones, se agrega en la frmula, es decir:
PM: peso molecular.
M1V1 M2V2 M3V3 MT VT
Na(OH)
Ej.: En una solucin acuosa de al 20% en
peso, tiene una densidad de 1.2g/cm3.Calcular su
molaridad y su molalidad. Ej.: Se mezclan 200ml de una solucin HCl cuya
molaridad es 2, con 300ml de otra solucin de HCl
cuya molaridad es 7.Calcular la molaridad de la
solucin resultante.
Exclusivo para postulantes a la UNP 39
Teora de Qumica
= CAPTULO 10: CIDOS Y BASES
VT
HCl
HCl HCl
Un cido
300mles una sustancia que tiene sabor agrio.
MT=X
Una base es una sustancia que tiene sabor
amargo.
M2=7 200ml
Pero para definir un cido o una base, tenemos 3
definiciones que +
M1=2nos dan los cientficos:
Arrhenius, Bronsted-Lowry y Lewis.
Arrhenius:
Solucin:
Volumentotal H
VT V1 V2 cido: es una sustancia que libera en
VT 500 solucin acuosa.
Aplicamosla frmula Ejemplos:
M1V1 M2V2 MT VT HCl,H2SO 4
2 200 7 300 MT 500 cidos fuertes:
MT 5
HF,NH41
cidos dbiles: , los cidos
Neutralizacin o Titulacin orgnicos.
En una neutralizacin interviene un cido y una
base. Base o lcali: es una sustancia que libera
(OH) 1
en solucin acuosa.
Ca(OH) 2 , Na(OH)
VB Bases Fuertes:
Al(OH) 3 , NH3
NB
VA :
Bases Dbil
NAVA = NBVB
NA
NOTA: Segn Arrhenius un electrolito es
aquel que conduce la electricidad, este
Ej.: En una neutralizacin se tiene 400ml de cido puede ser un cido o una base.
sulfrico cuya molaridad es 8, calcular la
normalidad de una solucin de 200ml de Na(OH). Si un cido y una base son fuertes
entonces son electrolitos fuertes, se
Solucin: disocian al 100%.
En el cido sulfricoH2SO 4
Bronsted-Lowry:
aplicamos N M
N A MA
cido: es una sustancia que dona protones
N A 2 8 N A 16
en solucin inica.
Aplicamosla frmula Base: es una sustancia que acepta
N A VA NB VB protones en solucin inica.
16 400 NB 200 Lewis:
NB 32
cido: es una sustancia que acepta
electrones porque su tomo central no ha
completado su octeto.
Exclusivo para postulantes a la UNP 40
Teora de Qumica
BH3
Ejemplo: , los cationes. HCl NH3
H* B *H Luego:
*
H
Vemos que el tomo central (B) no ha HCl + NH3 NH4+1 + Cl-1
completado su octeto, por eso es un cido CIDO BASE CIDO CONJUGADO BASE CONJUGADA
de Lewis.
Base: es una sustancia que dona electrones
porque su tomo central tiene electrones libres.
NH3 INDICADORES
Ejemplo: , los aniones. Son sustancia que a simple vista nos dicen si una
solucin es cida o bsica. Ejemplos: papel
H* N *H tornasol, naranja de metilo y la fenolftalena.
*
H
Como vemos el tomo (N) tiene 2
electrones libres, entonces es una
base de Lewis.
Cuadro de cidos y bases
Lewis
Bronsted-Lowry
Arrhenius
ste cuadro quiere decir por ejemplo:
Todo cido y base de Arrhenius es cido y
base de Bronsted-Lowry.
Todo cido y base de Bronsted-Lowry es cido
y base de Lewis.
No todo cido y base de Bronsted-Lowry es
cido y base de Arrhenius.
cidos y bases conjugadas
Todo cido tiene su base conjugada y toda base
tiene su cido conjugado.
Veamos un ejemplo:
HCl + NH3 NH4+1 + Cl-1
Como vemos en la reaccin el HCl dona un H al
NH3
, por lo tanto el HCl es un cido y como el
NH3
acepta el H es una base.
Exclusivo para postulantes a la UNP 41
Teora de Qumica
Es cuando en una reaccin la velocidad directa
llega a ser igual a la velocidad inversa.
Vd
A B C D
Vi
Vd
: Velocidad directa, velocidad con la que los
reactivos se convierten en productos.
Vi
: Velocidad inversa, velocidad con la que los
productos se convierten en reactivos.
CIDO
Recuerda:
BASE
El equilibrio qumico se da slo en las
reacciones reversibles.
El aumento o la disminucin de la velocidad
Cuando agregamos papel tornasol a una base, el papel se pone
en una azul.
reaccin depende de: la presin, del
volumen y de los catalizadores.
Cuando agregamos papel tornasol a un cido, el papel se pone
K C rojo.
CONSTANTE DE EQUILIBRIO ( )
Tambin se le llama constante de acidez, slo
depende de la temperatura.
En una reaccin, se calcula del siguiente modo:
aA g bB g cC g dD g
Kc
C c D d
A a B b
Dnde: representa la molaridad, es decir:
A
es la molaridad de A.
Kc
INDICADOR CIDO BASE NOTA: Para el clculo de slo tendremos
Papel tornasol Rojo Azul en cuenta a las sustancias gaseosas, las
Naranja de metilo Rojo Amarillo sustancias slidas o lquidas las ignoramos.
Fenolftalena Incoloro Rojo
EQUILIBRIO QUMICO
Exclusivo para postulantes a la UNP 42
Teora de Qumica
1Ej. : Hallar la constantede equilibrioen la Cada cido tiene una constante llamada
siguiente reaccin 2A g 4B g 5C g 7D g Ka
Solucin: K c
C D
5 7
constante de acidez y cada base una
A 2 B 4 Kb
constante de basidad .
2 Ej. : Hallarla constante de equilibrio enla siguiente
reaccin1A g 3B l 2C g 8D s , sila molaridad
de A 0.1 y la molaridad de C 0.02. pK a
Solucin: Potencial de la constante de acidez ( )
Slo tendremos en cuentaa las sustanciasgaseosas
pK a logK a
A y C.
Kc
C2
A 1
0.022 Ej. : Si K a 10-6,Hallar pK a
Kc
0.11
K c 4 10 3
pK a log10 6
pK a (6)
CONSTANTE EN FUNCIN DE LAS PRESIONES pK a 6
KP
PARCIALES ( )
En una reaccin, se calcula del siguiente modo: pK b
aA g bB g cC g dD g Potencial de la constante de basidad ( )
pK b logK b
PC c PD d
KP
PA a PB b Kw
Producto inico del agua ( )
K w K a K b
Pero tambin la podemos calcular de otro modo
ms fcil: K w 1014
K P K C .(RT ) n
pH
Dnde:
Potencial de Hidrgeno ( )
R=Constante de los gases.
El pH es el negativo logaritmo de la concentracin
T= Temperatura en Kelvin.
n (c d)-(a b) H
de hidrgenos
ORDEN DE UNA REACCIN
pH log H1
.
Ej. : Hallar el orden de la reaccin 2A B 3C 4D
Kc
C 3 D 4 El pH se mide en una escala, donde del 0 al 7 se
A 2 B 1 considera cido y del 7 al 14 se considera bsico.
Orden 3 4 2 1 Orden 4
NOTA : es comohallar el gradode un monomio. 0 7 14
pH cido pH bsico
pH neutro
Constante de acidez y constante de basidad
Exclusivo para postulantes a la UNP 43
Teora de Qumica
Ej. : Ej. Determinar la concentracin de hidrgenos en
Una sustanciaconpH 2,es una sustanciacida. una solucin de amoniaco 0.4M que esta ionizada
Una sustanciaconpH 10,es una sustanciabsica. al 2%
Solucin:
NOTA: La acidez y la basidad aumenta segn la 0.4 100%
figura. H 2%
0.4 x 2 H x 100
0 7 14
H 0.008M
Aumenta la acidez Aumenta la basidad
Por ejempo: una sustanciacon pH 1, es ms
cida,que una sustanciacon pH 5.
CAPTULO 11: QUMICA ORGNICA
Es llamada tambin qumica del carbono, se
0 1 5 7 14 inici cuando Federico Wohler, descubri
accidentalmente la rea al calentar el cianato de
Aumenta la acidez amonio.
pOH
Potencial de OH ( )
pOH log OH
.
pH pOH
Relacin entre ( y )
pH pOH 14
Ej. : Se tieneuna solucnacuosade Na(OH) 0.8M
Calcular su pH.Datolog2 0.3
Solucin:
pOH log OH pOH (3(0.3) 1)
pOH log0.8 pOH 0.1
8
pOH log comopH pOH 14
10
pOH (log8 log10) pH 0.1 14
pOH (3log2 1) pH 13.9
X%
Porcentaje de disociacin ( )
Llamado tambin porcentaje de ionizacin, se
calcula con un regla de tres.
M 100%
H X%
Exclusivo para postulantes a la UNP 44
Teora de Qumica
Nota: A la rea tambin se le conoce como
carbodiamida CO(NH2)2.
Propiedades del carbono:
r
le
ho
W
ich
Las propiedades del carbono son 4:
dr
ie
Fr
Obtuvo Tetravalencia: el carbono tiene 4 ligaduras.
Covalencia: el carbono forma enlaces covalentes.
Autosaturacin: llamada tambin concatenacin,
es la propiedad del carbono para formar
cadenas abiertas o cerradas.
C - C- C
1
C C
C - C- C - C C - C- C
Cadena Abierta Cadena Cerrada
Nota: Las cadenas abiertas pueden ser lineales
o ramificadas.
sp sp2
Hibridacin: el carbono tiene hibridacin ,
sp3
y .
Altropos del carbono
Exclusivo para postulantes a la UNP 45
Teora de Qumica
Carbono grafito: su forma molecular es
hexagonal. Es de color negro, adems es el
nico no metal que conduce la electricidad. Lo
podemos encontrar en la pilas.
Panasonic
DURACIN
EXTRA
AA
Hidrocarburos
Benceno
Carbono Diamante: su forma molecular es Alifticos Aromticos
tetradrica, no conduce la electricidad, su (No tienen olor) (Tienen olor)
densidad es mucho mayor a la del grafito y Entre
Entreellos
ellostenemos
tenemosa:a todos los compuestos que se derivan
tiene color cristalino. Alcanos
Alquenos
Alquinos
Ciclo alcanos
Ciclo alquenos
Ciclo alquinos
Nota: El diamante es el objeto ms duro que
existe en la naturaleza.
Hidrocarburos
Su mismo nombre lo dice son compuestos
formados por carbono e hidrgeno.
Clasificacin:
Cmo saber formar una cadena carbonada?
Es muy fcil formar una cadena, slo hay que
tener en cuenta que el carbono tiene cuatro
enlaces, osea cuatro rayitas, en cada rayita va
un hidrgeno.
En cada rayita que falte se completar con
hidrgenos.
Ej.: Formar una cadena lineal con 5 carbonos.
Primero: colocamos los 5 carbonos en una lnea.
Exclusivo para postulantes a la UNP 46
Teora de Qumica
C C CH3 CH2
C C C
Segundo: Colocar los hidrgenos que faltan.
Carbonos primarios
Son aquellos carbonos que estn rodeados por 1
C C carbono.
C C C Ej.:
CH3 CH2
Vemos que el primer carbono (el que est en
negrita) tiene una rayita eso quiere decir que le
faltan 3 rayitas, estas 3 rayitas que le faltan se la
completamos con 3 hidrgenos.
CH3 C C C Por lo tanto en la cadena hay 2 carbonos
C
primarios, son los que estn en negrita.
CH3 CH2
El segundo carbono (el que esta negrita), tiene 2
rayitas eso quiere decir que le faltan 2 rayitas,
estas 2 rayitas que le faltan se la completamos
con 2 hidrgenos.
Los carbonos que estn en negrita son carbonos
CH3 primarios, porque cada uno est rodeado por un
CH2 C carbono.
C C
Carbonos secundarios
Son aquellos carbonos que estn rodeados por 2
carbonos.
Ej.:
Continuando de la misma manera para los dems
carbonos la cadena sera:
Exclusivo para postulantes a la UNP 47
Teora de Qumica
CH3 CH2 CH2 CH2
CH3
Carbono cuaternario, porque Carbono secundario,
est rodeado de CH3 por
4 carb
C CH3
CH3
Por lo tanto en la cadena hay 3 carbonos
secundarios, son los que estn en negrita.
CH3 Hidrocarburos Alifticos
CH2 CH2 CH2 CH3
Alcanos
Llamados tambin parafinas, son compuesto
saturados que se utilizan para quemarlos
como combustible.
CnH2n+2
Frmula Global:
Los carbonos que estn en negrita son carbonos
secundarios, porque cada uno est rodeado por
dos carbonos.
Carbonos terciarios
Son aquellos carbonos que estn rodeados por 3
carbonos. Se nombran con la terminacin ano
Ej.: CH4 metano
C2H6 etano
CH3 CH3 C3H8 propano
C4H10 butano
CH CH3 C5H12 pentano
Carbono terciario, porque est rodeado de 3 carbonos. C6H14 hexano
C7H16 heptano
Los alcanos que continan se nombran como
los polgonos, por ejemplo:
C12H26 dodecano
C20H42 icosano
Carbonos Cuaternarios
Estado fsico de los alcanos:
Son aquellos carbonos que estn rodeados por 4
carbonos.
C1 - C4 Son gases.
Ej.:
C5 - C16 Son lquidos.
El resto son slidos.
Esto quiere decir que: los cuatro primeros
alcanos son gases, es verdad, ya que estos
cuatro forman el gas natural.
Exclusivo para postulantes a la UNP 48
Teora de Qumica
Formas de representar un hidrocarburo
-Un hidrocarburo se puede representar en forma
C Cl
Cl Cl
global, en forma desarrollada y en forma H
semidesarrollada. Cloroformo CHCl3
Ej.: representar al butano. H
H
H C H
Metano CH4
CH3 CH2 H
Forma Semidesarrollada
H
Forma desarrollada
Radicales de los alcanos
SeCH2
forman cuando a un alcanoCH3
le quitamos un
hidrgeno, la terminacin ano cambia por il.
Ej.:
CH4 CH3
metano metil
C2H6 C2H5
etano etil
C3H8 C3H7
propano propil
Y as sucesivamente con los dems alcanos.
Nota: el metano es un gas venenoso que
mezclado con el aire forman el gas gris, Nota: para formar una radical la terminacin ano
adems a partir del metano se obtiene el cambia por il, pero tambin puede reemplazarse
cloroformo. por ilo, por ejemplo al metil tambin se le puede
llamar metilo, y as sucesivamente.
Ismeros de los alcanos
Son compuestos que tienen la misma frmula
global pero diferente forma.
Por ejemplo el butano tiene slo 2 ismeros ellos
son:
Exclusivo para postulantes a la UNP 49
Teora de Qumica
(Isobutano)
(n-butano)
CH3
CH3
Neohexano
CH3 CH
CH3
C
CH3 CH2 CH2
CH2 CH3
CH3
CH3
CH3 CH3
Neopentano CH3
C CH3
CH3
Nota: El trmino n quiere decir normal, es decir
cuando se escribe de forma horizontal.
El trmino iso se pone cuando el alcano tiene la
forma de una Y.
Para calcular la cantidad de ismeros de un
alcano se puede utilizar las frmulas:
Iso: se utiliza cuando aparece una Y.
Ej.:
2n-4 +1 Si 4 n 7
2n-4 +(n-6)
Si 8 n 10 CH3
Dnde: n es la cantidad de carbonos. Isopropano
CH2
CH3 CH3
Ej.: Cuntos ismeros ramificados tiene el n-
heptano? Isobutano CH
UNP-Febrero 2014. CH3
CH3
Solucin:
Como n=7, aplicamos la primera frmula.
27-4 +1=9, pero se tiene que restar 1, porque el n-
heptano est incluido hay y el no es ramificado.
Rpta 8.
-Hay algunos trminos que hay que
aprender estos son: Neo, Iso, Cis, Trans.
Cis: tiene dos trminos iguales en lnea
Nota: para nombrarlos se tiene que contar la horizontal (x).
cantidad de carbonos.
Neo: se utiliza cuando aparece una cruz.
Ej.:
Exclusivo para postulantes a la UNP 50
Teora de Qumica
x
CH3 CH2 CH3
CH3
CH2
x n
CH CH3
CH CH
m
CH
CH2
Ej.: Nombrar el siguiente compuesto.
Como hay 8 carbonos se llamar cis-nonano.
Trans: tiene dos trminos iguales en lnea
CH3 CH2 CH3 diagonal (x).
CH3
CH2
n
CH3
CH
x x
CH
CH
CH2
CH
m
Como los dos trminos de la parte de arriba
son iguales, se trata de un compuesto cis.
Se cuenta la cantidad de carbonos que hay en Ej.: Nombrar el siguiente compuesto.
total.
Exclusivo para postulantes a la UNP 51
Teora de Qumica
CH3 Nota: Los ismeros de los compuestos cis o
trans se llaman ismeros geomtricos.
CH2 ( )
Alquenos
Llamados tambin olefinas, son compuestos
CH3
sp2
CH2
CH3 insaturados tienen hibridacin , adems
decoloran la solucin de permanganato de
CH3 potasio.
CH CnH2n
Frmula Global:
CH
CH2
Se nombran con la terminacin eno
C2H4 eteno
C3H6 propeno
Como los trminos de la diagonal son iguales, C4H8 bueno
se trata de un compuesto Trans. C5H10 penteno
Se cuenta la cantidad de carbonos que hay en Y as sucesivamente.
total.
Ej: si quisiramos escribir el octeno, entonces n=8
CH3 C nH2n
Reemplazamos en la frmula .
CH2 C 8H16
Octeno: .
CH3 En forma semidesarrollada:
CH2 CH2 Eteno
CH2
CH3
CH2 CH CH3 Propeno
CH3 CH2 CH CH2 CH3 Buteno
CH
CH
CH2
Radicales de los alquenos:
Los radicales de los alquenos son 2: el vinil y el
alil.
El vinil se origina cuando al eteno le quitamos un
hidrgeno.
Como hay 9 carbonos se llamar Trans-
nonano.
Exclusivo para postulantes a la UNP 52
Teora de Qumica
CH2 CH CH CH Etino
Vinil o Vinilo CH C CH3 Propino
El Alil se origina cuando al propeno le quitamos Ciclo alcanos
un hidrgeno. Son compuestos de cadena cerrada que
presentan enlace simple.
CH2 CH CH2 Ej.:
Alil o Alilo
Alquinos ( )
Llamados tambin acetilnicos, son compuestos
insaturados que tienen enlace triple e hibridacin
sp
.
Frmula Global:
CnH2n-2
Ciclo hexano
Ciclo propano
Ciclo Butano
Se nombran con la terminacin ino
C2H2 Etino o Acetileno
Ciclo pentano
C3H4 Propino
C4H6 Butino
C5H8 Pentino
Y as sucesivamente.
Ej: si quisiramos escribir el octino, entonces n=8
C nH2n-2
Reemplazamos en la frmula . Nota: en cada vrtice de cada figura geomtrica
C 8H14 van carbonos con hidrgenos.
Octeno: .
En forma semidesarrollada:
Exclusivo para postulantes a la UNP 53
Teora de Qumica
CH2
<>
CH2 CH2
Ciclo propino
Ciclo Butino
Radicales de los ciclo alcanos
Al igual que los radicales de los alcanos, la
terminacin ano cambia por il.
Ciclo Alcano Radical
Nota: Un hidrocarburo de cadena cerrada puede
ser:
Homocclico: es cuando en cada vrtice tiene
Ciclo propano Ciclo propil carbonos.
Ej.:
<> C C
C C
Ciclo Butano Ciclo Butil
C
C
Ciclo alquenos Heterocclico: es cuando tiene al menos en
Son compuestos de cadena cerrada que tiene sus vrtices un elemento diferente al carbono.
enlace doble. Ej.:
Ej.:
N
Ciclo propeno
FUNCIONES OXIGENADAS
Son aquellas que contienen oxgeno.
Ciclo Buteno
Alcoholes: R - (OH)
Y as sucesivamente con los dems.
Presentan el grupo hidroxilo (OH), que tambin
Ciclo alquinos se le llama oxidrilo.
Son compuestos de cadena cerrada que tienen Ej.:
enlace triple.
Exclusivo para postulantes a la UNP 54
Teora de Qumica
CH3 CH2(OH)
Este carbono est rodeado
por 1 carbono, por ello es un
alcohol primario.
CH3 Isopropanol
CH
CH3
CH3 Propanol o alcohol proplico
CH2
CH3 Etanol o alcohol etlico
CH2 CH3 (OH) Metanol o alcohol metli
OH CH2 (OH)
(OH)
) Secundario: Cuando el carbono
Alcohol que
lleva el (OH) est rodeado por dos carbonos.
Ej.:
CH3 CH
Este carbono est rodeado
por 2 carbonos, por ello es un alcohol secundario.
Recuerda que n-propanol es el mismo propanol,
el n quiere decir normal.
n-propanol
CH3 CH2
CH2 (OH)
)
Nota: tambin se le puede quitar la rayita donde
va el (OH).
Ej:
Reacciones que hay que conocer:
Cuando un alqueno reacciona con el agua se
obtiene un alcohol, pero para ello se tiene que
CH3 Propanol H2SO 4
CH2 CH3(OH) Metanol
utilizar como catalizador.
CH3 CH2(OH) Etanol
Ej.: Al reaccionar el eteno con agua generar
CH2(OH) etanol.
)
Alcohol primario: Cuando el carbono que
lleva el (OH) est rodeado por un carbono.
Ej.:
Al fermentarse un azcar se genera alcohol etlico,
la reaccin es la siguiente:
Exclusivo para postulantes a la UNP 55
Teora de Qumica
C6H12O6 C2H5(OH)+ CO2
Glucosa Etanol
CH3 Butanona
CO Propanona o Acetona
CH3 CO CH3
CH2 CH3
Aldehdos: R - (CHO)
cidos carboxlico: R - (COOH)
Son compuestos solubles en agua. Estn
formados por el grupo formilo (CHO), se
obtienen por la oxidacin de los alcoholes
primarios.
Se nombran con la terminacin al. Son compuestos que estn formados por el
Ej.: grupo carboxilo (COOH).
Uno de los cidos carboxlico ms importante es
el cido actico debido a que es un componente
del vinagre.
CH3 Propanol oCH2
propinaldehido Se nombran con la terminacin oico.
H CHO Metanal o formaldehido
Ej.:
CH3 CHO Etanal o acetaldehido
CHO
CH3 cido propanoco
CH2 H COOH cido metanoico o cido
CH3 COOHcido etanoico o cido
Nota: COOH
El formaldehido es gaseoso y si lo disolvemos
en agua obtenemos el formol.
Cetonas: R - CO - R
Y as sucesivamente con los dems cidos,
recuerda que se nombran dependiendo de la
cantidad de carbonos, por ejemplo:
1. Ej.: Formar el cido Exanoico
Estn formadas por el grupo carbonilo (CO), se
obtienen por la oxidacin de los alcoholes Solucin:
secundarios. Exa, quiere decir que hay 6 carbonos
Se nombran con la terminacin ona.
Exclusivo para postulantes a la UNP 56
Teora de Qumica
CH3 CH2 CH2 CH2
4 CH2
3
CH3
CH3
2. Ej.: formar el cido propanodioico. CH CH2 COO
Solucin:
El trmino dioico quiere decir que hay 2
COOH.
Luego el cido propanodioico ser:
CH3 COO COOH Acido 3 metil-butanoico.
Otra forma de nombrar la cadena es utilizando
la nomenclatura comn, cuya numeracin se
hace con letras griegas.
Recuerda: que el trmino propa quiere decir
que tiene que haber 3 carbonos.
3. Ej.: Nombrar la siguiente cadena.
CH3
CH3
CH3 CH CH2 COO
CH3
CH CH2 COOH
Nota: no se cont a partir del carbono del
COOH, porque a este carbono no le pueden
salir radicales. La nomenclatura comn dice que
empieza a contar de los carbonos que pueden
Solucin: tener radicales.
En este caso se le da preferencia al grupo
carboxlico.
steres: R - COO - R
Exclusivo para postulantes a la UNP 57
Teora de Qumica
Se forman cuando reaccionan un cido Aminas: R - (NH2)
carboxlico y un alcohol.
cido carboxlico + Alcohol ster + Agua
Resulta cuando al amoniaco NH3 le quitamos un
hidrgeno.
Ej.:
Ej.:
CH3 COO
CH3 Etil -amina
CH2 CH3 NH2 Metil-amina
NH2
El trmino oico cambia por ato y el trmino anol
cambia por ilo.
Amina primaria:
ter: R - O - R
Cuando su nitrgeno est rodeado por 1
carbono.
Ej.:
CH3 NH2
Estn formados por el grupo oxi (O).
Se nombran con la terminacin oxi.
Amina Secundaria:
Cuando su nitrgeno est rodeado por 2
carbonos.
Ej.:
CH3 CH2 CH3 NH CH3
O CH2 CH3 O
Metil - oxi -etil
CH2 CH3
Etil oxi - propil )
Amidas: R - (CONH2)
FUNCIONES NITROGENADAS
Son compuestos que contienen nitrgeno, estos
pueden ser: las aminas y las amidas.
Exclusivo para postulantes a la UNP 58
Teora de Qumica
Son compuestos cuaternarios porque tienen 4
elementos qumicos C, H, O y N.
Ej.:
H CONH2 Metil-amida
CH3 CONH2 Etil amida Debido a esta rotacin de los enlaces el benceno
lleva un crculo dentro llamado anillo bencnico.
Radical del benceno:
El benceno tiene un radical llamado fenil:
Nitrilos: R CN
< >C6H5
Son compuestos que tiene el grupo ciano CN
Ej.:
Etano-nitrilo
CH3 H CN Metano-nitrilo
CN
Nota: un radical se forma cuando quitamos un
hidrgeno y aparece una rayita.
Derivados del benceno:
Tolueno o metil benceno
HIDROCARBUROS AROMTICOS
Estos compuestos nacen a partir del benceno, se
les llama aromticos. CH3
El benceno C6H6
Es un compuesto homocclico, que presenta
resonancia.
El benceno se puede escribir as:
Xileno
Pero como los enlaces pueden ir rotando, por ello
tambin se puede escribir as:
Exclusivo para postulantes a la UNP 59
Teora de Qumica
CH3
NO2
CH3
Anilina
Fenol o hidroxibenceno
NH2
OH
Anisol
Nota: el fenol NO es un alcohol, no tiene
absolutamente nada que ver con el alcohol. O CH3
cido benzoico
COOH
Piridina
Nitrobenceno Trinitrotolueno (TNT)
Exclusivo para postulantes a la UNP 60
Teora de Qumica
NO2
CH3 Nota: A partir del naftaleno se obtiene la naftalina
que es una sustancia voltil, es decir se evapora
fcilmente.
NO2
Antraceno
NO2
Fenantreno
Nota: este compuesto es el que conforma la
dinamita.
Trinitrofenol o cido pcrico
NO2
Hay algunos trminos que tenemos que aprender,
ellos son: orto, meta y para.
OH
Orto 12
Meta 13
NO2 Para 14
Los nmeros representan las numeraciones que
se hacen tal que los radicales reciban siempre la
numeracin ms baja.
NO2
1. Ej.: Representar el orto-xileno.
Naftaleno
Exclusivo para postulantes a la UNP 61
Teora de Qumica
2
CH3
CH3
4
CH3 CH3
1
1
2 3
Nota: Orto quiere decir que los radicales estn
en la posicin 1,2. REGLAS PARA NOMBRAR CADENAS
2. Ej.: Representar el Meta-xileno. Elegir la cadena ms larga.
Al enumerar la cadena, tratar en lo posible de
estar siempre ms cerca al radical; pero
2 cuando hayan enlaces dobles o triples se les
dar prioridad a estos, de modo que tengan la
CH3 CH3 numeracin ms baja
Cuando hay radicales diferentes el radical ms
1 complejo es el que tiene preferencia, es decir
recibe la numeracin ms baja.
3 Cuando en una cadena el enlace doble y el
triple estn a la misma distancia el doble tiene
preferencia, teniendo este la numeracin ms
baja.
1. Ej.: Nombrar la cadena.
3. Ej.: Representar el Para-xileno.
CH3 CH2
CH3
Solucin:
Primero elegimos la cadena ms larga.
Exclusivo para postulantes a la UNP 62
Teora de Qumica
CH3 CH2 CH2 CH2
CH3 CH3 C
CH2
CH3
Segundo enumeramos siempre ms cerca al
radical.
CH3 CH2 CH2 CH2
CH3
Radical
Solucin:
Primero elegimos la cadena ms larga.
Enumerando:
6 CH3 CH2
5
4 CH3
3
1
2
CH3 CH2
CH3
La cadena se llama: 2-metil-hexano.
2. Ej.: Nombrar la cadena.
Segundo enumeramos siempre ms cerca al
radical.
Exclusivo para postulantes a la UNP 63
Teora de Qumica
1 7
2
8
7 3
1
4
2
8 6
5
9
CH3 CH2
CH3
H3
2,2 dimetil- 4 etil octano.
4. Ej.: Nombrar la cadena.
CH2 CH3
C2H5
CH3
3,5 dimetil-nonano.
Nota: cuando hayan dos radicales, se le
nombra con la terminacin di, cuando hayan
3 tri y as sucesivamente.
Solucin:
3. Ej.: Nombrar la cadena. Como podemos observar los radicales estn a
la misma distancia. En este caso tiene mayor
jerarqua el radical ms grande.
CH2 CH2 CH3
C2H5 CH2 CH3
CH3
CH3
C2H5
CH3
Solucin: 6 metil-3 etil-octano.
Elegimos la cadena ms larga y siempre ms
cerca al radical. Nota: los radicales se pueden nombrar de dos
formas:
En orden creciente a complejidad
Exclusivo para postulantes a la UNP 64
Teora de Qumica
(El ms usado): 6 metil-3 etil-octano. 8
7
En orden alfabtico: 3 etil-6 metil-octano. 3
2
3
4
5. Ej.: Nombrar la cadena. 5
CH3 CH CH CH2
Solucin: 1,6 octadieno.
Siempre ms cerca al enlace.
7. Ej.: Nombrar la cadena.
CH3 CH CH CH2 1 2 3
CH3 CH2
CH3
2-penteno.
Nota: Se tiene que escribir el nmero en el cual
va el enlace, este est antes de pasar el Solucin:
enlace. Si bien es cierto el radical est ms cerca, pero
el enlace doble tiene la preferencia, por ello se
6. Ej.: Nombrar la cadena. empieza a contar de izquierda a derecha.
CH3 CH
6
5 CH CH2
4
CH2
3
Solucin:
Siempre ms cerca al enlace, como hay dos
enlaces dobles se le llamar dieno.
6 metil-3 hepteno.
Exclusivo para postulantes a la UNP 65
Teora de Qumica
8. Ej.: Nombrar la cadena.
1. Ej.: Nombrar la cadena.
CH3 CH CH C CH
Solucin:
Enumeramos la cadena ms larga y colocamos
puntitos para contar sin equivocarnos.
2 4 6
Solucin: 1 3 5 7
Cuando se tiene enlace doble y triple, estos
deben de tener la numeracin ms baja. Por
ello empezaremos de derecha a izquierda.
5 4 3 2 1
CH3 CH CH C CH
La cadena se llama: Heptano
2. Ej.: Nombrar la cadena.
3 penteno-1 ino.
Solucin:
9. Ej.: Nombrar la cadena. Elegimos la cadena ms larga, la ramita que
est encerrada es el radical metil.
CH3 CH CH CH2 C C CH3 Metil
Empezamos a contar siempre ms cerca al
radical.
Solucin: 2 4 6 8
El enlace doble y el triple estn a la misma
distancia ,en este caso el doble tiene
preferencia. 1 3 5 7
1 2 3 4 5 6 7
CH3 CH CH CH2 C C CH3
4 metil-octano.
3. Ej.: Nombrar la cadena.
2 hepteno -5 ino.
CADENAS EN FORMA DE ZIG ZAG
Exclusivo para postulantes a la UNP 66
Teora de Qumica
Solucin:
Elegimos la cadena ms larga, dos ramitas Solucin:
significa el radical etil. Se elige la cadena ms larga, que es para
abajo.
Luego enumeramos.
etil
2
1 3
44
Metil
5
2 4 6 8
Etil 6
1 3 5 7 9
3 etil-hexano.
CADENAS CARBONADAS CCLICAS
4 metil-3 etil-nonano.
1. Ej.: Nombrar la cadena.
4. Ej.: Nombrar la cadena.
CH3
NO2
Solucin:
El enlace doble tiene preferencia. CH3
2 4 6 8
1 3 5 7
Solucin:
Cuando hay radicales iguales, siempre se
empieza a contar por el diferente.
5 metil- 2 octeno.
5. Ej.: Nombrar la cadena.
Exclusivo para postulantes a la UNP 67
Teora de Qumica
2 1
4
5 3 5
3
4
C2H5
2
1 NO2 CH3
6
CH3
CH3 6
2 metil-1 etil benceno.
2,3 dimetil 1 nitro ciclohexano.
3. Ej.: Nombrar la cadena.
Nota: la numeracin se hizo en sentido
antihorario, porque de esta manera los
radicales tendrn la numeracin ms baja.
2. Ej.: Nombrar la cadena.
CH3
C2H5
CH3 Solucin:
Se tiene que enumerar primero todo el enlace
doble.
1 6
2 4
3 5
CH3
Solucin:
El radical ms complejo tiene la preferencia.
4 metil -1 ciclo hexeno.
4. Ej.: Nombrar la cadena.
Exclusivo para postulantes a la UNP 68
Teora de Qumica
CH3
CH3
CH3
OH NO2
NO2
Solucin:
El OH tiene preferencia sobre cualquier radical.
Solucin:
Se empieza a contar por el radical diferente.
CH3
CH3
3 2
OH 4
1
6
5
CH3
1
NO2
6 2
5 3
NO2
4
2,3 dimetil-1 hidroxi-ciclohexano. 2,3 dinitro-1 metil- benceno.
5. Ej.: Nombrar la cadena. PROBLEMAS RESUELTOS
1. Cientfico que descubri de manera accidental el
primer compuesto orgnico llamado rea.
a) Kolbe
b) Wurtz
c) Grinard
d) Wohler
e) Dalton
Solucin:
Fue el cientfico alemn Friedrich Wohler.
Exclusivo para postulantes a la UNP 69
Teora de Qumica
Rpta: d Rpta: a
2. Se les llama compuestos insaturados a:
a) Alcanos
b) Alquenos 5. Calcular la suma de enlaces Sigma y pi del
c) Alquinos benceno.
d) Parafinas a) 12
e) b y c b) 15
c) 16
Solucin:
Los compuestos insaturados son: los alquenos d) 17
y los alquinos. e) 18
Solucin:
Rpta: e El benceno tambin se puede representar as:
3. La autosaturacin es la propiedad del carbono
en la que ste forma cadenas abiertas o
cerradas, a esta propiedad tambin se le
conoce como: Ahora se desarrolla teniendo en cuenta que en
a) Tetravalencia cada vrtice hay un carbono.
b) Concatenacin
c) Hibridacin
d) Covalencia
e) Alotropa
Solucin:
A la autosaturacin tambin se le conoce como
CONCATENACIN.
Rpta: b
4. Relacionar.
I. Compuestos Saturados ( ) Alcoholes
II. Tienen el grupo (OH) ( ) Alcanos
III. Tienen hibridacin sp ( ) Alquinos
a) II,I,III b) I,II,III c) III,II,I d) I,III,II e) II,III,I
Solucin:
La relacin correcta es: II, I y III.
Exclusivo para postulantes a la UNP 70
Teora de Qumica
6. Al fermentarse la azcar produce un compuesto
orgnico llamadoestos compuestos
poseen el grupo..
a) Alcohol-cetnico
b) Alcohol-carboxlico
c) Alcohol-Hidroxilo
d) Benceno-Fenilo
e) Aldehdo-Oxidrilo
Solucin:
La fermentacin de un azcar produce alcohol,
estos compuestos tiene el grupo hidroxilo (OH)
llamado tambin oxidrilo.
Rpta: c
7. Se consideran las propiedades del carbono.
1) La tetravalencia
2) La autosaturacin
sp3 sp2 sp
3) Presentar hibridacin , y .
Son ciertas:
a) Solo 1
b) Solo2
H c) Solo3
d) 1 y 2
e) Todas las anteriores.
H H UNP-AGOSTO 2015.
C Solucin:
C C
Todas son correctas porque las propiedades
del carbono son: la tetravalencia, la
C C autosaturacin y la hibridacin.
C
Rpta: e
H
Sigmas =12 y pi =3, luego la suma es 15
Rpta: b
8. Indique la sustancia que presenta un ster.
Exclusivo para postulantes a la UNP 71
Teora de Qumica
a) I y II b) I,III y IV c) II y IV d) II,III y IV e)Todas
UNP-ABRIL 2015.
Solucin:
c) b)
I. (V):Una cadena abierta puede ser:
d) a)
e)
C
C
RamificadaLineal C C
NH CH3
UNP-ABRIL 2015.
Solucin:
Un ster tiene la siguiente forma:
R - COO - R, por ello la respuesta es:
COO
II. (V):Una cadena abierta puede ser :
C C
Insaturada (Puede tener enlaces dobles o triples). C
Rpta: b Satura
III. (V): Los compuestos de cadena cerrada
pueden ser aromticos como el benceno.
9. Diga que proposiciones son correctas: IV. (V): A partir de la autosaturacin (formacin
I. Los compuestos de cadena abierta pueden de cadenas) se forman los millones de
ser lineales o ramificados. hidrocarburos.
II. Los compuestos de cadena abierta pueden
ser saturados e insaturados. V. (V): Los compuestos de cadena cerrada
III. Los compuestos de cadena cerrada pueden pueden ser:
ser aromticos o alicclicos.
IV. Los hidrocarburos se constituyen en base
de la propiedad de la autosaturacin.
V. Los compuestos de cadena cerrada pueden
ser sustituidos, saturados e insaturados.
Exclusivo para postulantes a la UNP 72
Teora de Qumica
12. Cul es el principal componente del gas
natural?
CH3 a) Monxido de carbono
Insaturados
b) Butano
Saturados c) Propano
d) Metano
e) Gases ligeros del petrleo
Sustituidos
UNP-AGOSTO 2011.
(Tiene radicales)
Rpta: d
Rpta: e
13. La frmula del benceno es C6H6, Calcula la
masa en gramos de carbono que existen en 39
PROBLEMAS PROPUESTOS g de benceno.
10. El nmero de enlaces sigma del cido: a) 6 b) 12 c) 36 d) 24 e) 30
CH3 CO(CH2)2 COOH
UNP-AGOSTO 2011.
Rpta: d
a) 12 b) 13 c) 15 d) 14 e) 18
UNP-ABRIL 2013-MEDICINA 14. La masa molecular de metil-fenil-cetona es:
Rpta: c
a) 98 b) 120 c) 110 d) 102
e) 108
UNP-ABRIL 2010.
Rpta: b
11. El peso molecular del 2-butanol es:
a) 80g/mol
b) 78g/mol
c) 72g/mol
d) 76g/mol
e) 74g/mol
15. Cul es el nombre del siguiente compuesto?
UNP-AGOSTO 2011.
Rpta: d
Exclusivo para postulantes a la UNP 73
Teora de Qumica
UNP-ABRIL 2012.
Rpta: d
CH3
CH2
CH2 CH3 17. Son propiedades generales de los cidos,
excepto:
CH3 CH CH3 a) Neutralizan a las bases
b) Son insolubles en agua
CH3
C c) Enrojecen el papel tornasol CH2
d) Por reaccin con muchos metales liberan
hidrgenos
e) frente a la fenolftalena se mantiene incoloros
UNP-ENERO 2011.
Rpta: b
a) 2,2 dimetil 4 propil 5,5 etil nonano 18. La frmula molecular C 4H8O corresponden a
b) 2,2 dimetil 4 metil 6,6 dietil octano los siguientes compuestos:
c) 2,2 dimetil 4 propil 5,5 dietil octano 1) ter metiletlico
d) 2,2 dimetil 4 isopropil 6,6 dietil 2) Butanona
octano 3) Butanol
e) 2,2 dimetil 4 propil 5,5 etilo octano 4) 1butanol
5) 2-metil -2 propanol
UNP-ABRIL 2010-MEDICINA
Rpta: d
a) 1,2 y 4 b) 1,3 y 5 c) 4 y 5
d) 1,2 y 5 e) 2 y 3
UNP-NOVIEMBRE 2010.
Rpta: e
16. El otro nombre qumico de la rea es:
a) Metil amida
b) Propil amida
c) Butil amida
d) Carbodiamida
e) Butildiamida
Exclusivo para postulantes a la UNP 74
Вам также может понравиться
- Taller de Nivelación - La MateriaДокумент10 страницTaller de Nivelación - La MateriaLina VidalesОценок пока нет
- Guía Métodos de Separación de MezclasДокумент5 страницGuía Métodos de Separación de MezclasMassiel Vergara100% (2)
- Taller de Quimica CandeДокумент6 страницTaller de Quimica CandeWalter CanoОценок пока нет
- La Materia Mezclas Paar ImprimirДокумент5 страницLa Materia Mezclas Paar Imprimirjohnx820Оценок пока нет
- Quimica 02Документ4 страницыQuimica 02xsHaDoWnxОценок пока нет
- Semana 1 SM QuímicaДокумент9 страницSemana 1 SM QuímicaMarita SilvaОценок пока нет
- Clasificacion de La MateriaДокумент2 страницыClasificacion de La Materiarosvall100% (1)
- 5º Materia y EnergiaДокумент5 страниц5º Materia y EnergiaNiko JudoОценок пока нет
- Nivelación Quimica 10Документ8 страницNivelación Quimica 10LorenitaLäväöОценок пока нет
- Teoria Cinetica en Liquidos y SolidosДокумент5 страницTeoria Cinetica en Liquidos y SolidosLm SunОценок пока нет
- Taller de Mezclas.Документ5 страницTaller de Mezclas.mitulipan2710Оценок пока нет
- 12 Quimica 3Документ24 страницы12 Quimica 3mireyda herrera100% (1)
- Trabajo de QuimicaДокумент6 страницTrabajo de QuimicaWalter Cano100% (1)
- Materia y Energìa 5to Año 1 UnidadДокумент7 страницMateria y Energìa 5to Año 1 UnidadGerman Junior Toribio CamposОценок пока нет
- Clase 1 Rombo de Seguridad Almacenamiento de Sustancias Código de Colores.Документ4 страницыClase 1 Rombo de Seguridad Almacenamiento de Sustancias Código de Colores.Lorena FrancoОценок пока нет
- Separación de Mezclas y AplicacionesДокумент1 страницаSeparación de Mezclas y AplicacionesMariana CaralampioОценок пока нет
- Estado de La MateriaДокумент2 страницыEstado de La MateriaEyda MaciasОценок пока нет
- Unidad I - Quimica GeneralДокумент9 страницUnidad I - Quimica GeneralMilagros LeonОценок пока нет
- MATERIA - Sesion 2Документ6 страницMATERIA - Sesion 2eduardofnaf12312Оценок пока нет
- Conglomerantes PDFДокумент6 страницConglomerantes PDFAlejandro Zamora SolórzanoОценок пока нет
- Guia Materia y EnergíaДокумент9 страницGuia Materia y EnergíaLuciana pОценок пока нет
- Quimica Decimo-Geronimo MarinДокумент3 страницыQuimica Decimo-Geronimo MarinCesar Alejandro Henao MendozaОценок пока нет
- Guía 02 - QUIMICAДокумент5 страницGuía 02 - QUIMICASANDY MURCIAОценок пока нет
- ConglomerantesДокумент6 страницConglomerantesAymarRaúlPortilloCazorlaОценок пока нет
- Guía de QuímicaДокумент36 страницGuía de Químicaredsocial1102Оценок пока нет
- La Materia Mezclas Paar ImprimirДокумент7 страницLa Materia Mezclas Paar ImprimirNicoll Natalia Poveda OrjuelaОценок пока нет
- Semana 01 Materia y EnergíaДокумент6 страницSemana 01 Materia y EnergíaJose Antonio Tello PoloОценок пока нет
- ACTIVIDA1Документ8 страницACTIVIDA1anis perezОценок пока нет
- Separación de Mezclas (Decantacion)Документ31 страницаSeparación de Mezclas (Decantacion)liseth ruizОценок пока нет
- Mapa Conceptual de Los Estados de La Materia 3Документ1 страницаMapa Conceptual de Los Estados de La Materia 3rojascarbajalcarlosrafaelОценок пока нет
- Tratamiento de Materiales MineralogicosДокумент13 страницTratamiento de Materiales Mineralogicosnickel de la cruz fortuna100% (3)
- Cuarentena 9Документ6 страницCuarentena 9JOSE CARLOS DIAZ TRIANAОценок пока нет
- Quimica Tema1Документ5 страницQuimica Tema1CARNERO OLIVARES LOURDES LUZ DEL PILARОценок пока нет
- Resumenes Parciales QuímicaДокумент60 страницResumenes Parciales QuímicajhoheyjumeОценок пока нет
- El AguaДокумент1 страницаEl Aguacamila condoriОценок пока нет
- QUIMICAAET2Документ4 страницыQUIMICAAET2TOCAS MALCA VICTOR ANDREОценок пока нет
- Clasificación de La Materia para Segundo Grado de SecundariaДокумент5 страницClasificación de La Materia para Segundo Grado de SecundariaEduardo AllemantОценок пока нет
- Actividad N°3-Mezclas-Métodos de SeparaciónДокумент4 страницыActividad N°3-Mezclas-Métodos de SeparaciónbwonkinistaОценок пока нет
- 3.1. La Materia-ClasificacionДокумент6 страниц3.1. La Materia-ClasificacionjuanОценок пока нет
- Materia y EnergíaДокумент14 страницMateria y Energíateranhfelix20Оценок пока нет
- Guia de Materia 4 GradoДокумент4 страницыGuia de Materia 4 GradoRosiDanisОценок пока нет
- Propiedades de La MateriaДокумент11 страницPropiedades de La MateriaJavier Suarez VillaОценок пока нет
- Cuadro Sinoptico Propiedades de La MateriaДокумент1 страницаCuadro Sinoptico Propiedades de La MateriaErick gonzalez HernandezОценок пока нет
- Taller 1 Materia y EnergiaДокумент12 страницTaller 1 Materia y EnergiaJose Dayan DUQUE CADENAОценок пока нет
- Clase 6 - Físico - QuímicaДокумент4 страницыClase 6 - Físico - QuímicaAlvaro FernandezОценок пока нет
- Química Tema 4Документ4 страницыQuímica Tema 4nahumОценок пока нет
- 05 Ciencia y Ambiente Mes de JulioДокумент14 страниц05 Ciencia y Ambiente Mes de JuliosofiaОценок пока нет
- Ot21 Sep Quim2 1Документ5 страницOt21 Sep Quim2 1JonathanArandaAОценок пока нет
- 1er - Parcial Quimica1Документ21 страница1er - Parcial Quimica1Ebed Gabriel Montes RochaОценок пока нет
- 3° Resumen Cientifico - 23 Agosto - Ciencia y TecnologiaДокумент1 страница3° Resumen Cientifico - 23 Agosto - Ciencia y TecnologiaDenisse Rojas OrellanaОценок пока нет
- Actividad #4. Teoría. Sistemas MaterialesДокумент3 страницыActividad #4. Teoría. Sistemas MaterialesDaniel Jose MendiciniОценок пока нет
- Volume Nes Molar Es Parcial EsДокумент34 страницыVolume Nes Molar Es Parcial EszekyvillagarciaОценок пока нет
- Sistemas Materiales y Métodos de SeparaciónДокумент2 страницыSistemas Materiales y Métodos de SeparaciónSandra HambergОценок пока нет
- Ref 5Документ2 страницыRef 5enkaramadorОценок пока нет
- Metodos de Separación de MezclasДокумент2 страницыMetodos de Separación de MezclasCatalina Silva GonzalezОценок пока нет
- Tema 3 2ºAДокумент58 страницTema 3 2ºAMonica SalgadoОценок пока нет
- MateriaДокумент28 страницMateriawchoqueОценок пока нет
- Word Basico - Mod 2 - Cap 3Cb2R5ZДокумент1 страницаWord Basico - Mod 2 - Cap 3Cb2R5Zgonzales994Оценок пока нет
- Oraciones Nuevas.Документ6 страницOraciones Nuevas.gonzales994Оценок пока нет
- Fisica 3 - Aplicaciones de Los Capacitores - Pantalla TáctilДокумент8 страницFisica 3 - Aplicaciones de Los Capacitores - Pantalla Táctilgonzales994Оценок пока нет
- Trabajo de GeoДокумент13 страницTrabajo de Geogonzales994Оценок пока нет
- Pelicula El NaufragoДокумент2 страницыPelicula El Naufragogonzales994Оценок пока нет
- Pelicula El NaufragoДокумент2 страницыPelicula El Naufragogonzales994Оценок пока нет
- Campos VectorialesДокумент1 страницаCampos Vectorialesgonzales994Оценок пока нет
- Sesión 4 - Algebra I - Clases Laterales - Subgrupo Normal - Teorema de LagrangeДокумент8 страницSesión 4 - Algebra I - Clases Laterales - Subgrupo Normal - Teorema de Lagrangegonzales994100% (1)
- Microsoft Word - Examen de Redimiento AcadémicoДокумент3 страницыMicrosoft Word - Examen de Redimiento Académicogonzales994Оценок пока нет
- Preguntas Aritmetica ArnoldДокумент3 страницыPreguntas Aritmetica Arnoldgonzales994Оценок пока нет
- Algo Mejor VendráДокумент1 страницаAlgo Mejor Vendrágonzales994Оценок пока нет
- Sesion 1 - Algebra I - HomomorfismosДокумент8 страницSesion 1 - Algebra I - Homomorfismosgonzales994Оценок пока нет
- Preguntas Aritmetica ArnoldДокумент3 страницыPreguntas Aritmetica Arnoldgonzales994Оценок пока нет
- Trabajo Final Ecuaciones Diferenciales ParabolicasДокумент20 страницTrabajo Final Ecuaciones Diferenciales Parabolicasgonzales994Оценок пока нет
- Pedagogía PersonalizadaДокумент9 страницPedagogía Personalizadagonzales994Оценок пока нет
- Práctica Dirigida N - 04 Construcciones GeométricasДокумент2 страницыPráctica Dirigida N - 04 Construcciones Geométricasgonzales994Оценок пока нет
- Relaciones BinariasДокумент9 страницRelaciones BinariasJavierGomezОценок пока нет
- Informe Asignacion2Документ22 страницыInforme Asignacion2gonzales994Оценок пока нет
- Conjuntos B PDFДокумент15 страницConjuntos B PDFItalo Sánchez AnguloОценок пока нет
- Consulta EspiritualДокумент2 страницыConsulta Espiritualgonzales994Оценок пока нет
- Oraciones NiñosДокумент1 страницаOraciones Niñosgonzales994Оценок пока нет
- Areas de Figuras PlanasДокумент13 страницAreas de Figuras PlanasLuis Fernando100% (2)
- Algebra III - Extensiones AlgebraicasДокумент3 страницыAlgebra III - Extensiones Algebraicasgonzales994Оценок пока нет
- Avances Geo 2Документ8 страницAvances Geo 2gonzales994Оценок пока нет
- Los SupercampeonesДокумент1 страницаLos Supercampeonesgonzales994Оценок пока нет
- Avances Geo 2Документ8 страницAvances Geo 2gonzales994Оценок пока нет
- Los SupercampeonesДокумент1 страницаLos Supercampeonesgonzales994Оценок пока нет
- BiologiaДокумент1 страницаBiologiagonzales994Оценок пока нет
- La BiologiaДокумент1 страницаLa Biologiagonzales994Оценок пока нет
- Mapa ConceptualДокумент1 страницаMapa ConceptualJefferson AmaguaОценок пока нет
- Química Paes 2023Документ43 страницыQuímica Paes 2023ROSA MUÑOZ100% (3)
- Gu Ia 3: Simetr Ia MolecularДокумент3 страницыGu Ia 3: Simetr Ia MolecularMaría Ignacia SalasОценок пока нет
- Química 1 López - GutiérrezДокумент16 страницQuímica 1 López - GutiérrezAna VázquezОценок пока нет
- Talle Guia 4 y 5 David Flórez PDFДокумент3 страницыTalle Guia 4 y 5 David Flórez PDFDavid FlorezОценок пока нет
- TELERRADIOGRAFÍA - Said AlavaДокумент1 страницаTELERRADIOGRAFÍA - Said AlavabelzevadОценок пока нет
- Energia RelativaДокумент13 страницEnergia Relativacarlos rios rengifoОценок пока нет
- Gran Colisionador de HadronesДокумент18 страницGran Colisionador de HadronesAshura mmtzОценок пока нет
- Estructura AtomicaДокумент4 страницыEstructura AtomicaKaren ArevaloОценок пока нет
- Cuestionario de Práctica 1Документ2 страницыCuestionario de Práctica 1Alonso Mamani GodoyОценок пока нет
- Trivalentes: ActinioДокумент15 страницTrivalentes: ActinioChelo LópezОценок пока нет
- Actividad 1Документ1 страницаActividad 1Ivan AsumasaОценок пока нет
- Campos y Fuerzas MagneticasДокумент15 страницCampos y Fuerzas MagneticasJORGE ABRAHAM ORTEGA CHIMALОценок пока нет
- TP 1 QuimicaДокумент13 страницTP 1 Quimicalunariaferreyra2004Оценок пока нет
- Historia de La QuímicaДокумент10 страницHistoria de La QuímicaFrancisco Pichal CerdaОценок пока нет
- Guía QuímicaДокумент13 страницGuía QuímicaJesa DuranОценок пока нет
- Informe 10 Nuevo-1Документ12 страницInforme 10 Nuevo-1Villarroel Meneses ErwinОценок пока нет
- Ejercicios Unidad 3Документ2 страницыEjercicios Unidad 3Victor BarrónОценок пока нет
- 1era Actividad de Quimica de 5to Año. Iii Momento - Modelos Atomicos Y Tabla PeriodicaДокумент2 страницы1era Actividad de Quimica de 5to Año. Iii Momento - Modelos Atomicos Y Tabla PeriodicaCristian RojasОценок пока нет
- Taller 1Документ5 страницTaller 1roberОценок пока нет
- RX y Fluroscopia WordДокумент8 страницRX y Fluroscopia WordYessenia ParedesОценок пока нет
- Actividad 3 QuimicaДокумент8 страницActividad 3 QuimicaLaura RamírezОценок пока нет
- 11 Ayudant A Martes 13 14 FIS140Документ2 страницы11 Ayudant A Martes 13 14 FIS140Nahum MadridОценок пока нет
- Capítulo 05 Química Nuclear 1Документ1 страницаCapítulo 05 Química Nuclear 1Teofilo Donaires FloresОценок пока нет
- ListoДокумент30 страницListoEdward TorresОценок пока нет
- 5.1 Definiciones - SAVGДокумент3 страницы5.1 Definiciones - SAVGSEBASTIAN ALDAIR VEGA GARCIAОценок пока нет
- Marcha HumanaДокумент11 страницMarcha HumanaAlejandra Vazquez SalinasОценок пока нет
- S9 (05-09 Jul) Bio 1 Bioelementos (37 - 43)Документ7 страницS9 (05-09 Jul) Bio 1 Bioelementos (37 - 43)Kevin QuishpeОценок пока нет
- Tarea2 Química Uane BachilleratoДокумент9 страницTarea2 Química Uane BachilleratoabyОценок пока нет
- Guia de Aprendizaje Prefisica 1er Periodo Grado 9° 2021Документ8 страницGuia de Aprendizaje Prefisica 1er Periodo Grado 9° 2021davaesОценок пока нет