Академический Документы
Профессиональный Документы
Культура Документы
Tarea 1. Fuerzas Intermoleculares
Загружено:
Alberto RoblesАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Tarea 1. Fuerzas Intermoleculares
Загружено:
Alberto RoblesАвторское право:
Доступные форматы
Qumica Inorgnica
TAREA N1. Fuerzas intermoleculares en lquidos y slidos
02 de abril de 2017
Grupo 2
Pregunta 1
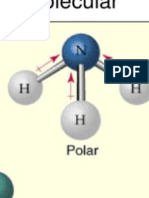
En el diclorometano, CH2Cl2 ( = 1,60 D), la contribucin de la fuerza de
dispersin a las fuerzas de atraccin intermoleculares es aproximadamente cinco
veces ms grande que la contribucin dipolo dipolo. Se espera que la
importancia relativa vare (a) en el dibromometano ( = 1,43 D)? (b) en el
fluorometano ( = 1,93 D)? Explique.
Las fuerzas de dispersin aumentan conforme se aumente la cantidad de electrones.
Tambin el momento dipolar aumenta conforme se aumente su electronegatividad. Por
lo tanto, en el flor para la molcula de fluormetano, al ser ms electronegativo, la
contribucin dipolar va a aumentar, mientras que las fuerzas de dispersin van a
disminuir por tener menos electrones. En otras palabras, dicha importancia relativa
disminuye en comparacin a la molcula de diclorometano.
En cambio, en el bromo para la molcula de dibromometano, lo que se va a tener es
menor contribucin dipolar y adems por tener ms electrones se aumentar la
contribucin de las fuerzas de dispersin de London. Como consecuencia, la
importancia relativa va a aumentar en comparacin a la molcula de diclorometano.
Pregunta 2
Qu miembro de los pares siguientes tienen las fuerzas de dispersin ms
intensas?
a) Bromo molecular u oxgeno molecular
El bromo molecular debido a que tiene mayor cantidad de electrones.
b) 1-butanotiol o 1-pentanotiol
1 pentanotiol tiene mayoy intensidad de fuerza de dispersin debido a que
tiene mayor peso molecular.
c) 1-cloro-propano o cloruro de isopropilo
1 cloro propano tiene mayor intensidad de fuerza de dispersin debido a que su
forma de la molcula es ms alargada de que la del cloruro de isopropilo.
Docente: Yanet Villasana Estudiante: Alberto Robles
Qumica Inorgnica
Pregunta 3
El alcohol proplico y el alcohol isoproplico, tienen puntos de ebullicin de 97.2 y
82.5 C, respectivamente. Explique por qu la diferencia entre ambos, aunque
tienen la misma frmula molecular.
Alcohol proplico
Cl Alcohol isoproplico
Como se observa en la estructura molecular de cada molcula, el acohol proplico tiene
mayor punto de ebullicin y como consecuencia mayor fuerza intermolecular debido a
que tiene mayor disponibilidad de contacto. La razn es que es ms alargada que la del
alcohol isoproplico, pues, sta ltima es ms ovalada.
Pregunta 4
La hidracina, el perxido de hidrgeno y el agua tienen tensiones superficiales
excepcionalmente altas comparadas con otras sustancias de pesos moleculares
similares.
a) Represente las estructuras de Lewis de estos compuestos
b) Qu propiedad estructural tienen en comn estas sustancias?
Tanto la hidracina, el perxido de hidrgeno y el agua poseen enlaces covalentes
con el hidrgeno, especficamente H O y H N. Lo que pasa a formar puentes
de hidrgeno.
c) Cmo explicara sus tensiones superficiales elevadas?
Las tensiones superficiales son elevadas debido a que entre sus molculas existe
el tipo de fuerzas intermoleculares ms fuerte, puente de hidrgeno. Por lo tanto,
como existe una relacin directamente proporcional entre tensin superficial y
fuerza intermolecular, la fuerza emanada en la superficie de los lquidos es alta.
Pregunta 5
Los compuestos como CCl2F2 se conocen como clorofluorocarbonos, CFC. Estos
compuestos solan usarse ampliamente como refrigerantes, pero ahora estn siendo
sustituidos por compuestos que supuestamente son menos dainos para el entorno.
El calor de vaporizacin de CCl2F2 es de 289 J/g. Qu masa de esta sustancia debe
evaporarse para congelar 100 g de agua que inicialmente est a 18C? (El calor de
fusin del agua es de 334 J/g; el calor especfico del agua es de 4.18 J/g-K.)
Docente: Yanet Villasana Estudiante: Alberto Robles
Qumica Inorgnica
J
x
Q = cmT = 4.18 gK 100 g x 18 K = 7524 J
J
x 100 g=
334 g 33400 J
33400 J + 7524 J = 40924 J
g
x
Masa de CCl2F2 = 40924 J 289 J = 141.6 g
Pregunta 6
El etilenglicol [CH2(OH)CH2(OH)] es el principal componente del fluido
anticongelante. Es un lquido un tanto viscoso, no muy voltil a temperatura
ambiente, con un punto de ebullicin de 198C. El pentano (C 5H12), que tiene casi
el mismo peso molecular, es un lquido no viscoso muy voltil a temperatura
ambiente con un punto de ebullicin de 36.1C. Explique las diferencias en las
propiedades fsicas de las dos sustancias.
El etilenglicol, pese a tener casi el mismo peso molecular con el pentano, tiene mayor
punto de ebullicin debido a que posee enlaces con puentes de hidrgeno, H O. Las
fuerzas intermoleculares son ms fuertes en el primer compuesto, antes mencionado,
puesto que el hidrgeno al no tener suficientes electrones internos, el ncleo con carga
positiva va a atraerse con mayor fuerza con un tomo electronegativo, en este caso, el
oxgeno. Cosa que no sucede con el pentano ya que solo existen molculas de carbono e
hidrgeno y que como consecuencia se tiene fuerza intermolecular de dispersin.
Docente: Yanet Villasana Estudiante: Alberto Robles
Вам также может понравиться
- Ingeniería química. Soluciones a los problemas del tomo IОт EverandIngeniería química. Soluciones a los problemas del tomo IОценок пока нет
- Explosivos en La MineriaДокумент4 страницыExplosivos en La MineriaCesar Diaz MalaverОценок пока нет
- Fuerzas IntermolecularesДокумент38 страницFuerzas IntermolecularesTomas YarangaОценок пока нет
- DIENOSДокумент7 страницDIENOSMishell Karolina Machado ValleОценок пока нет
- Instalación eléctrica: cálculo de secciones de cablesДокумент42 страницыInstalación eléctrica: cálculo de secciones de cablesGianFranco Villegas Flores100% (4)
- Evaluacion de La Luz y El SonidoДокумент3 страницыEvaluacion de La Luz y El Sonidopaula100% (1)
- Fuerzas IntermolecularesДокумент38 страницFuerzas Intermolecularesmichael15201150% (2)
- 01.02.reflexion Snell.03.Fresnel PolarizacionДокумент100 страниц01.02.reflexion Snell.03.Fresnel PolarizacionSofi TaylorОценок пока нет
- Mecanica de SolidosДокумент14 страницMecanica de Solidosanderson ayala castañedaОценок пока нет
- Taller 1 BioquimicaДокумент4 страницыTaller 1 BioquimicaSergio Rozo PerdomoОценок пока нет
- Fuerzas intermoleculares y sus efectos en las propiedades de sustancias orgánicasДокумент39 страницFuerzas intermoleculares y sus efectos en las propiedades de sustancias orgánicasJHONJAYRO MARCOS SAAVEDRA VENTURAОценок пока нет
- Guía Fuerzas IntermolecularesДокумент12 страницGuía Fuerzas IntermolecularesPaulina Constenla SaideОценок пока нет
- Solucionario Libro QM Electivo Cpech (OliverClases)Документ8 страницSolucionario Libro QM Electivo Cpech (OliverClases)Oliver Henriquez Aracena100% (1)
- Guía Fuerzas Intermoleculares PDFДокумент12 страницGuía Fuerzas Intermoleculares PDFpalomaОценок пока нет
- Facultad de Ingeniería Química y Textil: Ciclo Académico 2022-1Документ26 страницFacultad de Ingeniería Química y Textil: Ciclo Académico 2022-1Alfaro Barrientos Diego MaximilianoОценок пока нет
- Tema 3Документ40 страницTema 3Rodeo CrabОценок пока нет
- Ejercicios Grupo 1 PDFДокумент4 страницыEjercicios Grupo 1 PDFAntonio CalderónОценок пока нет
- Cuestionario de BiomóleculasДокумент7 страницCuestionario de BiomóleculasArmando CastilloОценок пока нет
- 07 - Fuerzas IntermolecularesДокумент17 страниц07 - Fuerzas IntermolecularesAriana Ansherly Salazar AriasОценок пока нет
- Ejercicio 2Документ5 страницEjercicio 2William LozanoОценок пока нет
- Enlaces IntermolecularesДокумент18 страницEnlaces IntermolecularesLoren Paredes Garay100% (1)
- Unidad 4 - FUERZAS IntermolecularesДокумент25 страницUnidad 4 - FUERZAS IntermolecularesAnderson GuarnizoОценок пока нет
- Tarea 1 Parcial 1Документ3 страницыTarea 1 Parcial 1Mauricio CruzОценок пока нет
- 01 Fuerzas Intermoleculares PDFДокумент14 страниц01 Fuerzas Intermoleculares PDFEmilio DamiánОценок пока нет
- Química 11-3.1reacciones de AlcanosДокумент3 страницыQuímica 11-3.1reacciones de AlcanosKaren PiscoОценок пока нет
- Preguntero de Quimica 2Документ12 страницPreguntero de Quimica 2Paloma numesОценок пока нет
- Ejercicios Fuerzas Intermoleculares AlumnosДокумент9 страницEjercicios Fuerzas Intermoleculares AlumnosAuxiliares QuimicaОценок пока нет
- PAUTA AG7 v2Документ2 страницыPAUTA AG7 v2ElisaОценок пока нет
- Taller Líquidos-3Julio-20Документ5 страницTaller Líquidos-3Julio-20Maryoris MelgarОценок пока нет
- Polímeros orgánicos y sus propiedadesДокумент25 страницPolímeros orgánicos y sus propiedadesKarla Shantal González CamposОценок пока нет
- Semana 07 - Tarea Académica 3 - Fuerzas Intermoleculares.Документ5 страницSemana 07 - Tarea Académica 3 - Fuerzas Intermoleculares.LauraОценок пока нет
- Tarea Académica 3 - Fuerzas IntermolecularesДокумент5 страницTarea Académica 3 - Fuerzas IntermolecularesKevin Acuña Cenzano71% (7)
- 1er Ensayo Nacional Filadd - Ciencias - Mención Química (v1)Документ46 страниц1er Ensayo Nacional Filadd - Ciencias - Mención Química (v1)Krishna Amara VilchesОценок пока нет
- SEMINARIO 2 - SolucionarioДокумент9 страницSEMINARIO 2 - SolucionarioRosmery Gonzales100% (1)
- Chalco Marion Ejercicios de Quimica #5Документ2 страницыChalco Marion Ejercicios de Quimica #5Marion ChalcoОценок пока нет
- Ep 2021-1Документ6 страницEp 2021-1Italo Garay TejadaОценок пока нет
- Enlace Quimico IIIДокумент36 страницEnlace Quimico IIIFranchesca SotomayorОценок пока нет
- Simulacro Parcial Corte 1Документ5 страницSimulacro Parcial Corte 1Esteban Polo AgredoОценок пока нет
- QuimicaorganicagdfgdsgДокумент467 страницQuimicaorganicagdfgdsgOmar Sanchez PerezОценок пока нет
- Cap 8 Forces Intermol-Def-3662Документ7 страницCap 8 Forces Intermol-Def-3662Alexandra Melissa Reto SabaОценок пока нет
- Fuerzas IntermolecularesДокумент28 страницFuerzas IntermolecularesLINA SOFIA RIVAS COLLAZOSОценок пока нет
- Reacciones y SecuenciasДокумент9 страницReacciones y SecuenciasKristhy LargoОценок пока нет
- Deber Individual 8 - Ejercicios Del Grupo 17Документ2 страницыDeber Individual 8 - Ejercicios Del Grupo 17Greys ChuquimarcaОценок пока нет
- AlcanosДокумент7 страницAlcanosKeiner TorresОценок пока нет
- 6 A1 Ticos PropiedadesДокумент12 страниц6 A1 Ticos Propiedadesjzedano95Оценок пока нет
- REACORGÁNICAДокумент25 страницREACORGÁNICAnoeliacea23Оценок пока нет
- 01.2 Estructura y Enlace Parte 2Документ12 страниц01.2 Estructura y Enlace Parte 2Luis Angel Caceres SoteloОценок пока нет
- Fuerzas IntermolecularesДокумент31 страницаFuerzas IntermolecularesCecilia Meinero20% (5)
- CuestionarioquimicaДокумент4 страницыCuestionarioquimicaDIEGO FERNANDO CUERVO FAJARDOОценок пока нет
- Química OrgánicaДокумент24 страницыQuímica OrgánicaElkin José Simanca ArrietaОценок пока нет
- Experimento batería NaHCO3-Cu-ZnДокумент3 страницыExperimento batería NaHCO3-Cu-Znmaria alrjandra arroyoОценок пока нет
- Cuestionario de Estudio Fuerzas IntermolecularesДокумент3 страницыCuestionario de Estudio Fuerzas Intermolecularesabm_2009903350% (6)
- Cálculo del pH de una mezcla de HCl y NaOHДокумент15 страницCálculo del pH de una mezcla de HCl y NaOHMvc JohnsОценок пока нет
- Final de Quimica Modelo 1Документ4 страницыFinal de Quimica Modelo 1daniel gonzalezОценок пока нет
- AlquenosДокумент5 страницAlquenosLeonardo TonazzolliОценок пока нет
- Diels Alder Practica 3Документ9 страницDiels Alder Practica 3Javier BarraganОценок пока нет
- Fuerzas intermoleculares y cambios de estadoДокумент11 страницFuerzas intermoleculares y cambios de estadolisseth calleОценок пока нет
- Fuerzas intermoleculares y cambios de estadoДокумент10 страницFuerzas intermoleculares y cambios de estadolisseth calleОценок пока нет
- Alquenos, Alquinos FinalДокумент9 страницAlquenos, Alquinos FinalEvelin Ontiveros Beltran100% (1)
- Enlaces CovalentesДокумент28 страницEnlaces Covalentesjose serranoОценок пока нет
- Presentación Unidad 4 - Fuerzas IntermolecularesДокумент21 страницаPresentación Unidad 4 - Fuerzas IntermolecularesLucas SabchezОценок пока нет
- 2.2 HT Propiedades Físicas CHO C OДокумент3 страницы2.2 HT Propiedades Físicas CHO C OisabelОценок пока нет
- Taller de Quimica CaliДокумент11 страницTaller de Quimica CaliYeferson cuesta palaciosОценок пока нет
- Actividad de Aprendizaj1 Y 2Документ6 страницActividad de Aprendizaj1 Y 2StalynОценок пока нет
- Conocimiento Ancestral de La Chicha ¿Lo Conoces?Документ15 страницConocimiento Ancestral de La Chicha ¿Lo Conoces?Alberto RoblesОценок пока нет
- Fisica Informe Ley LaplaceДокумент4 страницыFisica Informe Ley LaplaceAlberto RoblesОценок пока нет
- Aplicaciones Del Efecto TúnelДокумент3 страницыAplicaciones Del Efecto TúnelAlberto RoblesОценок пока нет
- Practica 5Документ9 страницPractica 5Alberto Robles0% (1)
- Solicitud de matrícula y cambio de horarioДокумент3 страницыSolicitud de matrícula y cambio de horarioAlberto RoblesОценок пока нет
- Geología RocasДокумент12 страницGeología RocasAlberto RoblesОценок пока нет
- Aplicaciones Del Efecto TúnelДокумент3 страницыAplicaciones Del Efecto TúnelAlberto RoblesОценок пока нет
- Análisis de VarianzaДокумент9 страницAnálisis de VarianzaAlberto RoblesОценок пока нет
- Hora RiosДокумент8 страницHora RiosAlberto RoblesОценок пока нет
- HorariosДокумент10 страницHorariosAlberto RoblesОценок пока нет
- Biologia EnsayoДокумент1 страницаBiologia EnsayoAlberto RoblesОценок пока нет
- Comparación de Bacterias en Distintos Medios para La Producción de La ChichaДокумент2 страницыComparación de Bacterias en Distintos Medios para La Producción de La ChichaAlberto RoblesОценок пока нет
- Por Si Me Quieres LeerДокумент1 страницаPor Si Me Quieres LeerAlberto RoblesОценок пока нет
- Vectores y MatricesДокумент3 страницыVectores y MatricesAlberto RoblesОценок пока нет
- 04 HwovДокумент4 страницы04 HwovAlberto RoblesОценок пока нет
- Informe 1Документ8 страницInforme 1Alberto RoblesОценок пока нет
- Paper Transformes: Español - EnglishДокумент12 страницPaper Transformes: Español - EnglishAlberto RoblesОценок пока нет
- Informe 2Документ12 страницInforme 2Alberto RoblesОценок пока нет
- Comportamiento de suelos - Propiedades hidráulicas y flujo establecido de agua en sueloДокумент20 страницComportamiento de suelos - Propiedades hidráulicas y flujo establecido de agua en sueloMoncho McfzОценок пока нет
- 0004940e (1523942) PDFДокумент16 страниц0004940e (1523942) PDFRamon Mario De DonatisОценок пока нет
- 1 Mezcla-MulticomponenteДокумент20 страниц1 Mezcla-MulticomponenteKevin LealОценок пока нет
- Sistema GeneradorДокумент4 страницыSistema GeneradorAdriana OssesОценок пока нет
- T P Ndeg 2 Sistema de Fuerzas - Cont - Ind 2012Документ5 страницT P Ndeg 2 Sistema de Fuerzas - Cont - Ind 2012Lidia Yurena Yanes ValidoОценок пока нет
- Conceptos Básicos de ElectrónicaДокумент4 страницыConceptos Básicos de ElectrónicaGuillermina ScarОценок пока нет
- Tarea Examen Bloque 3Документ6 страницTarea Examen Bloque 3qfbjaimerrojasОценок пока нет
- Tablas DiseñoДокумент6 страницTablas DiseñodavidОценок пока нет
- Matriz de Evaluación EAДокумент1 страницаMatriz de Evaluación EAHarold Aroum HChirinosОценок пока нет
- Movimiento circular uniformeДокумент7 страницMovimiento circular uniformekustОценок пока нет
- MMДокумент12 страницMMTatiana Sanchez0% (1)
- 11 327Документ3 страницы11 327Ronald Martinez100% (1)
- Química Moderna t1Документ39 страницQuímica Moderna t1Carmen ReasonОценок пока нет
- WebFT07 TurbulentoДокумент15 страницWebFT07 TurbulentoJosueGuayuscaSoriaGalvarroОценок пока нет
- E944 (15090-15066) Balance Termico de Un Equipo de Aire AcondicionadoДокумент7 страницE944 (15090-15066) Balance Termico de Un Equipo de Aire AcondicionadoRoberto Abujatum RubioОценок пока нет
- Los Condensadores Codigo de ColoresДокумент6 страницLos Condensadores Codigo de Coloresd-k4Оценок пока нет
- Definición de MatrizДокумент9 страницDefinición de MatrizVictor Javier InfanteОценок пока нет
- Cuchilla Tipo V Manual de 72.5-145kVДокумент7 страницCuchilla Tipo V Manual de 72.5-145kVLOM1994Оценок пока нет
- Fundamentos ReologiaДокумент65 страницFundamentos ReologiaWilliam RoaОценок пока нет
- Unidad 3,4 Y 5Документ28 страницUnidad 3,4 Y 5Luis PeceroОценок пока нет
- Estructura Externa Del ÁtomoДокумент47 страницEstructura Externa Del ÁtomoFederico CalcopietroОценок пока нет
- Cantidades Físicas PDFДокумент18 страницCantidades Físicas PDFjames9jos99ju9rez9muОценок пока нет
- Reporte Diseño de Sist MecanicosДокумент11 страницReporte Diseño de Sist MecanicosDaniel RosalesОценок пока нет
- Principio de ArquimedesДокумент5 страницPrincipio de Arquimedesnashita1Оценок пока нет
- Proyecto de investigación sobre velocidad del sonido y sus propiedadesДокумент9 страницProyecto de investigación sobre velocidad del sonido y sus propiedadesnataliaОценок пока нет