Академический Документы
Профессиональный Документы
Культура Документы
Tipos de Reacciones Químicas
Загружено:
gabriel0 оценок0% нашли этот документ полезным (0 голосов)
15 просмотров5 страницquimica
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документquimica
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
15 просмотров5 страницTipos de Reacciones Químicas
Загружено:
gabrielquimica
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 5
Tipos de Reacciones Qumicas
29 de Marzo de 2010 Publicado por Mnica Gonzlez
Sntesis o Adicin, Descomposicin o Anlisis, Doble
sustitucin o Doble Desplazamiento
Las reacciones qumicas son procesos que transforman
una o ms substancias llamadas reactivos en otras
substancias llamadas productos.
En un lenguaje ms acadmico, decimos que una reaccin
qumica promueve el cambio de estructura de la materia.
En la qumica inorgnica podemos clasificar las reacciones
en cuatro tipos diferentes
1- Reacciones de Sntesis o Adicin
Las reacciones de sntesis o adicin son aquellas donde las
substancias se juntan formando una nica sustancia.
Representando genricamente los reactivos como A y B,
una reaccin de sntesis puede ser escrita como:
A + B > AB
Veamos algunos ejemplos
Fe + S > FeS
2H2 + O2 > 2H2O
H2O + CO2 > H2CO3
Perciba en los ejemplos que los reactivos no precisan ser
necesariamente substancias simples (Fe, S, H2, O2),
pudiendo tambin se substancias compuestas (CO2, H2O)
pero en todas el producto es una sustancia menos simple
que las que originaron.
2- Reacciones de Anlisis o Descomposicin
Las reacciones de anlisis o descomposicin son lo
opuesto de las reacciones de sntesis, o sea, un reactivo da
origen a productos ms simples que el. Escribiendo la
reaccin genrica nos resulta fcil entender lo que sucede:
AB > A + B
No parece simple? Lo es bastante. Veamos algunos
ejemplos:
2H2O 2 H2 + O2
2H2O2 2H2O + O2
Reversibilidad de las reacciones qumicas
Los ejemplos pueden sugerir que cualquier reaccin de
sntesis puede ser invertida a travs de una reaccin de
anlisis. Esto no es verdad. Algunas reacciones pueden ser
reversibles, como podemos notar en la reaccin del agua:
2H2 + O2 2H2O
2H2O 2H2 + O2
Sin embargo esto no es una regla
3- Reacciones de Desplazamiento
Las reacciones de desplazamiento o de sustitucin simple
merecen un poco ms de atencin que las anteriores. No
que sean complejas, pues no lo son, pero tienen algunos
pequeos detalles. En su forma genrica la reaccin puede
ser escrita como:
AB + C > A + CB
Vamos a entender lo que sucede: C cambio de lugar A.
Simple asi, pero ser que esto ocurre siempre?
Intuitivamente la respuesta es que no. Imagina lo siguiente:
Entras en un baile y ves a la persona con la que te gustara
bailar bailando con otra persona. Vas a ir hasta ella e
intentar hacerla cambiar de pareja, estars intentando
desplazar el acompaante indeseable y asumir su lugar. Si
resulta que eres ms fuerte que el indeseable basta darle
un empujn para asumir su lugar, pero si el fuera un bruto
troglodita, posiblemente el no sentir ni el empujn que le
des.
En la reaccin de desplazamiento el proceso es idntico: C
ve a B ligado a A, se aroxima y siendo ms fuerte, desplaza
A y asume la ligacin con B. En caso que C no sea ms
fuerte que A, nada suceder.
Bastar entonces saber quien es ms fuerte que quien.
Au<Ag<Cu<H<Pb<Sn<Ni<Fe<Cr<Zn<Al<Mg<Na<Ca<K<
Li
Metales nobles < hidrogeno < metales
De esta forma, tenemos:
2Na + 2H2O > 2NaOH + H2 (el sodio desplaza al
hidrgeno del agua H-OH)
Au + HCl > no reacciona (el oro no consigue desplazar
al hidrgeno)
4- Reacciones de Doble Sustitucin
Son tambin muy simples, pero debemos quedar atentos a
los detalles. El mecanismo es fcil:
AB + CD > AD + CB
Ciertamente ya habr podido ver lo que sucede. A cambi
de lugar con C. La diferencia de este tipo de reaccin con
el desplazamiento, es que ni A ni C estaban solos y en
ambos casos ninguno de ellos qued solo luego de la
sustitucin.
Para entender como es cuando una reaccin de este tipo
ocurre, tendremos que observar lo siguiente:
La substancia AB esta en solucin y de esta forma lo que
tenemos en verdad son los iones A+ y B- separados unos
de los otros. La substancia CD tambin est en solucin,
por tanto tenemos tambin los iones C+ y D- separados.
Cuando juntamos las dos soluciones estamos promoviendo
una gran mezcla entre los iones A+, B-, C+ y D-, formando
una gran sopa de iones.
Si al combinar C+ con B-, el compuesto CB fuera soluble,
los iones sern nuevamente separados en C+ y B-,
resultando exactamente en la misma cosa que tenamos
anteriormente. Lo mismo sucede con A+ y B-
As, al mezclar AB con CD, estamos en verdad haciendo:
(A+ ) + (B- ) + (C+ ) + (D- )
Tomemos en cuenta que juntar iones que se separarn
nuevamente resultar en la misma sopa de iones y no
resulta en ninguna nueva susbtancia, por tanto no ocurre
ninguna reaccin.
Para que la reaccin efectivamente ocurra, ser necesario
que al menos uno de los probables productos (AD o CB) no
sean separados al juntarse, o sea, deben formar un
compuesto insoluble y esto es logrado a travs de una sal
insoluble, de un gas o de agua.
Si uno de los productos fuera una sal insoluble el no ser
separado en iones y permanecer slido. Si fuese un gas,
el se desprender de la solucin (burbujas) y tambin
permanecer con sus molculas agrupadas. Mientras que
si uno de los productos fuese agua, ella no se desagrega
en su propia presencia.
NaCl + AgNO3 > NaNO3 + AgCl
En esta reaccin el producto AgCl (cloruro de prata) es
insoluble, por tanto la reaccin ocurre.
NaCl + LiNO3 > NaNO3 + LiCl
Como ninguno de los productos formados, NaNO3 (nitrato
de sodio) o Lic. (Cloruro de Litio) es insoluble, la reaccin
no sucede.
NaOH + HCl > NaCl + H2O
Como uno de los productos es gua (H2O), la reaccin
ocurre.
Para la previsin de ocurrencia o no de una reaccin de
doble desplazamiento es fundamental que conozcamos la
solubilidad de las salen en agua, y para recordar esto lea
acerca de solubilidad en el agua.
Vio como es sencillo? Con un poco de prctica y
ejercicios usted podr lograr escribir reacciones que
pueden dar origen a un determinado producto: Quiere
ver?
Imagnese que usted desea obtener sulfato de plomo
(PbSO4), usted sabe que tendr que juntar el ion del plomo
(Pb 2+) y el ion de sulfato (SO42 -). Como sabemos que el
sulfato de plomo es insoluble, podemos promover un doble
desplazamiento
PbX + YSO4 > PbSO4 + XY
Es solo elegir X e Y de forma que las dos substancias sean
solubles.
Otra forma de realizar el desplazamiento de hidrgeno, del
hidrgeno por el plomo ya que este es ms reactivo.
Pb + H2SO4 > H2 + PbSO4
Lee todo en: Tipos de Reacciones Qumicas | La Gua de
Qumica http://quimica.laguia2000.com/conceptos-
basicos/tipos-de-reacciones-quimicas#ixzz4iT9cPZfp
http://blocs.xtec.cat/debianita/files/2014/03/REACCIONES-
QU%C3%8DMICAS-rev_2013-copia.pdf
Вам также может понравиться
- Vías parenterales: Introducción, tipos y técnicasДокумент11 страницVías parenterales: Introducción, tipos y técnicasSergio Luquillas CuevaОценок пока нет
- Antiparkisoanianos Ppts 1Документ20 страницAntiparkisoanianos Ppts 1gabrielОценок пока нет
- FenitoinaДокумент5 страницFenitoinagabrielОценок пока нет
- Antidepresivos .Grupo3Документ71 страницаAntidepresivos .Grupo3gabrielОценок пока нет
- Bio Gen Teoria 6 2017 Sist Endomembranas-1Документ23 страницыBio Gen Teoria 6 2017 Sist Endomembranas-1gabrielОценок пока нет
- Bio Gen Teoria 6 2017 Sist Endomembranas-1Документ23 страницыBio Gen Teoria 6 2017 Sist Endomembranas-1gabrielОценок пока нет
- Bio Gen Teoria 5 2015 Celula y MembranaДокумент30 страницBio Gen Teoria 5 2015 Celula y MembranagabrielОценок пока нет
- Bioquimica I Practica04Документ2 страницыBioquimica I Practica04gabrielОценок пока нет
- Cito esqueleto: componentes y funcionesДокумент16 страницCito esqueleto: componentes y funcionesgabrielОценок пока нет
- Guia de Enfermedades Raras 2010.Документ109 страницGuia de Enfermedades Raras 2010.José Isaac Lamas GarcíaОценок пока нет
- Bio Gen Teoria 5 2015 Celula y MembranaДокумент30 страницBio Gen Teoria 5 2015 Celula y MembranagabrielОценок пока нет
- Teoría 4 Numero CuanticoДокумент24 страницыTeoría 4 Numero CuanticogabrielОценок пока нет
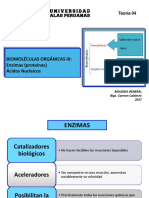
- Bio Gen Teoria 4 2017 Enzimas y Ac. Nucleicos PDFДокумент30 страницBio Gen Teoria 4 2017 Enzimas y Ac. Nucleicos PDFgabrielОценок пока нет
- TRATAMIENTO QUEMADURAS 15 Dic 2013Документ43 страницыTRATAMIENTO QUEMADURAS 15 Dic 2013Javier ShermanОценок пока нет
- Dialecto IdiolectoДокумент16 страницDialecto IdiolectogabrielОценок пока нет
- Bio Gen Teoria 10 2017 Replicacion - SintesisДокумент28 страницBio Gen Teoria 10 2017 Replicacion - SintesisgabrielОценок пока нет
- Taller de Integracion ...Документ8 страницTaller de Integracion ...gabrielОценок пока нет
- Guia 7 CarbohidratosДокумент7 страницGuia 7 CarbohidratosJose OspinaОценок пока нет
- La ComunicaciónДокумент14 страницLa ComunicacióngabrielОценок пока нет
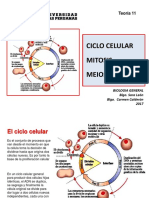
- Bio Gen Teoria 11 2017 Ciclo CelularДокумент24 страницыBio Gen Teoria 11 2017 Ciclo CelulargabrielОценок пока нет
- Bio Gen Teoria 8 2017 Mitocondrias y CloroplastosДокумент25 страницBio Gen Teoria 8 2017 Mitocondrias y CloroplastosgabrielОценок пока нет
- La ComunicaciónДокумент14 страницLa ComunicacióngabrielОценок пока нет
- Bio Gen Teoria 4 2017 Enzimas y Ac. Nucleicos PDFДокумент30 страницBio Gen Teoria 4 2017 Enzimas y Ac. Nucleicos PDFgabrielОценок пока нет
- Dialecto IdiolectoДокумент16 страницDialecto IdiolectogabrielОценок пока нет
- Teoria 5 Tabla PeriodicaДокумент26 страницTeoria 5 Tabla PeriodicagabrielОценок пока нет
- Bio Gen Teoria 11 2017 Ciclo CelularДокумент24 страницыBio Gen Teoria 11 2017 Ciclo CelulargabrielОценок пока нет
- La ComunicaciónДокумент14 страницLa ComunicacióngabrielОценок пока нет
- Teoria 5 Tabla PeriodicaДокумент26 страницTeoria 5 Tabla PeriodicagabrielОценок пока нет
- Teoria 8.2 Reacciones y Ecuaciones QuimicasДокумент24 страницыTeoria 8.2 Reacciones y Ecuaciones QuimicasgabrielОценок пока нет
- Bio Gen Teoria 13 2017 Herencia - GeneticaДокумент24 страницыBio Gen Teoria 13 2017 Herencia - GeneticagabrielОценок пока нет
- Laboratorio de SifonДокумент18 страницLaboratorio de SifonelvisОценок пока нет
- Caudal EsДокумент36 страницCaudal EsYetchan QuiveОценок пока нет
- Demostraciones 1Документ4 страницыDemostraciones 1Alejandra CaizaluisaОценок пока нет
- Topologia de Redes 2010Документ7 страницTopologia de Redes 2010LuisОценок пока нет
- Chapas Colaborantes - Arcelormittal PDFДокумент25 страницChapas Colaborantes - Arcelormittal PDFMirian AlvarezОценок пока нет
- Electricidad - Angel RodriguezДокумент10 страницElectricidad - Angel RodriguezAngel RodriguezОценок пока нет
- Deber 2 CV 2017-BДокумент2 страницыDeber 2 CV 2017-BTefani TroyaОценок пока нет
- 14 4Документ19 страниц14 4hugoОценок пока нет
- Trabajo de Investigacion 1. Produccion Mas LimpiaДокумент7 страницTrabajo de Investigacion 1. Produccion Mas LimpiaDarwin De LeonОценок пока нет
- Art Cisterna CircularДокумент5 страницArt Cisterna CircularIVANОценок пока нет
- Numeros RealesДокумент51 страницаNumeros RealesAnyelo Alejandro Garcia CastellanosОценок пока нет
- Formato Procedimiento de ExpandidoДокумент1 страницаFormato Procedimiento de Expandidoa_parratОценок пока нет
- Practica 10 ORGANICAДокумент7 страницPractica 10 ORGANICASarahi GuillenОценок пока нет
- Ejemplo Preguntas Ing CivilДокумент16 страницEjemplo Preguntas Ing CivilF Carla Chambi RojasОценок пока нет
- Clase 06 Vida Util 2017Документ16 страницClase 06 Vida Util 2017kevinОценок пока нет
- Ondas de choque en toberas convergente - divergenteДокумент9 страницOndas de choque en toberas convergente - divergenteJulio AlvaradoОценок пока нет
- 3 VectoresДокумент30 страниц3 VectoresRennyer VillamizarОценок пока нет
- Estudio EconomicoДокумент208 страницEstudio EconomicohenryОценок пока нет
- TRIPTICOДокумент2 страницыTRIPTICOMarianela Calva SalasОценок пока нет
- Tema 1-12Документ20 страницTema 1-12JaimeОценок пока нет
- Extraccion de Disolventes Organicos y ActivosДокумент3 страницыExtraccion de Disolventes Organicos y ActivosCristopher CanoОценок пока нет
- Funciones Especiales Control de Los Movimientos de Subida yДокумент5 страницFunciones Especiales Control de Los Movimientos de Subida yCanek UnoОценок пока нет
- Acondicionamiento TermoparДокумент12 страницAcondicionamiento TermoparManuel Alberto Chavez SalcidoОценок пока нет
- Lectura - Probabilidades m8 - ProesДокумент8 страницLectura - Probabilidades m8 - ProesSalva JhulianaОценок пока нет
- DAP y Propuesta de Un SGA para La Universidad Nacional de Tacna 2003Документ127 страницDAP y Propuesta de Un SGA para La Universidad Nacional de Tacna 2003guille_al82Оценок пока нет
- Propiedades morfométricas de cuencas hidrográficasДокумент19 страницPropiedades morfométricas de cuencas hidrográficascamilo florezОценок пока нет
- 9 Tolerancias de CabeceoДокумент11 страниц9 Tolerancias de Cabeceoarista22Оценок пока нет
- 5700 C GC INF 1007 - Rev1 PDFДокумент14 страниц5700 C GC INF 1007 - Rev1 PDFPercy FloresОценок пока нет
- Informe Laboratorio 3 Determinación de Paracetamol Por Valoración ConductimétricaДокумент16 страницInforme Laboratorio 3 Determinación de Paracetamol Por Valoración ConductimétricaprissОценок пока нет
- ROTAMETROДокумент31 страницаROTAMETROgdgdgdgОценок пока нет