Академический Документы
Профессиональный Документы
Культура Документы
Practica N
Загружено:
Kenyi Ibañez MachadoОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Practica N
Загружено:
Kenyi Ibañez MachadoАвторское право:
Доступные форматы
PRACTICA N2
CONSERVACIN DE LA ENERGA
I. OBJETIVO:
1.1 OBJETIVOS GENERALES:
Verificar la relacin existente entre el trabajo elctrico (mecnico)y el calor.
1.2 OBEJTIVOS ESPECIFICOS:
II. TIEMPO:
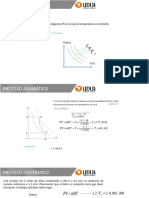
III. FUNDAMENTO TEORICO
El principio de conservacin de la energa nos dice que si una dada cantidad de energa de
algn tipo se transforma completamente en calor la variacin de energa trmica resultante
debe ser equivalente a la cantidad de energa entregada.
En este experimento buscamos demostrar la equivalencia entre la energa entregada a un
sistema y el calor en que se convierte. Si la energa se mide en Joules y el calor en caloras,
nos proponemos tambin encontrar la equivalencia entre estas unidades. A la relacin
cuantitativa entre Joules y caloras la llamaremos equivalente elctrico o mecnico del calor y
la denominaremos Je.
Recordamos que joule es la unidad de energa del sistema internacional de unidades: 1 J = 1
N-m; y una calora es la cantidad de calor que hay que suministrar a un gramo de agua para
elevarle la temperatura 1C (desde 14.5C hasta 15.5C).
Un dispositivo muy til para los experimentos de termodinmica es el calormetro de mezclas
que consiste en un recipiente con una buena aislamiento trmico y que contiene un lquido
(por lo regular agua), un termmetro y otros elementos, como un agitado y un calefactor
(resistencia elctrica).
No debemos olvidad que el calormetro participa como parte integrante en los procesos de
transferencia de calor que se realicen en l y por tal motivo es importante caracterizar su
comportamiento trmico. Aqu damos un mtodo para obtener el parmetro del calormetro
denominado equivalente de en agua del calormetro, Meq.
Si por algn mtodo suministramos una cantidad de calor Q al sistema, la temperatura del
calormetro aumentara una cantidad T . La relacin entre estas cantidades ser:
Q=(C aguamagua + Ctermon .mtermon . +C xxmxx ) T
{C termon.mtermon. + C xxm xx }
Q=C agua(magua + ) T
C agua
Aqu, C agua es el calor especfico del agua, Ctermon . representa el calor especfico
del termmetro y C xx el calor especifico del recipiente, agitado y dems
elementos dentro del calormetro, estos dos ltimos desconocidos en general. Las
masas correspondientes son: magua , mtermon . y mxx . Para un dado calormetro,
el termino entre llaves es una constante con dimensin de masa, y puede agruparse
en una sola constante M eq . , que se designa como el equivalente en agua del
calormetro M eq . tiene un significado fsico simple: representa una masa de agua
cuya capacidad calorfica es igual a la del conjunto constituido por el termmetro,
recipiente, agitador y todos los dems componentes del calormetro.
Existen varios mtodos para determinar el valor de M eq. Un modo simple de
obtenerlo consiste en mezclar dos volmenes de agua a distintas temperaturas: una
masa de agua m1 a T 1 (agua fra, una decena de grados debajo de la
temperatura ambiente, T amb ), que se supone esta en el calormetro junto a los
dems componentes y otra masa de agua m2 a T 2 (agua caliente, una decena
de grados arriba de T amb ). Una vez medidas las temperaturas T 1 y T 2 , los
dos volmenes de agua se mezclan en el calormetro, el cual se equilibrara
trmicamente a una temperatura. Por conservacin de la energa tenemos:
Q=C_agua*(m_1 + M_(eq.))*(T_f-T_1)
Вам также может понравиться
- Respuestas de TermoДокумент6 страницRespuestas de TermoRei Armella100% (1)
- Climatizacion 18 InstClimatizacionAgua 3 2Документ100 страницClimatizacion 18 InstClimatizacionAgua 3 2Julián Passardi DonosoОценок пока нет
- Taller 8. Termoquimica - CalorimetriaДокумент1 страницаTaller 8. Termoquimica - CalorimetriaCuenta Cuenta100% (1)
- EXAMEN FINAL TransferenciaДокумент4 страницыEXAMEN FINAL TransferenciaCristian Najar OcharanОценок пока нет
- Termodinamica S3Документ6 страницTermodinamica S3francia valdesОценок пока нет
- Ciclos TermodinamicosДокумент29 страницCiclos TermodinamicosDavid trejo TrejoОценок пока нет
- Imrpmirr Expo EstadisticaДокумент8 страницImrpmirr Expo EstadisticaKenyi Ibañez MachadoОценок пока нет
- Bautista Culquipoma & Soto ChirinosДокумент151 страницаBautista Culquipoma & Soto ChirinosKenyi Ibañez MachadoОценок пока нет
- Informe de Practicas Joel CribilleroДокумент82 страницыInforme de Practicas Joel CribilleroKenyi Ibañez Machado100% (1)
- Avance Informe CaletaДокумент87 страницAvance Informe CaletaKenyi Ibañez MachadoОценок пока нет
- La Mozama Es Un Baile Típico Del Carnaval LimeñoДокумент1 страницаLa Mozama Es Un Baile Típico Del Carnaval LimeñoKenyi Ibañez MachadoОценок пока нет
- Vitocal IP PDFДокумент148 страницVitocal IP PDFpoliplexorОценок пока нет
- Peltier Thomson SeebeckДокумент5 страницPeltier Thomson SeebeckPaul SinclairОценок пока нет
- Rfa - Tema 4. El Ambiente TérmicoДокумент37 страницRfa - Tema 4. El Ambiente TérmicoAngélica FelipeОценок пока нет
- Operacion Del RefrigeradorДокумент8 страницOperacion Del RefrigeradorAlexanderFerrettyОценок пока нет
- Poster Termo IIДокумент1 страницаPoster Termo IIEsteban FernandezОценок пока нет
- Guia 1, Grado OactavoДокумент11 страницGuia 1, Grado OactavoLEONARDO YEPEZОценок пока нет
- Ciclo Otto DieselДокумент34 страницыCiclo Otto DieselNOELIA MILAGROS CONDO SILVAОценок пока нет
- Motor EricssonДокумент2 страницыMotor EricssonSeba TrigoОценок пока нет
- TermómetrosДокумент37 страницTermómetrossolitario2009Оценок пока нет
- Formulario de QuimicaДокумент3 страницыFormulario de QuimicaAnthony JácomeОценок пока нет
- Primera Ley de La TermodinámicaДокумент2 страницыPrimera Ley de La TermodinámicaIsrael MateoОценок пока нет
- Tarea 4 1 2021Документ1 страницаTarea 4 1 2021matematica fisica quimica boliviaОценок пока нет
- Formulario FSQ I 2021BДокумент4 страницыFormulario FSQ I 2021BAlan PalaciosОценок пока нет
- Tarea 13 OkokДокумент4 страницыTarea 13 OkokAdrian LovonОценок пока нет
- Avance Pratica EvaporadoresДокумент10 страницAvance Pratica EvaporadoresCesar Ivan Hernandez JimenezОценок пока нет
- Tarea MarceloДокумент3 страницыTarea MarceloLuis CautivoОценок пока нет
- Termodinamica - Aplicada - Oct 2020-Marzo 2021Документ16 страницTermodinamica - Aplicada - Oct 2020-Marzo 2021Bryan DarkОценок пока нет
- Cuadro Sinoptico EQДокумент2 страницыCuadro Sinoptico EQMiguel Angel Romero GomezОценок пока нет
- Equilibrio 2006Документ2 страницыEquilibrio 2006lacaya2Оценок пока нет
- Diseño de Equipos, CiclohexanoДокумент39 страницDiseño de Equipos, Ciclohexanosheyla IsabelОценок пока нет
- Repaso Examen 1 - Fisica II 201701Документ5 страницRepaso Examen 1 - Fisica II 201701SofiaOrtizОценок пока нет
- 21 EcuascionesДокумент4 страницы21 EcuascionesCarlos Herrera Delgado0% (1)
- Practica #6 Coraza y TubosДокумент15 страницPractica #6 Coraza y Tubossantiago quispe mamaniОценок пока нет
- Aze R33Документ3 страницыAze R33Gonzalo vargasОценок пока нет