Академический Документы
Профессиональный Документы
Культура Документы
Blanco - Quimica Biológica (8va) - Cap 23 - Balance Hidromineral
Загружено:
Abel Neto100%(1)100% нашли этот документ полезным (1 голос)
282 просмотров36 страницACIDO BASE
Авторское право
© © All Rights Reserved
Доступные форматы
PDF или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документACIDO BASE
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF или читайте онлайн в Scribd
100%(1)100% нашли этот документ полезным (1 голос)
282 просмотров36 страницBlanco - Quimica Biológica (8va) - Cap 23 - Balance Hidromineral
Загружено:
Abel NetoACIDO BASE
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF или читайте онлайн в Scribd
Вы находитесь на странице: 1из 36
CAPITULO 23
Balance hidromineral
El estudio del balance del agua y de los
electrolitos constituye un capitulo de especial
importancia en todas las ramas de la medicina
El agua es el solvente en el cual transcurren
casi todas las reacciones guimicas de nuestro
organismo. Ademés de los nutrientes provistos
a las células, los compuestos sintetizados por
elias y los productos de desecho metabélico. el
agua de( organismo contiene en solucién sustan-
cias minerales, muchas de las cuales se disocian
en iones, comportandose como electrétites.
E] agua es la sustancia cuantitativamente mas
importante en la mayoria de seres vivos. En hu-
manos tepresenta alrededor del 60% del peso
corporal en el varén adulto; en Ja mujer el agua
constituye el 55% del peso corporal. Esta dite-
fencia se debe principalmente a la mayor pro-
porcidn de tejido adiposo en la mujer. En gene-
ral, la cantidad relativa de agua disminuye con
Ja edad. En nifios prematuros es de hasta 80%,
en recién nacidos normales atcanza a 77% y lue-
go disminuye lentamente hasta 70-65% poco
después dei aio de vida. Esta proporcién se
mantiene hasta la adultez. Desde los 60 afios en
adelante el porcentaje se reduce progresivamente
a valores de 50 y 45%, especialmente debido a
disminucién de la masa muscular.
La proporcién de agua en diferentes tejidos
varia notablemente. Por ejemplo, la piel posee
72% de agua; el misculo, 75%; el hueso, 22%;
el higado, 68%; el rifién, 82%: el intestino, 74%;
el tejido adiposo, 10%
En el individuo normal, el contenido de agua
total se mantiene mas 6 menos estable dentro de
estrechos limites; es una constante con mecanis-
mos de regulacidn propios.
Como el contenido de agua total guarda rela
cidn con la cantidad de tejido adiposo, la pro-
porcién del peso corporal correspondiente al
agua disminuye a medida que aumenta el por-
centaje de grasa. El agua total es relativamente
seducida en obesos.
Determinacién de} agua total. El agua total pue-
de medirse por técnicas de dilucién de solutos que atra-
viesan facilmente las membranas celulares y se distri-
buyen uniformemente ent todo el cuerpo. Se procede a
administrar una cantidad conocida de Ja sustancia y
cuando su conceptracién se ha equilibrado en todos
Jos tejidos se determina su concentracién en plasma
sanguineo. El volumen de agua total (V;), en litros,
se calcula con la f6rmula:
intidad administrada (mg)/Concentracién (mg/L)
Se utilizan pa
tiourea y compuest
otritio).
esta determinacién antipirina,
s con isétopos (6xidos de deuterio
‘Une técnica de uso mas reciente es el anélisis de
impedancia bioelécivica. La medicién de impedancia
elgctrica de Jos tejidos de} cuexpo prove estimacién
1.
del agua total, masa libre de grasa y grasa corpo!
Ademis de determinar la adiposidad, esta siendo util
zada para calcular la masa celular y agua corporal to-
tal en diferentes condiciones clinicas.
Distribucion del agua
La gran masa de agua del organismo esta re-
partida en diferentes “compartimientos”. Se dis
iinguen dos grandes compartimientos: inrrace
lular y extracelular.
499
500 QUIMICA BIOLOGICA
a) Intracelular (IC). Limitado por las mem-
branas plasmndticas. cuya permeabilidad selecti-
va es responsable de la sustancial diferencia de
composicién quimica entre el Iiquido encerrado
en las células y el intersticial. Este compartimien-
to contiene dos tercios del agua corporal total,
unos 27 litros en un varén adulto de 70 kg de
peso. No hay métodos directos para la medicién
del agua IC. Se la obtiene por diferencia des-
pués de determinar agua total y extracelular.
b) Extracelular (EC). Claude Bernard lo lla
m6 “medio interno”. Todas las células se encuen-
tran inmersas en este liquido. de él reciben los
nutrientes necesarios para sus procesos anabé-
licos (de sintesis) y en é] vierten sus desechos
catabdlicos. La capacidad para regular la com-
posicién del medio interno ha sido el eslabon
evolutivo que permitis a los seres vivos indepen-
dizarse del medio externo. Los ptocesos fisiolé-
gicos de regulacién general tienden a mantener la
constancia de este medio interno.
El compartimiento extracelular comprende
los liquidos intravascular e intersticial. El liqui-
do intravascular o plasma sanguineo se encuen-
va confinado en el sistema canalicular del apars
to circulatorio. El Jiguido inrersticial toma con-
lacto directo con los cuerpos celulares, baiiados
por él, En el espacio EC se encuentra 20% del
agua total, aproximadamente 12 litros en un adulto
normal de 70 kg. A través de la pared de Jos ca-
pilares se realiza un activo intercambio entre los
Iiquidos intravascular e intersticial
La distribucion relativa del agua corporal
entre los distintos compartimientos se indica en
la tabla 23-1
‘A los compartimientos mencionados debe
agregarse otro, el transcelular, que comprende
el liquido contenido en la luz de los tractos d
gestivo, urinario y respiratorio; los liquidos ce-
tos Ifquidos representa s6lo 2,5% del total (aproxi-
madamente { litvo).
Cada uno de los espacios fluidos esté separado
por membranas que permiten el pasaje de agua y de
algunos solutos. Moléculas pequefias (O,. CO,. urea)
se mueven libremente entre todos los compartimien-
tos, pero otras sustancias tienen restringidos sus mo-
vimientos. Las proteinas del plasma, por ejemplo, es-
tn confinadas en el espacio intravascular; la pared
de los capilares no es permeable a macromoléculas.
El liquido intersticial no es fisioldgicamente uni-
forme. Consta de una fase libre, en intercambio con
los otros compartimientos, y otra fase parcialmente
“secuestrada’” en la red de la matriz del hueso y tejido
conjuntivo denso. Las fibras cokigenas minerilizadas
del hueso y la sustancia fundamental del conectivo for-
mada por los polimeros aniénicos de glicosamino-
glicanos unen selectivamente cationes y retienen agua
en una red casi cristalina, Por esta razén, una fraccion
importante del agua total (~ 10%) no intercambia facil-
mente con el resto de liquidos orgdnicos.
Consideradas de manera simplista, tas diferencias
quimicas entre compartimientos pueden resumirse a
los siguientes rasgos principales: el liquide intravas-
cular o plasma sanguineo posee numerosas sustancias
de peso molecular pequeno o cristaloides, en soht-
cidn verdadera, y proteinas (7 ¢ por dL} en solucisn
coloidal. Estas Gitimas, de gran tamaiio molecular,
no pueden atravesar las paredes capilares, que ac
tian como una membrana de didlisis. E) liquido
intersticial tiene una composicidn muy similar al plas
ma en cuianto a sustancias de pequeita masa, pero
su contenido de proteinas es pobre. El liquido in-
tracelular difiere notablemente de fos anteriores en
su composicién.
Determinacién det agua extracelular. Es posi
ble medir el volumen de agua EC con la técnica de
dilucién de solutos que difunden tnicamente en este
compartimiento, por ejempto inulina, "Br o sulfatos
con 8, Estos dltimos dan resultados més exactos. El
volumen de agua del plasma se puede estimar con co-
lorantes como e! azul de Evans o albtimina marcada
falorraquideo, pleural, pericdrdico y sinovial y el con "'o "I. En las mediciones de agua EC no se
humor acuoso de} globo ocular. La suma de es- —incluye el volumen de agua transcelular.
mn del agua corporal en el ser humano
Agua Liquide Liguido Liquido Liquide
total intracelular extracelular _intersticial _ intravascular
Hombre (aduito} 60 45 15 10 5
Mujer (adilta) 55 40 15 10 5
Lactante 7 48 29 24 5
Las cifras indican porcentaje del peso corporal
Bolance hidrico
En condiciones de adecuado aporte dietético,
el peso corporal de un adulto normal permanece
constante a pesar de las variaciones habituales
en la ingesta de agua. Ello indica que el contenido
hidrico es regulado eficazmente.
La incorporacién de agua se realiza por via
oral con los liquidos de bebida y con fos alimen-
tos sdlidos, que pueden contener 40% 0 mas de
su peso en agua. Debe agregarse el agua genera-
da en el organismo como producto metabolico
final. Una dieta mixta balanceada produce alrede-
dor de 12 g de agua por cada 100 Calorfas consu-
midas.
El rifidn est4 capacitado para mantener cons-
(ante el volumen hidrico: elimina orina muy dilui-
da cuando hay exceso de agua, o sumamente con-
centrada cuando es necesario retener agua en el
organismo. Hay pérdidas obligadas a nivel de la
piel por perspiracién insensible y por el pulmén,
pues el aire espirado esté saturado de vapor de
agua. Estas pérdidas aumentan en ambientes de
alta temperatura y sequedad atmosférica 0 en al-
‘gunos estados patolégicos (fiebre elevada por ej.)
Normalmente, las pérdidas por aparato digestivo
son escasas. En el tracto gastrointestinal se vier-
ten por dia unos 8 litros de agua, los cuales son
reabsorbidos en su casi totalidad. En un adulto
normal, en 24 horas se forman 1.000 mL de sa-
Jiva, 2.000 mL de jugo géstrico, 500 mL de bilis,
1.500 mL de jugo pancredtico y 3.000 mL de
jugo intestinal.
En condiciones patolégicas que provocan v6-
mitos 0 diarreas, buena parte de ese liquido no es
reabsorbido; las pérdidas de agua y electrélitos
pueden ser considerables: se producen deshidra-
tacién y desequilibrios iénicos.
En la tabla 23-2 se exponen cifras del balance
hidrico de un dia en un adulto normal.
‘Tabla 23-2. Balance hidrico de un
adulto normal (en 24 horas)
BALANCE HIDROMINERAL S01
Composicién iénica
de los liquidos corporates
La separacién del agua del organismo en com-
partimientos intra y extracelular tiene utilidad bio-
l6gica y clinica. Si bien las denominaciones son
esencialmente anatémicas, reflejan ta divisién
funcional y quimica resultante de la actividad de
Ja membrana celular. Aun dentro de Ia célula, la
composicién quimica de los liquidos contenidos
en las diversas estructuras subcelulares es dife-
rent. Por ejemplo, las mitocondrias y el reticulo
endoplésmico poseen capacidad para concentrar
determinados iones en su interior.
Tonogramas. La composicién iénica de los liqui-
dos corporales. puede representarse con los Hama
dos ionogramas propuestos por Gamble (fig. 23-1),
‘Un ionograma consta de dos columnas o barras ver-
ticales colocadas a la par; la izquierda representa
Jos cationes y la derecha, los aniones. La altura de
las barras es proporcional a la concentracién de
iones expresada en miliequivalentes por Jitro*. Como
en los liquidos biolégicos se mantiene la electroneu-
tralidad, ambas columnas tienen la misma altura.
E! sodio es el principal catin extracelular y el
potasio es el ms abundante del espacio intracelular.
Entre los aniones, el cloruro es preferentemente
extracelplar y los fosfatos, proteinatos y sulfatos
son principalmente intracelulares.
El agua difunde libremente a través de Jas mem-
branas, razén por la cual la presién osmética en todos
Jos compartimientos es aproximadamente la misma
Las columnas de aniones y cationes del liquido
intracelular son mas altas, es decir, muestran mayor
concentracién iénica que las de ios otros liquidos. Esto
implica que el ntimero de particulas disueltas por fitro
y la presién osmética intracelular son mayores que las
del liquido intersticial. Como Ja presién osmética re-
sulta del néimero de particulas dispersas en un deter-
minado volumen, independientemente de su carga el
trica y/o capacidad de combimacién, la diferencia entre
la presi6n osmética intra y extracelular es mucho me-
nor que lo sugerido por los ionogramas (fig. 23-1),
donde las concentraciones se representan en mili-
equivalentes por litro. En el Iiquido intracelular exis-
fe una buena proporcién de iones con carga mayor
que 1 y, por otra parte, algunos iones intracelulares
estin ligados a moléculas o estructuras y, por lo tanto,
no cuentan desde el punto de vista osimético,
De los tres compartimientos, el plasma sangui-
neo es e] mas accesible al andlisis. El liquido intersti-
cial es an ultrafiltrado del plasma: su composiesin
se calcula a partir de los vatores del plasma, aplican-
do un factor de correccién (ver mas adelante). La
concentraci6n de proteinas del liquido intersticial
es menor que la del plasma
© Se aconseja repasar los canceptos sobre expresivn de
concentraciones (pagina 18),
502
QUIMICA BIOLOGICA
No electrdtitos
HCO, clectetites
Heo; aemmemml1,COs
pico; “ ~Tosfatos
act es
wor
me s0F Ee Mg?
, e~Ac.ongan. Kt SOF
Plasma. Liquido intersticial ye
4 Liquido
Liquid extracelular intracelular
Fig, 23-1 Jonogramas del plasma, liquido intersticial ¢ intracelular (Gamble). La escala representa mEq por litro de agua.
Las concentraciones por ltro de agua resultan algo més elevadas que las expresadas por litro de plasma liquido intracelular.
El plasma contiene alrededor de 92% de agua y
8% de sdlidos, principalmente proteinas y
(la concentracién de proteinas plasmaticas var
tro del rango de 6 a 8 g por dL.). Debido a ese 8% de
sélidos, Ja concentraci6n de solutos aumenta en ese
porcentaje cuando es expresada por litro de agua
del plasma. Asi. si la concentracign de Na* en plas-
ma es 142 mEq/L, expresada en agua del plasma es
153 mEq/L. El Na‘ es el cation predominante del plas-
ma y su concentracion se mantiene dentro de estric~
tos limites. Otros cationes, como K*, Ca* y Mg, se
encuentran en cantidades mucho més reducidas. Los
principales aniones del ptasma son cloruro (CI) y
bicarbonato (HCO;-) (tabla 23-3). El liquido inters
ticial es un filtrado del plasma a través de las pare-
des de capilares, altamente permeables al agua, elec-
dlitos y solutos de pequefia masa. Muy escasa es
la cantidad de proteinas que atraviesa la pared capi-
lar. En la linfa, liquido de composicién sitnilar a la del
Viquido intersticial, la concentracién de proteinas es
de 13g pordL.
EI movimiento de fluido a través de Ja pared ca-
pilar depende del equilibrio entre fuerzas hidrostética
y osmstica (ver pag. 505). Hay una ligera diferencia
entre las concentraciones de electrdlitos en liquido
intersticial y plasma, determinada por el equilibrio
Gibbs-Donnan. La concentracién de cationes difu-
sibles es aproximadamente 4% més alta en plasma
que en el inlersticio, mientras la de aniones difusibles
€s menor en plasma en el mismo porcentaje.
Las particulas disueltas en los tiquidos orgéni-
cos son responsables de la fuerza osmética que de~
termina desplazamientos de agua entre compatti
mientos. Mientras Nat, Cl y HCO, son los print
pales responsables de Ja fuerza osmética que man-
tiene el agua en cl compartimiento extracelular, K*,
Mg? fosfatos y diferentes sustancias orgdnicas son
los solutos osméticamente dominantes en el inte-
rior de las células.
Aunque la composicién del Iiguido IC varfa en
diferentes tipos celulares, en todos 1a concentra-
cién de K* es elevada (~150 mEq/L) y baja en Nat
(~10 mEq/L). Otro catién presente en mayor con-
centraci6n en el liquido IC es el Mg, con alrededor
de 26 mEq/L, comparada con 2 mEg/L. en liquide EC.
La composicién de aniones de los liquidos IC y EC
también difiere; las concentraciones de Cry HCO,
son mas bajas, y las de fosfatos y sulfatos més altas
en el primero.
Equilibrio Gibbs-Donnan
AL pH de Jos Iiquidos biol6gicos (pH del plasma
normal = 7,4) las proteinas actitan como aniones.
Las protefnas, por su tamafio molecular, no pueden
atravesar las membranas celulares ni las paredes
capilares. La presencia de estos aniones, confina-
dos en un espacio hidrico cerrado por membranas,
semipermeables que permiten la libre difusion de
ottos jones, trae aparejada una distribuci6n desigual
de los iones difusibles a ambos lados de la membra-
na. En esta distribucién se cumplen tres requeri-
mientos basicos:
a) La concentracién total de aniones es igual a la
de cationes en cada lado de la membrana
BALANCE WIDROMINERAL 503
‘abla 23-3. Concentraciones de iones en plasma sanguineo,
Kiquido intersticial e intracelular (expresadas en mEq/L)
Agnadel Liquide Liquide a
oe s mugo Igo
ee Plasma “plasma instersticiat ttracetuler gisrico puncmisicn #47
= Ses 25 (ontsextlo) =
Sodio 142.0 152,7 147,5 13,0 60 130 45
50 0 150,0 7 7 cs
- SA ¥ 40 oa 110” Seed i
19 1s 26,0 - =
165.0 1580 189.6 = Sei
3.0 100 60 58
100 0 100 0
12
60
Proteinas 160 va 0
Total de aniones 153.2 1650 1580
b) En el sector que contiene protefnas, las con:
centraciones de aniones difusibles son menores y
las de cationes son mayores, comparadas con las,
de Ia fase sin proteinas.
©) La presién osmética es ligeramente superior
en el compartimiento con proteinas.
Supongamos dos compartimientos iguales (A y
B de la figura 23-2), separados por una membrana
semipermeable. En A se coloca una solucién que
contiene 5 mEq de proteina y 5 mEq de sodio. En B
se agrega igual volumen de Solucién con 10 mEq de.
cloruro y 10 mBq de sodio. Después de un cierto
tiempo se arriba @ un equilibrio entre ambas sohi-
ciones; la distribucién de Ios iones en los comparti-
micntos habré cambiado. En el lado A existiran, ade-
mas de los § mEq de proteinas y 5 mEq de sodio
Membrana semipermeable
A B | A B
Chamba a a
Nat Sint iNet YOmEa| | asa oquty Nar orb
Concentraciones Equilibrio
iniciales final
Fig, 23-2. Equilibrio Gibbs-Donnan
107,0
20,0
49,0
189.0
iniciales, 4 mEq de cloruros y 4 mEq de sodio que
difundieron desde el compartimiento B. En este iilti
mo quedaran 6 méq de cloruro y 6 mEq de sodio.
Si Mlamamos [Na’,} y [Cl-,] @ las concentracio-
nes de sodio y cloruro en el compartimiento A que
contiene proteinas, y [Na“g } y [Cla] a las existentes
en B, libre de iones no difusibles, una vez aleanzado
el equilibrio se tienen las siguientes relaciones:
(Na*4] [CPA] = [Na‘e) X [Clg]
[Na] [Chal
(Nes) Chal
La solucién en ambos lados de la membrana es:
eléctricamente neutra, [Na‘y] es igual a [Clg]. En el
compartimiento que contiene ct ion no difusible Prot”
se alcanza la electroneutralidad cuendo existe sufi-
ciente Na* para contrarrestar las cargas de Prot” y
Fr, de modo que: -
[Nar,] > (Cl] y (Nata) + [Cl g) > (Naty) + (Chg)
La presién osmética es mayor en el lado que
contiene proteinas. Para cada especie iGnica difusible
existe un gradiente, de igual magnitud pero de sen-
ido contrario, para cationes y aniones
504 QUIMICA BIOLOGICA
Entre plasma sanguineo y liquido intersticial, se~
parados por la pared de los capilares. se da una
situacién similar. Para calcular la concentraciGn de
anjones monovalentes en Ifquido intersticial, se
multiplica la concentracién determinada en plasma
por el factor 1,05 (factor Donnan); para cationes
monovalentes, el factor de correccién es 0,95.
Elequilibrio Gibbs-Donnan explica por qué la suma
de aniones y cationes es superior en el interior de fas
células, més rico en, protefnas. que en e) liquido
intersticial (ver ionogramas fig. 23-1). Sin embargo,
no puede inferirse de 1a teoria de Gibbs-Donnan la
desigual distribucién de Na* y K*, 0 de Ca’*, a am-
bos lados de la membrana plasmética. Esta situa-
cién es mantenida por mecanismos de transporte
activo que bombean sodio o calcio fuera de la célu-
la, Los sistemas de transporte existentes en las mem:
branas celulares son los principales responsables
de la diferencia en estructura idnica entre espacio
intracelular ¢ intersticio (ver pag. 183)
Osmolaridad de los liquidos corporates
La presién osmética de una solucién depende
del ndmero de partfculas (iones y moléculas) pre-
sentes en un determinado volumen de solvente,
Como el volumen de solvente varia con la tempera-
tura y, por Io tanto, Ja concentraci6n es modificada
por los cambios térmicos, se prefiere expresar la con-
centracién en mimero de particulas dispersas por
unidad de peso del solvente (molalidad). Una solu-
cidn que contiene un mol de particulas (6,022 x 10)
en 1,000 g de agua (solucién 1 molal o I m) desarro-
la una presién osmética de 22.4 atmésferas y con-
gela a —1,86°C (de:
‘Un mol de particalas corresponde también a una
tunidad lamada osmol. Un osmol es ta cantidad de par-
ticulas correspondiente al numero de Avogadro; di-
suelto en 1.000 g de agua da una solucién I osmolal.
Como la glucosa no se disocia, 1 mo! de hexosa
disuelto en 1.000 g de agua {solucién 1 m) produce
L mol de particulas y su osmolalidad es 1. El NaCl en
solucién acuosa se disocia completamente forman-
do dos iones (0 particulas) por cada molécula. Por
esta raz6n, una solucién | m de NaCl es 2 osmolal. El
K,SO, se disocia en solucién; da tres iones (un SO,
y dos K+) por cada molécula. Entonces, una solu-
cién | m de KSO, es 3 osmolal,
Un osmol de glucosa es igual a | mol; un osmol
de NaCl es igual a 0,5 moles y un osmol de K,SO,, a
0,333 moles. En la practica se utiliza Ja milésima parte
del osmol miliosmol (mOsmol).
A veces se habla indistintamente de osmolalidad y
osmolaridad, Jo cual no es correcto. La osmolaridad
expresa la concentracién en osmoles por litro de
solucién, mientras la osmolatidad, por 1.000 g de
solvente (la misma diferencia existente entre mo-
laridad y molalidad). A las temperaturas de interés
biolégico, cuando las concentraciones de soluto son
bajas, el error que se comete al referir osmolaridad
en lugar de osmolalidad no es muy acentuado,
Los compartimientos EC e IC estén en equilibrio
osmeético, dé modo que ambos tienen una concen-
tracién osmolar similar. Los desplazamientos de agua
son condicionados por la concentracién de solutos
osméticamente activos a cada lado de la membrana
En os liquidos extracelulares (LEC) pricticamente la
totalidad de la presién osmética se debe a iones y mo-
éculas de pequefia masa, que atraviesan facilmente
las paredes de los capilares. Determinaciones en plas-
ma sanguineo brindan informacidn sobre la osmo-
lalidad extracelutar, debida fundamentalmente a Ia
concentracién por kg de agua de los solutos acti-
vos sodio y aniones acompafantes y, en menor pro-
porcién, glucosa y urea
La presin osmética del plasma puede medirse
directamente por crioscopia. Si se determina el punto
de congelamiento del plasma es posible caleular st
concentracién en particulas osmoticamente activas
(el descenso del punto crioscépico, una de las pro
piedades coligativas, est relacionado con la con-
centracién de particulas). El plasma normal congela
a -0,56°C; por lo tanto, su osmolalidad es -0,56/
1,86 = 0,301 osmoles por kg de agua. En la prictica
no se comete error apreciable si se afirma que la
osmolaridad normal del plasma esté alrededor de
300 mOsmoles por litro.
Ladeterminacién de concentraciones de sodio, ghu-
cosa y urea en plasma también permite calculer la
osmolaridad mediante la siguiente frmula:
[glucosa] » Ndeurea)
1B 28
mOsmol/kg = 2[Na‘] +
La concentracién de Na* (habitualmente expre-
sada en mEq/L) se multiplica por 2 para incluir los
aniones acompaiiantes; las concentraciones de glu-
cosa y nitrégeno de urea (expresadas en mg/dL.) se.
dividen por 18 y 2,8 respectivamente para obtener el
valor en mEq/L (peso molecular de Ja glucosa, 180;
peso de 2 dtomos de N de Ja urea, 28)
Las sustancias no electroliticas aportan muy poco
a la presién osmética del plasma. Normalmente a la
glucosa le corresponden 5 mOsmol/kg. Sélo en casos
de diabetes con hiperglucemias muy elevadas puede
aleanzar alguna significaci6n. Por otto lado, como la
urea atraviesa las membranas y se equilibra répida
mente en todos Jos compastimientos, no es osméd-
ticamente efectiva. En condiciones normales no se
comete error importante si se infiere la presién
osmética efectiva del LEC a partir de la concentracién
de sodio en plasma.
Presién osmética efectiva (mOsmol/kg) = 2{Na*]
La osmolalidad efectiva es también designada
tonicidad. Las soluciones con osinolalidad efecti-
va igual a la de los liquidos corporales son isotd:
nicas; pot ejemplo. una solucién de NaCl 0,9 g/dL.
(solucion fisiolégiea).
Presién oncética. Una muy pequefta fraccisn de
la presidn osmética total del plasma se debe a Tas
proteinas. Pese a su reducido valor. la presion oncé-
Вам также может понравиться
- Test EDAHДокумент7 страницTest EDAHverecarranza100% (5)
- La Comunicación Perturbada y Su Impacto en La Construcción Del Conocimiento EscolarДокумент118 страницLa Comunicación Perturbada y Su Impacto en La Construcción Del Conocimiento EscolarCorphain PhyslakОценок пока нет
- Lesiones Liticas OseasДокумент2 страницыLesiones Liticas OseasAbel NetoОценок пока нет
- Precauciones en La Instalación de Transformadores de CorrienteДокумент6 страницPrecauciones en La Instalación de Transformadores de CorrienteLucas Gomez100% (1)
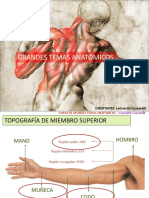
- Teoría Clase 2 - TopografíaДокумент76 страницTeoría Clase 2 - TopografíaAbel Neto100% (1)
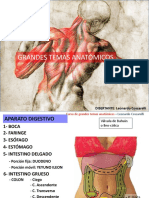
- Teoria Clase 3 ABDOMENДокумент90 страницTeoria Clase 3 ABDOMENAbel NetoОценок пока нет
- Tare 6. Prueba de Medias y Varianzas MejoradoДокумент11 страницTare 6. Prueba de Medias y Varianzas MejoradoalejandroОценок пока нет
- Teoría Clase 1 PELVISДокумент110 страницTeoría Clase 1 PELVISMaximilianoОценок пока нет
- TBC OsteoarticularДокумент7 страницTBC OsteoarticularAbel NetoОценок пока нет
- Fracturas Del CalcáneoДокумент35 страницFracturas Del CalcáneoAbel NetoОценок пока нет
- Fractura de MESETA TIBIAL - CLASIFICACION DE SCHATZKERДокумент2 страницыFractura de MESETA TIBIAL - CLASIFICACION DE SCHATZKERAbel NetoОценок пока нет
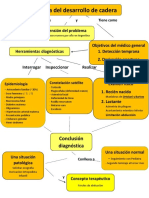
- Displasia Del Desarrollo de Cadera (Mapa y Ficha Conceptual)Документ3 страницыDisplasia Del Desarrollo de Cadera (Mapa y Ficha Conceptual)Juan Cruz SaldunaОценок пока нет
- Fractura de Tobillo 2Документ24 страницыFractura de Tobillo 2Abel NetoОценок пока нет
- Fracturas de AstrágaloДокумент25 страницFracturas de AstrágaloAbel NetoОценок пока нет
- 16 - ColagenopatíasДокумент8 страниц16 - ColagenopatíasAbel NetoОценок пока нет
- 17 - Manifestaciones Cutáneas de Enfermedades SistemicasДокумент7 страниц17 - Manifestaciones Cutáneas de Enfermedades SistemicasAbel NetoОценок пока нет
- Porque Soy Un Pueblo CelosoДокумент34 страницыPorque Soy Un Pueblo CelosoraguerreОценок пока нет
- Escuela Militar de Ingeniería PDFДокумент6 страницEscuela Militar de Ingeniería PDFBeimar Miguel CeronОценок пока нет
- Sena - Induccion Procesos Pedagogicos Taller Semana 3Документ3 страницыSena - Induccion Procesos Pedagogicos Taller Semana 3Anita SanOroОценок пока нет
- Casa GabrielaДокумент35 страницCasa GabrielaRonaldo ParionaОценок пока нет
- Evolucion Tecnologica de Ladrillos de ArcillaДокумент34 страницыEvolucion Tecnologica de Ladrillos de ArcillaOssWiss50% (2)
- Uptjaa Manual Psit 2015Документ86 страницUptjaa Manual Psit 2015Carlena AstudilloОценок пока нет
- Cómo Se Aplica La Teoría de TaylorДокумент2 страницыCómo Se Aplica La Teoría de TaylorZULAYОценок пока нет
- Comunicación AntonimoДокумент2 страницыComunicación AntonimoAngel MaciasОценок пока нет
- Pen Sis 55Документ19 страницPen Sis 55compraspto diazОценок пока нет
- X660671a4124e76648 Baker Huges Rev.04 PDFДокумент173 страницыX660671a4124e76648 Baker Huges Rev.04 PDFJoan MendozaОценок пока нет
- 4.3.3.C R.I. EgresadosДокумент7 страниц4.3.3.C R.I. EgresadosCarmela Esteban CastroОценок пока нет
- Interpretación e Integración Del Derecho Tributario 1Документ1 страницаInterpretación e Integración Del Derecho Tributario 1Mauro BarriosОценок пока нет
- Reseña de Finkielkraut Alain (1988) Cap. 1 ¿Quién Es Mi SemejanteДокумент5 страницReseña de Finkielkraut Alain (1988) Cap. 1 ¿Quién Es Mi SemejanteCAMILA LOPEZ OSORIOОценок пока нет
- Caso de Estudio AlfaДокумент12 страницCaso de Estudio AlfaMarcela Morales LopezОценок пока нет
- Caso Red LobsterДокумент2 страницыCaso Red Lobsterjose fabianОценок пока нет
- Ep4 CRMY SCMДокумент4 страницыEp4 CRMY SCMiluminacion LEDОценок пока нет
- Geometría Descriptiva UTPДокумент170 страницGeometría Descriptiva UTPBigotes BlancosОценок пока нет
- Solicitud de Inscripcion 22-23Документ2 страницыSolicitud de Inscripcion 22-23Aaron GonzalezОценок пока нет
- MRUVДокумент5 страницMRUVJulio Cesar Callata RojasОценок пока нет
- Antonio Machado (Resumen)Документ2 страницыAntonio Machado (Resumen)aixa_mosteiroОценок пока нет
- Clase 2. Entrevista Inicial Con Los Padres-AberasturyДокумент9 страницClase 2. Entrevista Inicial Con Los Padres-AberasturyMara CovarrubiasОценок пока нет
- TALLER QUIMICA No. 6-LA MATERIA Y SUS PROPIEDADES (II)Документ3 страницыTALLER QUIMICA No. 6-LA MATERIA Y SUS PROPIEDADES (II)maria fernandaОценок пока нет
- Análisis de Textos Jackobson Funciones Del LenguajeДокумент3 страницыAnálisis de Textos Jackobson Funciones Del Lenguajevanessa terraОценок пока нет
- 03 Carga Axial 04.11.2016Документ25 страниц03 Carga Axial 04.11.2016alfredo polin reyesОценок пока нет
- Problemas de Investigación OperativaДокумент7 страницProblemas de Investigación OperativamestadisticoОценок пока нет
- Wa0035.Документ5 страницWa0035.Sebastián GáfaroОценок пока нет