Академический Документы
Профессиональный Документы
Культура Документы
Obtención Del Magnesio Proceso Dow
Загружено:
Manuel FernandezАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Obtención Del Magnesio Proceso Dow
Загружено:
Manuel FernandezАвторское право:
Доступные форматы
Obtencin del Magnesio
Joaqun Jimnez Lorenzo
El magnesio es uno de los elementos ms abundante en la corteza terrestre
(2,2 % en masa). Est presente en el agua de mar (0,13 % en masa) y en diversos
minerales como la dolomita ( CaCO3 MgCO3 ), la magnesita ( MgCO3 ), la
brucita ( Mg (OH ) 2 ) la epsomita ( MgSO4 7 H 2 O ). En cuanto a los minerales
son los dos primeros los que mayor trascendencia tienen industrialmente, pero es
a partir de aguas marinas como se hace la extraccin a gran escala. Otros
minerales interesantes desde el punto de vista comercial seran la carnalita (
KMgCl3 6( H 2O ) )el talco ( H 2 Mg3 (SiO3 ) 4 ) y el olivino ( ( MgFe) 2 SiO4 ).
La dolomita es un constituyente fundamental de las rocas sedimentarias
carbonatadas (dolomas y calizas dolomticas) . Su presencia tambin es notable
en filones hidrotermales de baja temperatura y en rocas metamrficas (formadas
por altas presiones).
La magnesita se encuentra por lo comn en masas espticas compactas. Hay
importantes depsitos en la antigua Unin Sovitica, Austria, Grecia y Estados
Unidos.
Dolomita Magnesita
El magnesio metlico puede obtenerse por reduccin, tanto trmica como
electroltica.
En la reduccin trmica, la dolomita se descompone para dar xido de
magnesio, el cual se reduce en hornos elctricos a 1200 C con reductores como
pueden ser aleaciones de hierro y silicio (ferrosilicio), carbono, CaC 2 , etc. A
esta temperatura el magnesio se vaporiza a medida que se produce, desplazando
el equilibrio de la reaccin, que en principio era desfavorable a la reduccin.
El otro mtodo y el ms importante es la electrlisis gnea. En ste a su vez
distinguimos la electrlisis del MgO disuelto en un fluoruro y el mtodo de
electrlisis del MgCl 2 fundido.
La electrlisis del MgO disuelto en un fluoruro est actualmente en desuso.
Se fundamenta en una transformacin del mtodo clsico empleado para el
aluminio consistente en que la magnesita se disuelve en un bao de fluoruros
ajustando su densidad y su punto de fusin. Uno de los problemas del mtodo es
su tratamiento en la clula electroltica debido a la tendencia a flotar fundido por
encima del electrolito.
Finalmente se estudiar en ms detalle el segundo de los mtodos
electrolticos, tambin llamado proceso Dow con el que se obtiene el 80% del
magnesio mundial.
ste proceso parte del agua de mar o salmueras donde el magnesio se
encuentra disuelto en su forma inica Mg 2 (que proviene del MgCl 2 ( aq ) ) en
concentraciones de alrededor de 1350 mg/l.
Estas aguas marinas, tras ser filtradas y limpiadas se conducen a una planta
donde se les aade cal apagada ( Ca (OH ) 2 ), que se diluir generando iones
hidroxilo y dando lugar a la reaccin
Mg 2 (aq) 2(OH ) (aq)
Mg (OH ) 2 ( s) (*)(1)
en la que se obtendr hidrxido de magnesio que es muy poco soluble en agua y
que por tanto precipitar. Para obtener la mayor cantidad de precipitado el
proceso debe llevarse a cabo en un tanque de sedimentacin.
Es tpico que la cal apagada se produzca paralelamente a este proceso aunque
no forme parte de l estrictamente. Para su obtencin es comn la utilizacin de
conchas de ostras por su alto contenido de CaCO3 . stas se llevan a una planta
trituradora y posteriormente se las introduce en un horno a altas temperaturas
para producir cal y dixido de carbono de manera que ste ltimo se evapore y
slo quede la cal.
T
CaCO3 ( s ) CO2 ( g ) CaO( s )
Ms tarde se aade a la cal una cantidad limitada de agua cuya reaccin da la
cal apagada.
CaO ( s ) H 2O (l )
Ca(OH ) 2 ( s)
Despus de la reaccin (1) se procede a filtrar la suspensin lechosa
resultante. El Mg (OH ) 2 slido que da el filtrado se somete a un proceso de
lavado y secado, para ms tarde neutralizarlo con HCl .
Mg (OH ) 2 ( s) 2 HCl (aq)
MgCl2 (aq) 2 H 2 O(l ) (2)
Despus, la disolucin obtenida se conduce primero a unos evaporadores y
ms tarde a unos secadores con el objeto de eliminar el agua.
T
MgCl 2 (aq) 2 H 2 O(l ) MgCl 2 ( s ) 2 H 2 O(v)
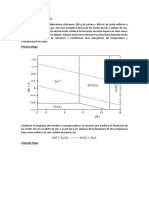
El MgCl 2 ( s ) que resulta se funde en una cuba electroltica (fig.) a unos
700C bajo atmsfera inerte (para minimizar las reacciones secundarias no
deseadas) para producir Mg fundido y Cl 2 gaseoso. El magnesio metlico se
forma en el ctodo de acero y sube a la superficie, donde se recoge
peridicamente. El cloro gaseoso se forma entorno al nodo de grafito y se
extrae. Este cloro gaseoso se convierte en HCl , que se reutilizar en la reaccin
(2). La reaccin de reciclaje es
T
2Cl 2 ( g ) 2 H 2 O(v) 4 HCl ( g ) O2 ( g )
(+ V c c)
Cl 2 ( g )
no do de g rafito
Mg (l )
MgCl 2 ( l )
(-V c c)
R ecipiente de acero que hace de ctodo
Oxidacin : 2 Cl Cl 2 ( g ) 2 e
2
Reduccin : Mg 2 e Mg ( l )
(*)Nota: la reaccin que realmente se produce es
Ca(OH ) 2 MgCl 2 (aq)
CaCl 2 (aq) Mg (OH ) 2 ( s )
dando como subproducto CaCl 2 que habr que tratar por su toxicidad.
En los ltimos aos China se ha convertido en uno de los grandes
exportadores del metal y ha cambiado las tendencias de obtencin anteriormente
expuestas. Ha apostado sobre todo por un proceso trmico llamado Pidgeon. Es
una tcnica algo ms sofisticada en la que se hace reaccionar silicio con xido de
magnesio a una temperatura muy elevada para obtener magnesio gaseoso.
T
2MgO CaO( s ) Si 2 Mg ( g ) Ca2 SiO4
Bibliografa
-R. E. Petrucci, W. S. Harwood. Qumica General. Principios y Aplicaciones
Modernas. Prentice Hall (1999)
-K. W. Whitten, R. E. Davis, M. L. Peck. Qumica General. McGraw Hill (1998)
-Fernando Fernndez Lzaro. Qumica Orgnica e Inorgnica Bsica.
Publicaciones UMH (2000)
Вам также может понравиться
- Capitulo IV - Metalurgia Del Magnesio Noviembre 2013Документ14 страницCapitulo IV - Metalurgia Del Magnesio Noviembre 2013Francisco Javier Alarcón Garrido100% (12)
- Tostación de CalcopiritaДокумент20 страницTostación de CalcopiritaJohn Reyes100% (2)
- Presentación General-Emew-CobreДокумент17 страницPresentación General-Emew-CobreGerardo Raúl0% (1)
- Química de La Fundición Del OroДокумент2 страницыQuímica de La Fundición Del OroLuis Angel Palomino100% (1)
- Fusión CuДокумент32 страницыFusión CuamilcarОценок пока нет
- Método de Ensayo Al FuegoДокумент2 страницыMétodo de Ensayo Al FuegoBV ACОценок пока нет
- Refinacion de Plomo ResumenДокумент3 страницыRefinacion de Plomo ResumenRodolfo UlloaОценок пока нет
- Obtención de Plomo Metálico A Partir de Concentrados Sulfurosos Mediante El Proceso de Lixiviación ElectrolíticaДокумент11 страницObtención de Plomo Metálico A Partir de Concentrados Sulfurosos Mediante El Proceso de Lixiviación ElectrolíticaCM AntoniОценок пока нет
- Obtención Del MagnesioДокумент8 страницObtención Del MagnesioCris Oñate100% (1)
- Electrodeposicion Del OroДокумент6 страницElectrodeposicion Del OroElvis BoNiОценок пока нет
- Electro Refinacion Del Cobre - ReviewДокумент9 страницElectro Refinacion Del Cobre - ReviewYudith Rosaluz Imata CondoriОценок пока нет
- Lab#6 Met-3322 Villca Lopez Jose MauricioДокумент9 страницLab#6 Met-3322 Villca Lopez Jose MauricioJose Mauricio Villca LopezОценок пока нет
- OximasДокумент52 страницыOximasalexis diazОценок пока нет
- Fire Assay 02Документ13 страницFire Assay 02Danielle KaufmanОценок пока нет
- Procedimiento de Copelacion y RefinacionДокумент7 страницProcedimiento de Copelacion y RefinacionLuis Enrique Surco FalconОценок пока нет
- Auxiliar No 6Документ6 страницAuxiliar No 6Cristian AlvayaiОценок пока нет
- Determinacion de Cu Por Volume Tri A RedoxДокумент7 страницDeterminacion de Cu Por Volume Tri A RedoxRodrigo Fuentes ValladaresОценок пока нет
- Metalurgia Del PlomoДокумент30 страницMetalurgia Del PlomoAnonymous uAFIm0Оценок пока нет
- Menas de CobreДокумент2 страницыMenas de CobreGeraldОценок пока нет
- Resumen Piro1Документ58 страницResumen Piro1Pamela Nacira Luna Flores0% (1)
- Metalurgia Del OroДокумент37 страницMetalurgia Del Orodavidnavarrete1991Оценок пока нет
- Proceso de Caustificación:Fabricación de La Soda CaústicaДокумент10 страницProceso de Caustificación:Fabricación de La Soda CaústicaJoseph Argume100% (1)
- Cementacion de Cobre-CrisДокумент6 страницCementacion de Cobre-CrisALEXANDER NAZARIO ACEVEDO SINCHEОценок пока нет
- Molina Examen1Документ7 страницMolina Examen1Alexandra MolinaОценок пока нет
- Preguntas InnovacionДокумент5 страницPreguntas InnovacionLito Saul Fernandez QuispeОценок пока нет
- Electrometalurgia IIДокумент14 страницElectrometalurgia IIcelesteОценок пока нет
- Problema Del FelderДокумент8 страницProblema Del FelderDamian DNОценок пока нет
- Informe #1 - OperacionesДокумент8 страницInforme #1 - OperacionesJuana Bessie Diaz SanchezОценок пока нет
- La Entalpia de Descomposición Del Peróxido de Hidrogeno Lab 5 de FQ PDFДокумент3 страницыLa Entalpia de Descomposición Del Peróxido de Hidrogeno Lab 5 de FQ PDFÁlvaro Rueda100% (1)
- Determinacion de CarbonatosДокумент8 страницDeterminacion de CarbonatosChristian Collazos Pardave0% (1)
- Metalurgia Power PointДокумент12 страницMetalurgia Power PointSergio Mourelle EliasОценок пока нет
- Ejercicios Sobre Gravimetría Bioquímica ClínicaДокумент11 страницEjercicios Sobre Gravimetría Bioquímica ClínicaVlady BazanteОценок пока нет
- Metales de La Triada Del HierroДокумент11 страницMetales de La Triada Del HierroPedro Santiago Salcedo Gutierrez100% (1)
- Separata Derivados Del AmoniacoДокумент31 страницаSeparata Derivados Del AmoniacoBrayan Castañeda LopezОценок пока нет
- Tarea 02 Lixiviación y Diagramas de PourbaixДокумент13 страницTarea 02 Lixiviación y Diagramas de PourbaixDaniel Bacilio RoldanОценок пока нет
- Diagrama de KelloggДокумент26 страницDiagrama de KelloggJuan Quispe100% (1)
- Laboratorio Pqi 1Документ8 страницLaboratorio Pqi 1James J. Rojas SanchezОценок пока нет
- Informe 1Документ10 страницInforme 1luiguiОценок пока нет
- Cálculos y ResultadosДокумент1 страницаCálculos y ResultadosRen AsОценок пока нет
- Determinacion de Niquel Por GravimetriaДокумент5 страницDeterminacion de Niquel Por GravimetriaMaira velandiaОценок пока нет
- Evaluación de Acidez en La Lixiviación de Minerales de CobreДокумент13 страницEvaluación de Acidez en La Lixiviación de Minerales de CobreIvonneRossyParianYallicoОценок пока нет
- Lab3 Analitica I CEXДокумент7 страницLab3 Analitica I CEXguiovanaОценок пока нет
- Hidrometalurgia de La CalcopiritaДокумент25 страницHidrometalurgia de La CalcopiritaChristian Mendez UtcaniОценок пока нет
- Cadmio y GalioДокумент14 страницCadmio y GalioBraulio ala andiaОценок пока нет
- Pirometalurgia - Pellasfinal-2-1Документ55 страницPirometalurgia - Pellasfinal-2-1Kleyjarh CorreaОценок пока нет
- Laboratorio de HidrometalurgiaДокумент5 страницLaboratorio de Hidrometalurgiajosemiguel_455Оценок пока нет
- GoetittaДокумент5 страницGoetittaluiguiОценок пока нет
- Planta ProcesosДокумент9 страницPlanta ProcesosJuan Livia VilcaОценок пока нет
- Determinacion de Zinc y Plata Por Espectrofotometría deДокумент15 страницDeterminacion de Zinc y Plata Por Espectrofotometría deFranz Aleman Sanchez100% (1)
- Hornos o Celdas para La Recuperacion de MAGNESIOДокумент16 страницHornos o Celdas para La Recuperacion de MAGNESIOGERARDOОценок пока нет
- Edx CursoДокумент55 страницEdx CursojeanОценок пока нет
- Informe 5Документ23 страницыInforme 5Yesica RiveraОценок пока нет
- MAGNESIOДокумент6 страницMAGNESIOarando estradaОценок пока нет
- Exposición Sobre El MagnesioДокумент4 страницыExposición Sobre El MagnesioElvis David Olivera MerloОценок пока нет
- Electrolisis para Obtención de MgCl2Документ4 страницыElectrolisis para Obtención de MgCl2estefania_chicaiza_40% (1)
- Obtención Del MagnesioДокумент13 страницObtención Del MagnesioGisse TolabaОценок пока нет
- Metal Proveniente Del MarДокумент6 страницMetal Proveniente Del MarBety Tlelo BárcenaОценок пока нет
- MagnesioДокумент5 страницMagnesioYudithMontalvoRamirezОценок пока нет