Академический Документы
Профессиональный Документы
Культура Документы
Silabo Quimica
Загружено:
J FОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Silabo Quimica
Загружено:
J FАвторское право:
Доступные форматы
UNIVERSIDAD NACIONAL DE INGENIERA
FACULTAD DE CIENCIAS
ESCUELA PROFESIONAL DE QUMICA
SLABO
INFORMACIN GENERAL
ASIGNATURA : QUIMICA I
CDIGO : CQ111
CRDITOS : 05 (CINCO)
PRE-REQUISITO : NINGUNO
CONDICIN : OBLIGATORIO
HORAS POR SEMANA : 07 (TEORA: 04, PRCTICA: 03)
SISTEMA DE EVALUACIN : F
OBJETIVO
Capacitar y presentar los principios bsicos de la Qumica como ciencia natural, abarcando sus tpicos ms
importantes y su relacin con los problemas cotidianos.
PROGRAMA ANALTICO
1. Qumica y Materia
La qumica y el mtodo cientfico.
Materia: Definicin. Clasificacin, sustancias y mezclas. Cambios fsicos y qumicos. Propiedades
fsicas y qumicas; Intensivas y extensivas.
Medicin e incertidumbre en las medidas. Cifras significativas.
2. Atomos, molculas e iones
Estructura del tomo: Ncleo atmico y nube electrnica. Unidad de masa atmica. Nmero atmico,
nmero de masa. Representacin de nclidos. Istopos.
Qumica Nuclear: Radiactividad. Energa nuclear. Estabilidad nuclear. Procesos nucleares: Emisiones
alfa y beta. Emisin de positrones. Captura electrnica. Transmutacin nuclear. Fisin y fusin nuclear.
Masas isotpicas, masas atmicas. Molculas y masas moleculares. Iones y masas formulares.
Definicin de mol. Masa molar. Relaciones de masas en frmulas qumicas: Frmula emprica,
frmula molecular, composicin centesimal.
Plan de Estudios 2011
3. Estructura electrnica de los tomos
Radiacin Electromagntica: Naturaleza Ondulatoria de luz, longitud de onda y frecuencia, espectro
electromagntico. Naturaleza corpuscular de la luz, la radiacin del cuerpo negro, efecto
fotoelctrico, energa del fotn, espectros atmicos, el modelo de Bohr para el tomo de Hidrogeno.
Dualidad onda-partcula de la materia y la energa, principio de incertidumbre. Modelo mecnico
cuntico del tomo: funciones de onda, nmeros cunticos y orbtales atmicos.
tomos multielectrnicos. Configuraciones electrnicas: Principios de construccin, exclusin y
mxima multiplicidad. Casos especiales de configuracin electrnica. Configuracin electrnica de
iones. Paramagnetismo y diamagnetismo.
4. Periodicidad qumica
Tabla Peridica Moderna: Ley peridica. Grupos y periodos. Bloques de la Tabla Peridica. Metales,
no metales, semimetales y gases nobles. Carga nuclear efectiva y efectos de pantalla. Propiedades
peridicas. Configuracin electrnica y reactividad qumica.
5. Enlace qumico y fuerzas intermoleculares
Energa en las reacciones qumicas: Calor y temperatura. Unidades de energa. Funciones de estado.
Energa interna y Entalpa, definicin y aplicaciones. Procesos endotrmicos y exotrmicos.
Clculo indirecto de la entalpa: Ley de Hess. Energas de enlace.
Enlace Inico: Notacin y estructura Lewis, formacin de iones, consideraciones energticas en el
enlace Inico, ciclo de Born-Haber. Carcter inico: Reglas de Fajans. Propiedades de compuestos
Inicos.
Enlace Covalente: Regla del Octeto, Formacin del enlace, tipos de enlace covalente,
representaciones de Lewis, carga formal, resonancia, excepciones a la regla del octeto.
Geometra Molecular. Reconocimiento de las formas geomtricas de las especies qumicas Momento
dipolar en una molcula.
Hibridizacin de orbtales atmicos, geometra de molculas orgnicas sencillas con enlace
mltiple.
Orbitales moleculares: definicin, formacin a partir de orbitales atmicos. Diagrama de orbitales
moleculares de especies homonucleares.
Enlaces en los Metales: TEV aplicado al enlace metlico, Mtodo Orbital Molecular y Teora de
Bandas, Teora de los electrones libres de metales (Modelo del mar de Electrones), Aislantes y
Semiconductores, dopaje.
Fuerzas de Van der Waals: In dipolo, dipolo-dipolo, polarizabilidad, fuerzas de dispersin de
London, Enlace por Puente de Hidrogeno: Intermolecular e intramolecular
6. Gases
Caractersticas generales del estado gaseoso. Presin, medicin y unidades de presin. Temperatura,
escalas relativas y escala absoluta. El gas ideal: definicin, restricciones. Aplicaciones. Teora
Cintico-Molecular de los gases: Visin Molecular de la ley de los gases. Distribucin de las
Velocidades Moleculares. Ley de Graham.
7. Lquidos y slidos
Lquidos: Tensin Superficial. Viscosidad. Presin de Vapor. Punto de ebullicin. Punto de
congelacin. Diagrama de fases: Fases, transiciones de fase, propiedades supercrticas, fluidos
supercrticos
Slidos: Tipos de slidos: Moleculares, redes covalentes, Inicos y metlicos. Slidos Amorfos.
Ejemplos y propiedades. Estructuras cristalinas, red cristalina, celda Unitaria, Sistemas cristalinos,
Plan de Estudios 2011
redes espaciales. Empaquetamiento cristalino en sustancias moleculares e inicas. Eficiencia de
empaquetamiento. Densidad y volumen molar.
8. Soluciones
Soluciones: Definicin. Visin molecular del proceso de disolucin. Solubilidad. Efectos de la
temperatura sobre la solubilidad, curvas de solubilidad. Efectos de la presin, ley de Henry.
Unidades de concentracin. Fsicas: Porcentaje en masa, volumen y masa/volumen. Qumicas:
Molaridad, molalidad, fraccin molar. Conversin de unidades. Operaciones de mezclado y dilucin.
Problemas.
9. Reacciones qumicas y estequiometra
Reacciones qumicas: representacin y balanceo de ecuaciones qumicas. Estequiometra: Relaciones
de masa en las ecuaciones qumicas.
Reactivo limitante. Rendimiento y pureza de reactivos.
Estequiometra de reacciones con soluciones. Estequiometra de reacciones con gases.
BIBLIOGRAFA
1. Ander P. y A. Sonessa, Principios de Qumica, Limusa, Mxico, 1983.
2. Brown T., H. Lemay y B. Bursten, Qumica. La Ciencia Central, 9 ed., Prentice Hall
Hispanoamericana, Mxico, 2009.
3. Chang R., Qumica, 9 ed., Mc Graw Hill, Mxico, 2009.
4. Mahan B., Qumica: Curso Universitario, Fondo Educativo Interamericano, Bogot,
1992.
5. Masterton W., Qumica General Superior, Interamericana, Mxico, 1983
6. Petrucci R. Y W. Hardwood, Qumica General, Prentice Hall, 10 Edicin, Madrid 2011.
7. Silberberg, Martn S. Qumica General. Segunda Edicin. Mxico: McGraw-Hill; 2002.
8. Whitten K., K. Gailey y R. Davis, Qumica General, Mc Graw Hill, Mxico, 1992.
Plan de Estudios 2011
Вам также может понравиться
- Laboratorio 3 - Fisica-Uni FiaДокумент18 страницLaboratorio 3 - Fisica-Uni FiaSTALIN GAMARRA GOMEZ100% (1)
- Laboratorio 3 - Fisica-Uni FiaДокумент18 страницLaboratorio 3 - Fisica-Uni FiaSTALIN GAMARRA GOMEZ100% (1)
- Hidrometalurgia I O. BenaventeДокумент105 страницHidrometalurgia I O. Benaventejamie04100% (10)
- Formación y Estabilidad de Complejos Metálicos (Cualitativa de Complejos)Документ8 страницFormación y Estabilidad de Complejos Metálicos (Cualitativa de Complejos)Abygail RH100% (1)
- Películas DelgadasДокумент3 страницыPelículas DelgadasJ FОценок пока нет
- Cho QuesДокумент23 страницыCho QuesJ FОценок пока нет
- Películas DelgadasДокумент3 страницыPelículas DelgadasJ FОценок пока нет
- Silabo QuimicaДокумент3 страницыSilabo QuimicaJ FОценок пока нет
- Fluor ProtectorДокумент8 страницFluor ProtectorYoyis NicolasОценок пока нет
- CuestionarioДокумент3 страницыCuestionarioJ FОценок пока нет
- Clase Quimica 24 03Документ15 страницClase Quimica 24 03J FОценок пока нет
- Qué Es El CromadoДокумент2 страницыQué Es El Cromadoyopoxxx100% (3)
- Informe (3) GasesДокумент16 страницInforme (3) Gasesnwmc00167% (3)
- "Informe Laboratorio 1" Química BásicaДокумент19 страниц"Informe Laboratorio 1" Química BásicaArT111091% (11)
- Introduccion Ala Ciencia de La ComputacionДокумент18 страницIntroduccion Ala Ciencia de La ComputacionJ FОценок пока нет
- Paradigma de ProgramacionДокумент2 страницыParadigma de ProgramacionJ FОценок пока нет
- Grafico - Velocidad - Vs - Tiempo - Docx - Filename - UTF-8''Grafico Velocidad Vs TiempoДокумент1 страницаGrafico - Velocidad - Vs - Tiempo - Docx - Filename - UTF-8''Grafico Velocidad Vs TiempoJ FОценок пока нет
- Clase Quimica 24 03Документ15 страницClase Quimica 24 03J FОценок пока нет
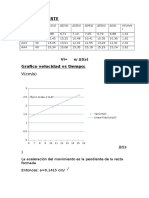
- Segunda ParteДокумент2 страницыSegunda ParteJ FОценок пока нет
- Velocidad y Aceleracion Laboratorio FisicaДокумент10 страницVelocidad y Aceleracion Laboratorio FisicaLutzScholzОценок пока нет
- Trabajo y EnergíaДокумент10 страницTrabajo y EnergíaMarco Ulloa67% (3)
- Guias de Quimica 1 2015-1Документ60 страницGuias de Quimica 1 2015-1J FОценок пока нет
- Hidrocarburos CíclicosДокумент18 страницHidrocarburos Cíclicoscarlos300106Оценок пока нет
- Trabajo MSДокумент30 страницTrabajo MSvkarimОценок пока нет
- Luisa Fernanda HoyosДокумент5 страницLuisa Fernanda HoyosNéstor Arias LoaizaОценок пока нет
- Enlace Metalico y Tom (I)Документ11 страницEnlace Metalico y Tom (I)Renato García TejadaОценок пока нет
- Compuestos de CoordinaciónДокумент24 страницыCompuestos de CoordinaciónVictoria HeydeОценок пока нет
- Cap 8 BДокумент20 страницCap 8 BIsmael Benito SánchezОценок пока нет
- I Respuestas Guia de Aprendizaje de Propiedades PeriodicasДокумент8 страницI Respuestas Guia de Aprendizaje de Propiedades PeriodicasDaniGonzálezSereyОценок пока нет
- Deber Individual Resumen y EjercДокумент5 страницDeber Individual Resumen y EjercKevincito PapitoОценок пока нет
- Electricidad FundamentosДокумент54 страницыElectricidad FundamentosVinzz Baldemar Frozt100% (1)
- Adición Electrofilica y NucleofilicaДокумент5 страницAdición Electrofilica y NucleofilicaNelson Daniel Guio PatiñoОценок пока нет
- Preguntas de Examen QUIMICA GENERALДокумент4 страницыPreguntas de Examen QUIMICA GENERALNadia N. SalattinoОценок пока нет
- EERДокумент5 страницEERGrid SanAyОценок пока нет
- Tarea de Refuerzo Física y Química 2 EvaluaciónДокумент2 страницыTarea de Refuerzo Física y Química 2 Evaluacióndoriscelinas4Оценок пока нет
- Presentacion Sem 3, 4 y 5 Quimica 10 ZoomДокумент25 страницPresentacion Sem 3, 4 y 5 Quimica 10 ZoomAngelica MolinaОценок пока нет
- Grupo B SolucionarioДокумент4 страницыGrupo B SolucionarioELMER TIGRE HUAMANОценок пока нет
- Clases 12-13-14 Enlace CovalenteДокумент62 страницыClases 12-13-14 Enlace CovalenteDayana Luz Garay RamirezОценок пока нет
- Capitulo I Libro FlotacionДокумент62 страницыCapitulo I Libro FlotacionConi GuzmánОценок пока нет
- Geometria MolecularДокумент21 страницаGeometria MolecularJesús Crespo RuizОценок пока нет
- IND 2022-02 Guía de Lab Q 6sДокумент5 страницIND 2022-02 Guía de Lab Q 6sKelvin Erick Toledo FloresОценок пока нет
- Conduccion Electrica de Los MaterialesДокумент10 страницConduccion Electrica de Los MaterialesAlonso Curiel LopezОценок пока нет
- Ensayo Compuestos InorganicosДокумент11 страницEnsayo Compuestos InorganicosAldrin Enforcer100% (1)
- Guias - Quimica - y - Lab - Desde La 1-5Документ28 страницGuias - Quimica - y - Lab - Desde La 1-5Patricia LopezОценок пока нет
- Propiedades Fisicoquimicas y Actividad FarmacologicaДокумент22 страницыPropiedades Fisicoquimicas y Actividad FarmacologicavladymirОценок пока нет
- Practica 2Документ10 страницPractica 2Juan Francisco JácomeОценок пока нет
- Información Sobre Las Reacciones Mecanoquímicas A Nivel MolecularДокумент9 страницInformación Sobre Las Reacciones Mecanoquímicas A Nivel MolecularNelson VelaОценок пока нет
- Quimica OrganikДокумент31 страницаQuimica OrganikBerenixerosenОценок пока нет
- ESTEREOQUIMICAДокумент16 страницESTEREOQUIMICAmirev25Оценок пока нет
- Guía de Laboratorio Tabla PeriodicaДокумент5 страницGuía de Laboratorio Tabla PeriodicaJuan Alejandro Fernandez CrespoОценок пока нет