Академический Документы
Профессиональный Документы
Культура Документы
Diagrama de Fase
Загружено:
LeiKer Castro0 оценок0% нашли этот документ полезным (0 голосов)
9 просмотров5 страницfase
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документfase
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
9 просмотров5 страницDiagrama de Fase
Загружено:
LeiKer Castrofase
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 5
Diagrama de fase.
En ciencia de materiales se denomina diagrama de estados de la
materia, a la representacin entre diferentes estados de la materia, en funcin
de variables elegidas para facilitar el estudio del mismo. Cuando en una de
estas representaciones todas las fases corresponden a estados de agregacin
diferentes se suele denominar diagrama de cambio de estado.
Los diagramas de equilibrio pueden tener diferentes concentraciones de
materiales que forma una aleacin a distintas temperaturas. Dichas
temperaturas van desde la temperatura por encima de la cual un material est
en fase lquida hasta la temperatura ambiente y en que generalmente los
materiales estn en estado slido.
Diferentes diagrama de equilibrio
Los diagramas de equilibrio ms sencillos son los de presin -
temperatura de una sustancia pura, como puede ser el del agua. En el eje
de ordenadas se coloca la presin y en el de abscisas la temperatura.
Generalmente, para una presin y temperatura dadas, el cuerpo presenta
una nica fase excepto en las siguientes zonas:
Punto critica: En este punto del diagrama coexisten los estados slido,
lquido y gaseoso. Estos puntos tienen cierto inters, ya que representan
un invariante y por lo tanto se pueden utilizar para calibrar termmetros.
Dos metales (A, B) a temperaturas superiores a sus respectivos puntos de
fusin (TA, TB) se encuentran en estado lquido pudindose disolver y
conformar as una fase nica lquida. Esto quiere decir que no podemos
establecer diferencias de comportamiento u observacin entre las distintas
partes del lquido y que los metales en las proporciones mezcladas tienen la
propiedad de miscibilidad. Si la mezcla lquida, XA + XB, la sometemos a un
proceso de solidificacin, mediante enfriamiento, llegamos a obtener el
producto que se denomina aleacin de los metales A y B.
Es conocido que las aleaciones mejoran las caractersticas de los metales
puros. Realmente debera decirse que introducen variables que diferencian
el comportamiento de los metales puros que las componen, porque en
algunas circunstancias pueden perjudicar sus propiedades. Obviamente,
conformar una aleacin es uno de los medios ms primitivos que la
ingeniera ha dispuesto para actuar sobre las propiedades de los metales
puros, incluso histricamente la aleacin es predecesora como lo justifica el
bronce,
En ciencia de materiales se utilizan ampliamente los diagramas de fase
binarios, mientras que en termodinmica se emplean sobre todo los
diagramas de fase de una sustancia pura.
Diagrama de fase eutctica.
La composicin eutctica presenta el punto de solidificacin ms bajo de
todo el sistema y por lo tanto la temperatura eutctica es la temperatura
ms baja a la cual puede existir alguna porcin de fase liquida. Si
prosigue el enfriamiento a partir de este punto, todo el liquido que quede
(que tendr composicin eutctica) solidifica formando simultneamente
las dos posibles fases solidas, y . Se da la circunstancia de que para
una determinada composicin existe una estabilidad asombrosa en
estado lquido y por tanto se "retarda" el proceso de solidificacin
Veamos esto en este diagrama
Si el componente es puro (a la izquierda del diagrama), la temperatura
de fusin (TA) es aprox 1380C. Para B puro (a la derecha del diagrama) la
fusin tiene lugar a 1485C. Si aadimos algo de B a A, por ejemplo, un 20% (
flecha roja) la temperatura de fusin (cristalizacin) se acerca a los 1360C.
Hemos conseguido reducir la temperatura a la que empieza la solidificacin
Para una mezcla de 60% (flecha azul) en B, tenemos un proceso parecido.
Cuando la concentracin, para esta aleacin, es del 50%, tenemos la
temperatura ms baja, dando lugar al punto Eutctico. Composicin de cada
fase. Cada fase tiene una composicin expresada en porcentaje en peso (% en
peso). Cuando en la aleacin est presente una sola fase, su composicin es
igual a la de la aleacin, y si se modifica la composicin original de la aleacin
se modifica entonces la composicin de la fase. Sin embargo, cuando
coexisten dos fases como liquido y slido, sus composiciones diferirn entre s
como de la composicin general original. Si esta cambia ligeramente, la
composicin de las dos fases no se afectar, siempre que la temperatura se
conserve constante. Esta diferencia queda explicada por la regla de fases de
Gibbs. Regla de la palanca. Es una herramienta para determinar el porcentaje
en peso de cada fase en un diagrama de fases binario. Se usa para determinar
el porcentaje en peso de las fases lquida y slida de un sistema binario
composicin-temperatura entre lquido y slido. En regiones de una sola fase,
la cantidad de la fase simple es 100%. En regiones Bifsicas, sin embargo, se
deber calcular la cantidad de cada fase. Una tcnica es hacer un balance de
materiales. Se puede utilizar la regla de la palanca en cualquier regin bifsica
de un diagrama de fases binario. En regiones de una fase no se usa el clculo
de la regla de la palanca puesto que la respuesta es obvia (existe un 100% de
dicha fase presente). Diagramas de Fase de Equilibrio. Los diagramas de
equilibrio de fase son mapas (por ejemplo, en el espacio temperatura-presin o
temperatura-composicin) de las fases estables de un material en funcin de
las condiciones de P, T y composicin.
Diagrama de fase binario
Cuando aparecen varias sustancias, la representacin de los cambios de
fase puede ser ms compleja. Un caso particular, el ms sencillo, corresponde
a los diagramas de fase binarios. Ahora las variables a tener en cuenta son la
temperatura y la concentracin, normalmente en masa.
Hay punto y lneas en estos diagramas importantes para su caracterizacin:
Slido puro o disolucin solida
Mezcla de disoluciones slidas (eutctica, eutectoide, peritctica,
peritectoide)
Mezcla slido - lquido
nicamente lquido, ya sea mezcla de lquidos inmiscibles (emulsin)o un
lquido completamente homogneo.
Mezcla lquido - gas
Gas (lo consideraremos siempre homogneo, trabajando con pocas
variaciones da altitud).
En un diagrama binario pueden aparecer las siguientes regiones:
Lnea de lquidos, por encima de la cual solo existen fases lquidas.
Lnea de slidos, por debajo de la cual solo existen fases slidas.
Lnea eutectoide y eutectoide. Son lneas horizontales (isotermas) en las
que tienen lugar transformaciones eutcticas y eutectoide respectivamente.
Lnea de solvu, que indica las temperaturas para las cuales una disolucin
slida () de A y B deja de ser soluble para transformarse en dos
disoluciones slidas () + () de distinta composicin en A y B.
Concentraciones definidas, en las que tienen lugar transformaciones a
temperatura constante:
Eutctica
Eutectoide
Peritctica
Peritectoide
Monotctica
Monotectoide
Sintctica
Catatctica
Вам также может понравиться
- LISTA DE SERVICIOS 2023 ActualizadaДокумент3 страницыLISTA DE SERVICIOS 2023 ActualizadaLeiKer CastroОценок пока нет
- Datos Tecnicos GMCCДокумент1 страницаDatos Tecnicos GMCCLeiKer Castro88% (8)
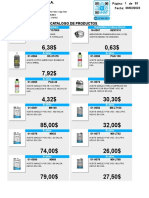
- Catalogo de Productos Amairca 08-02-2023Документ93 страницыCatalogo de Productos Amairca 08-02-2023LeiKer CastroОценок пока нет
- CATALOGO DE PRODUCTOS 22-12-2022 - CompressedДокумент77 страницCATALOGO DE PRODUCTOS 22-12-2022 - CompressedLeiKer CastroОценок пока нет
- Beneficios de La Actividad Fisica en El Adulto MayorДокумент26 страницBeneficios de La Actividad Fisica en El Adulto MayorLeiKer CastroОценок пока нет
- Soldadura (Electrodos Revestido)Документ84 страницыSoldadura (Electrodos Revestido)LeiKer CastroОценок пока нет
- Clasificación de Los Aceros AleadosДокумент14 страницClasificación de Los Aceros AleadosLeiKer CastroОценок пока нет
- Monografia Fisica Ii PDFДокумент5 страницMonografia Fisica Ii PDFhansОценок пока нет
- La Hoya de Las BrujasДокумент11 страницLa Hoya de Las BrujasCarinaMCorОценок пока нет
- Preguntas de Repaso Fisica MecanicaДокумент9 страницPreguntas de Repaso Fisica MecanicaLeidy Johanna Quitian Martinez100% (1)
- Cuchillas CañerasДокумент6 страницCuchillas CañerasJossymar Arroyo DíazОценок пока нет
- Ficha de Seguridad LOTO v01Документ3 страницыFicha de Seguridad LOTO v01Outdors Doors Xcluss100% (1)
- Serie 1 Emmc2013-1Документ8 страницSerie 1 Emmc2013-1bernyzeroОценок пока нет
- Curso RegularidadДокумент47 страницCurso RegularidadJesús AmorОценок пока нет
- Ud3 Refuerzo - Fyq 2eso - Parte 2Документ4 страницыUd3 Refuerzo - Fyq 2eso - Parte 2José Cuenca0% (1)
- Practicos Soluciones Cir2Документ41 страницаPracticos Soluciones Cir2dokitobi100% (3)
- Las Funciones TrigonométricasДокумент7 страницLas Funciones TrigonométricaskookarinОценок пока нет
- Informe Final de FisicaДокумент8 страницInforme Final de FisicaGiancarlos Pacherrez PerezОценок пока нет
- Proyecto Bobina de TeslaДокумент17 страницProyecto Bobina de TeslakaneozОценок пока нет
- FISICAДокумент4 страницыFISICAMAURICIO RIGOBERTO CHICAIZA QUINATOAОценок пока нет
- Biologia General 2Документ56 страницBiologia General 2Edinson AvilaОценок пока нет
- (CalcVarVbles) Clase 08Документ7 страниц(CalcVarVbles) Clase 08Wilson EcheverriОценок пока нет
- Instrumentos Electromagneticos. Caracteristicas y Funcionamiento PDFДокумент30 страницInstrumentos Electromagneticos. Caracteristicas y Funcionamiento PDFCarlosVianaОценок пока нет
- Monografia EstructurasДокумент9 страницMonografia EstructurasAndrea VilcamicheОценок пока нет
- ElectrogravimetríaДокумент44 страницыElectrogravimetríajaneОценок пока нет
- TCДокумент42 страницыTCVicente AriasОценок пока нет
- 2 - Interacción Electromagnética - PAUДокумент31 страница2 - Interacción Electromagnética - PAUHarim02Оценок пока нет
- Clase 12 (RM-UCV) 2Документ34 страницыClase 12 (RM-UCV) 2Jhonny CisnerosОценок пока нет
- Tippensfisica7ediapositivas07 131103205328 Phpapp01Документ53 страницыTippensfisica7ediapositivas07 131103205328 Phpapp01Eduardo Asinc BenitesОценок пока нет
- Resortes Helicoidales.2.0pptxДокумент11 страницResortes Helicoidales.2.0pptxJuan Diego AlvaradoОценок пока нет
- CAP 2 Ensayo de MaterialesДокумент99 страницCAP 2 Ensayo de MaterialesWilliams Solis QuispeОценок пока нет
- Trabajo Cuantica Uptc 1Документ1 страницаTrabajo Cuantica Uptc 1carlos peresОценок пока нет
- Preguntas para Test 2Документ27 страницPreguntas para Test 2rodrigocontr3100% (1)
- Vectores en El Espacio.Документ40 страницVectores en El Espacio.Jhonattan NeiraОценок пока нет
- 2012 - Invierno Fisica 0B Ingenierias 2da - EvaluacionДокумент8 страниц2012 - Invierno Fisica 0B Ingenierias 2da - EvaluacionJuan Jose Castro CabreraОценок пока нет
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaОт EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaРейтинг: 5 из 5 звезд5/5 (204)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaОт EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaРейтинг: 5 из 5 звезд5/5 (1876)
- La madre emocionalmente ausente: Como reconocer y sanar los efectos invisibles del abandono emocional infantilОт EverandLa madre emocionalmente ausente: Como reconocer y sanar los efectos invisibles del abandono emocional infantilОценок пока нет
- La violencia invisible: Identificar, entender y superar la violencia psicológica que sufrimos (y ejercemos) en nuestra vida cotidianaОт EverandLa violencia invisible: Identificar, entender y superar la violencia psicológica que sufrimos (y ejercemos) en nuestra vida cotidianaРейтинг: 4 из 5 звезд4/5 (2)
- El poder del optimismo: Herramientas para vivir de forma más positivaОт EverandEl poder del optimismo: Herramientas para vivir de forma más positivaРейтинг: 5 из 5 звезд5/5 (16)
- Yo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)От EverandYo Pude, ¡Tú Puedes!: Cómo tomar el control de tu bienestar emocional y convertirte en una persona imparable (edición revisada y expandida)Рейтинг: 5 из 5 звезд5/5 (8)
- Cómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.От EverandCómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.Рейтинг: 5 из 5 звезд5/5 (54)
- Psicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaОт EverandPsicología oscura: Una guía esencial de persuasión, manipulación, engaño, control mental, negociación, conducta humana, PNL y guerra psicológicaРейтинг: 4.5 из 5 звезд4.5/5 (766)
- Tus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadОт EverandTus Zonas Erroneas: Guía Para Combatir las Causas de la InfelicidadРейтинг: 4.5 из 5 звезд4.5/5 (1834)
- Resetea tu mente. Descubre de lo que eres capazОт EverandResetea tu mente. Descubre de lo que eres capazРейтинг: 5 из 5 звезд5/5 (196)
- Una mente en calma: Técnicas para manejar los pensamientos intrusivosОт EverandUna mente en calma: Técnicas para manejar los pensamientos intrusivosРейтинг: 4.5 из 5 звезд4.5/5 (145)
- Las 6 necesidades de cada niño: Empoderar a padres e hijos a través de la ciencia de la conexiónОт EverandLas 6 necesidades de cada niño: Empoderar a padres e hijos a través de la ciencia de la conexiónРейтинг: 4.5 из 5 звезд4.5/5 (7)