Академический Документы
Профессиональный Документы
Культура Документы
CM Tarea 1
Загружено:
ozhvyОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
CM Tarea 1
Загружено:
ozhvyАвторское право:
Доступные форматы
Ciencia de Materiales. Grupo: 1 Tarea.
Jimnez Pacheco Osvaldo.
Enlaces Secundarios.
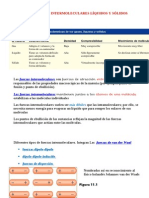
Los enlaces secundarios o tambin llamados de Van der Waals, son conocidos como
enlaces fsicos, y estos son ms dbiles en comparacin con los enlaces primarios o
qumicos (Inico, Covalente y Metlico).
Estos enlaces existen en todos los tomos de las molculas, pero su presencia puede pasar
desapercibida si ocurre alguno de los enlaces primarios. El enlace secundario es ms
evidente en los gases inertes, que tienen una configuracin electrnica estable, y adems,
entre molculas cuyos tomos este unidos covalentemente.
Las fuerzas de enlace secundario surgen de los dipolos atmicos o moleculares; un dipolo
aparece si hay alguna separacin entre las regiones positiva y negativa de un tomo o
molcula. Y el enlace es el resultado de la atraccin entre el extremo positivo de un
dipolo y la regin negativa del vecino. El enlace por puentes de hidrogeno, es un tipo
especial de enlace secundario.
Enlace Dipolo Inducido Fluctuante
En una molcula que normalmente es simtrica elctricamente se puede crear un dipolo
inducido por la distribucin espacial de electrones cargados positivamente. Todos los
tomos estn vibrando constantemente y pueden causar distorsiones instantneas en la
simetra elctrica de los tomos y molculas, creando pequeos dipolos elctricos, a su
vez los dipolos suelen desplazar la distribucin electrnica de tomos o molculas
prximas y generar otro dipolo que se enlazan dbilmente provocando un enlace
secundario.
Este tipo de enlace es el responsable de la condensacin y, a veces de la solidificacin de
los gases inertes y otras molculas elctricamente neutras y simtricas, (2 2 ). En los
materiales que presentan este tipo de enlace, se caracterizan por temperaturas de fusin
y ebullicin extremadamente bajas.
Enlace Dipolo Inducido- Molcula Polar.
En algunas molculas existen dipolos permanentes como consecuencia de la distribucin
asimtrica de regiones cargadas positiva y negativamente, son denominadas molculas
polares.
Estas molculas tambin pueden inducir dipolos en las molculas apolares prximas, y el
enlace es la resultante de las fuerzas de atraccin entre dos molculas, adems, la
magnitud de este enlace aumenta con los dipolos inducidos fluctuantes.
Enlace con Dipolo Permanentes.
Tambin existen fuerzas de Van der Waals entre molculas polares adyacentes, las
energas asociadas son significativamente mayores que las de los enlaces entres dipolos
inducidos.El tipo de enlace secundario ms fuerte, el enlace por puente de hidrogeno, es
un caso particular de enlace de molcula polar. Tiene lugar entre molculas con el
hidrogeno unido covalente mente al flor, al oxigeno y al nitrgeno. En cada enlace el
electrn positivo del hidrogeno es compartido con otro tomo, de este modo el hidrogeno
del enlace es esencialmente un protn cargado positivamente capaza de generar una
elevada fuerza de atraccin con el extremo negativo de una molcula adyacente. En
esencia, el protn forma un puente entre dos tomos cargados negativamente.
Cloruro de Sodio Disuelto en Agua.
El cloruro de sodio en agua, es una reaccin de disociacin, es decir que el cloruro de
sodio simplemente se disuelve en agua y formara los respectivos:
NaCl+ H20 ---->Na + Cl-
En cuanto a los enlaces, la sal (NaCl) est unida mediante un enlace inico, Na+----Cl-, y el
agua (H2O) H - -O- -H que es una molcula altamente polar y a la que le es muy fcil
debido al oxigeno encerrar a cada componente de la sal, es decir los oxgenos rodean al
sodio (Na+) y los hidrgenos restantes son atrados por el cloro (Cl-). El oxigeno que tiene
una carga 2- le es muy fcil atraer a la parte positiva de la sal, que es el sodio con carga 1+,
de manera similar ocurre con el hidrogeno, que tiene una carga 1+ y resultan atrados por
la carga negativa del cloro (Cl-).
Bibliografa.
Introduccin a la Ciencia e Ingeniera de los materiales, Callister Willian D. Editorial
Reverte.
Quimica, Chang Raymond, Mc Graw-Hill, Novena Edicin
Notas de clase, facultad de qumica.
Вам также может понравиться
- Enlace QuímicoДокумент8 страницEnlace QuímicoValeria Alexandra De La Cruz RojasОценок пока нет
- Fuerzas IntermolecularesДокумент38 страницFuerzas IntermolecularesTomas YarangaОценок пока нет
- Enlace IntermolecularДокумент17 страницEnlace IntermolecularLoren Paredes GarayОценок пока нет
- Enlace QuimicoДокумент10 страницEnlace QuimicoKairi TBCTОценок пока нет
- Cromatografía de GasesДокумент3 страницыCromatografía de GasesGalac TicosОценок пока нет
- FUERZAS IntermolecularesДокумент15 страницFUERZAS Intermolecularesloquillo1Оценок пока нет
- Destilación Simple y Destilación FraccionadaДокумент26 страницDestilación Simple y Destilación FraccionadaAndy AldamaОценок пока нет
- Fuerzas IntermolecularesДокумент43 страницыFuerzas IntermolecularesBrayan CastilloОценок пока нет
- Taller de Estudio 5 Fuerzas IntermolecularesДокумент2 страницыTaller de Estudio 5 Fuerzas IntermolecularesdeesdeewОценок пока нет
- Práctica 1 Química II Ciclo Impar 2021Документ9 страницPráctica 1 Química II Ciclo Impar 2021Sergio Jose Segura AmayaОценок пока нет
- Fuerzas IntermolecularesДокумент3 страницыFuerzas IntermolecularesNicolas VasiliuОценок пока нет
- Curso de Formuladores Quimicos 2018Документ307 страницCurso de Formuladores Quimicos 2018Adriana PInedaОценок пока нет
- 03 Estructura Interna de Los MaterialesДокумент8 страниц03 Estructura Interna de Los MaterialesFranco LОценок пока нет
- Ejercicios de Fundamentos de QuímicaДокумент4 страницыEjercicios de Fundamentos de QuímicaBrandon Calef Alain Estrada MartinezОценок пока нет
- Flotación de Minerales (Libro) PDFДокумент127 страницFlotación de Minerales (Libro) PDFElena Tobar Velásquez100% (1)
- Quimica de Compuestos PDFДокумент170 страницQuimica de Compuestos PDFDekino Rincón GallardoОценок пока нет
- Clase 6 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2015Документ34 страницыClase 6 Polaridad de Las Moléculas y Fuerzas Intermoleculares 2015Feña Ibarra FuentesОценок пока нет
- Teoria de Enlace QuimicoДокумент13 страницTeoria de Enlace QuimicoLlocclla Ccasani GloriaОценок пока нет
- 2023 Guía Química - NesДокумент53 страницы2023 Guía Química - NesPaulina UrbisagliaОценок пока нет
- Enlace Químico II - Enlace Puente de Hidrogeno - Dipolo - Dipolo - Pre Escolar MariscalДокумент4 страницыEnlace Químico II - Enlace Puente de Hidrogeno - Dipolo - Dipolo - Pre Escolar MariscalJulio Cesar Palomino PerezОценок пока нет
- Presentacion Enlace Quimico (Apunte 2) v2 FinalДокумент75 страницPresentacion Enlace Quimico (Apunte 2) v2 FinalAnto SanitáОценок пока нет
- bf3bbf77117ff6bb59e3114d231f55b7Документ23 страницыbf3bbf77117ff6bb59e3114d231f55b7Jesus D HernandesОценок пока нет
- Practica3 FruerzasДокумент7 страницPractica3 FruerzasLUIS LOPEZОценок пока нет
- Ejercicios Resueltos de QuimicaДокумент15 страницEjercicios Resueltos de QuimicaLuis Enrique Bautista DavidОценок пока нет
- M5 - MA41 - Guia de Laboratorio 201401 Version 2Документ66 страницM5 - MA41 - Guia de Laboratorio 201401 Version 2Esther Maribel Condori soncoОценок пока нет
- Tesis Espumas Contra IncendiosДокумент43 страницыTesis Espumas Contra IncendiosDiego Olivos100% (1)
- Capitulo 11 Fuerzas Intermoleculares Liquidos y SolidosДокумент12 страницCapitulo 11 Fuerzas Intermoleculares Liquidos y SolidostaipantaiОценок пока нет
- El Átomo y Los EnlacesДокумент24 страницыEl Átomo y Los EnlacesDdaniialejanddrooОценок пока нет
- Laboratorio de Química OrgánicaДокумент23 страницыLaboratorio de Química Orgánicamarlene-stemkeОценок пока нет
- Laboratorio Experiencia 4Документ28 страницLaboratorio Experiencia 4CrisThian Bances CajusolОценок пока нет