Академический Документы
Профессиональный Документы
Культура Документы
Benci Lo Pre Vio
Загружено:
Diana Moedano0 оценок0% нашли этот документ полезным (0 голосов)
6 просмотров4 страницыorganica
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документorganica
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
6 просмотров4 страницыBenci Lo Pre Vio
Загружено:
Diana Moedanoorganica
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 4
EQUIPO 5
MOEDANO PEREZ DIANA LAURA
BALDERAS GUTIERREZ AXEL ALEJANDRO
BENCILO
a) Efectuar una oxidación usando ácido nítrico en cantidades catalíticas.
b) Regenerar dentro del seno de la reacción el agente oxidante, utilizando
una segunda reacción de óxido-reducción.
1. Reacción y mecanismo propuesto.
La reacción se inicia cuando 2 moléculas de HNO3, a través de una reacción ácido-
base, reaccionan entre si para formar el ión nitrato y el ácido nítrico protonado, y
ante la ruptura heterolítica del enlace O-N, da a lugar agua y el ión nitronio, el cual
es en realidad el oxidante de la Benzoína; ya que este se transforma en ácido nitroso
y finalmente en óxidos de nitrógeno.El ión nitronio reacciona con el grupo hidroxilo
de la Benzoína para formar el éster nítrico protonado, el cual al reaccionar con el
ión nitrato sufre una reacción redox, dando a lugar así al producto de oxidación (la
Benzoína protonada), el producto de reducción (el ión nitrito) y ácido nítrico .El
Bencilo protonado, a través de una reacción ácido-base con el agua, conduce a la
formación de Bencilo. El anión nitrito en el medio ácido da lugar al ácido nitroso, el
cual se puede protonar en otra reacción ácido-base para formar el ácido nitroso
protonado. La ruptura heterolítica del enlace C-N da lugar a la generación de agua
y al ión nitrosonio
2. ¿Qué gas se desprende de la reacción y de donde proviene?
En la mayoría de los casos se presenta el óxido nitroso (también llamado dióxido
de nitrógeno), aunque puede darse el caso de que pueda presentarse en mínimas
cantidades el óxido nítrico (monóxido de nitrógeno), estos últimos son clasificados
como contaminantes tóxicos secundarios.
EQUIPO 5
MOEDANO PEREZ DIANA LAURA
BALDERAS GUTIERREZ AXEL ALEJANDRO
3. Esquema del montaje de la reacción (con trampa de agua o sosa)
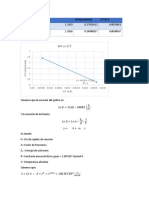
4. Rendimiento teórico
2.5 ***** ***** g
212 63.01 210 g/mol
0.01179 0.2358 0.01179 Mol
***** 14.8577 2.4759 g
***** 9.82 ***** mL
EQUIPO 5
MOEDANO PEREZ DIANA LAURA
BALDERAS GUTIERREZ AXEL ALEJANDRO
5. Propiedades de reactivos y productos.
EQUIPO 5
MOEDANO PEREZ DIANA LAURA
BALDERAS GUTIERREZ AXEL ALEJANDRO
6. Diagrama de Flujo
BIBLIOGRAFIA
1) Adams R., Johnson J.R. & Wilcox C.F. Laboratory Experiments in Organic
Chemistry 6a. Ed. Mc Millan Co. Londres (1970) p. 369. 2) Clarke H.T. et al Org.
Syn. Coll. 1 87 (1941). 3) J. Am. Chem. Soc. 70, 366-367 (1948). 4) Roberts J.D. &
Caserio M.C. Basic Principles of Organic Chemistry W.A. Benjamin Inc. U.S.A.
(1964)
Вам также может понравиться
- Planilla - Mantenimiento - Preventivo - Generadores Marcelo V1Документ5 страницPlanilla - Mantenimiento - Preventivo - Generadores Marcelo V1Andrés Luis DulcichОценок пока нет
- MVCS - Estudio de Microzonificacion Sismica y Peligros Multiples de La Ciudad de ChinchaДокумент31 страницаMVCS - Estudio de Microzonificacion Sismica y Peligros Multiples de La Ciudad de ChinchaFernando SanabriaОценок пока нет
- Curvas de SecadoДокумент6 страницCurvas de SecadoDiana MoedanoОценок пока нет
- Solucion Del Examen PDFДокумент5 страницSolucion Del Examen PDFDiana MoedanoОценок пока нет
- Tercer Examen ReactquimhomДокумент3 страницыTercer Examen ReactquimhomDiana MoedanoОценок пока нет
- Previo Secador Rotatorio-Diana Laura Moedano PérezДокумент7 страницPrevio Secador Rotatorio-Diana Laura Moedano PérezDiana MoedanoОценок пока нет
- FerrostalДокумент33 страницыFerrostalDiana MoedanoОценок пока нет
- Publicidad Subliminal en Nuestros TiemposДокумент9 страницPublicidad Subliminal en Nuestros TiemposDiana MoedanoОценок пока нет
- ConclusionesДокумент2 страницыConclusionesDiana MoedanoОценок пока нет
- LN KДокумент2 страницыLN KDiana MoedanoОценок пока нет
- P6EQ7Документ8 страницP6EQ7Ybonhe Ahava Ezmer100% (1)
- 338260846Документ10 страниц338260846Diana MoedanoОценок пока нет
- Carlos Infome Labo 2Документ15 страницCarlos Infome Labo 2Diana Moedano0% (1)
- BenzofenonaДокумент6 страницBenzofenonaDiana MoedanoОценок пока нет
- Exposición Ecosistema AnzoáteguiДокумент2 страницыExposición Ecosistema AnzoáteguiJeanerKix9335Оценок пока нет
- EnsayoДокумент4 страницыEnsayoCarlos MirandaОценок пока нет
- El Cambio Climatico CompressedДокумент9 страницEl Cambio Climatico CompressedGleidys RamirezОценок пока нет
- Observaciones Del Camal de Velille-Cusco Al Año 2020Документ15 страницObservaciones Del Camal de Velille-Cusco Al Año 2020Fernando Chirinos GarateОценок пока нет
- Contrato de Condiciones Uniformes PDFДокумент66 страницContrato de Condiciones Uniformes PDFPaulino Murcia HerreraОценок пока нет
- Memoria ITP 2006Документ31 страницаMemoria ITP 2006leydiangelinoОценок пока нет
- CatalogoДокумент20 страницCatalogoMeli CastañoОценок пока нет
- Trabajo Final de Consultoria EmpresarialДокумент7 страницTrabajo Final de Consultoria EmpresarialAlejandro RamosОценок пока нет
- Guía Práctica #01Документ4 страницыGuía Práctica #01ALEXANDER RONALDO TRUJILLO SANCHEZ100% (1)
- PIP RaindropTechniqueДокумент1 страницаPIP RaindropTechniqueMucia RodriguezОценок пока нет
- CIENCIA Y TECNOLOGÍA El Mal Manejo de Los Residuos Sólidos Influye en El Calentamiento GlobalДокумент9 страницCIENCIA Y TECNOLOGÍA El Mal Manejo de Los Residuos Sólidos Influye en El Calentamiento GlobalAtilio Jhon CHUQUILLANQUI MIRANDAОценок пока нет
- Logica Sin Sentido (Textos DispersosДокумент11 страницLogica Sin Sentido (Textos DispersosFreddie Alberto BossaОценок пока нет
- Catalogo TugaltДокумент32 страницыCatalogo TugaltVladimir Lopez ZamoraОценок пока нет
- Informe Shank AdapterДокумент3 страницыInforme Shank Adapterjose velascoОценок пока нет
- Signos Vitales para Udla PawerpointДокумент8 страницSignos Vitales para Udla PawerpointMei TachibanaОценок пока нет
- UPpoysnДокумент118 страницUPpoysnWualdo Arnaldo Blas SalazarОценок пока нет
- Documento Orientador y Guia de Estudios Est 1 Examen de Nuevo Ingreso 21 22Документ13 страницDocumento Orientador y Guia de Estudios Est 1 Examen de Nuevo Ingreso 21 22Emile Michel CioranОценок пока нет
- Exposicion II Unidad - Grupo 4Документ10 страницExposicion II Unidad - Grupo 4MARIANELA BARRIOS CHAFLOQUEОценок пока нет
- El Corazon Del Universo en Disputa Un EsДокумент26 страницEl Corazon Del Universo en Disputa Un EsvolveramonОценок пока нет
- Urea (Conde)Документ33 страницыUrea (Conde)Julio GomezОценок пока нет
- El Tracto Reproductivo de La VacaДокумент10 страницEl Tracto Reproductivo de La VacaHeber RojasОценок пока нет
- Pavimentos Flexibles.Документ26 страницPavimentos Flexibles.Atl YólotlОценок пока нет
- S2100398 EsДокумент148 страницS2100398 EssalehОценок пока нет
- Ensayo Vicky IIIДокумент8 страницEnsayo Vicky IIIConstanza PazОценок пока нет
- Terapia PeriodontalДокумент25 страницTerapia PeriodontalRobert AucancelaОценок пока нет
- Tesis MariquitasДокумент142 страницыTesis Mariquitasgourmand05Оценок пока нет
- NVS 21 629 PL 201 - Rev.0Документ2 страницыNVS 21 629 PL 201 - Rev.0Gutierrez Condor Diego AlonsoОценок пока нет
- Iqi-041e-Paucarchuco Castillo Ricardo Wilder PDFДокумент7 страницIqi-041e-Paucarchuco Castillo Ricardo Wilder PDFErick Gómez RomeroОценок пока нет