Академический Документы
Профессиональный Документы
Культура Документы
Lista de Calorimetria 2
Загружено:
Nuricel Villalonga AguileraИсходное описание:
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Lista de Calorimetria 2
Загружено:
Nuricel Villalonga AguileraАвторское право:
Доступные форматы
LISTA DE EXERCÍCIOS 2
CALORIMETRIA II
1. CURVA DE AQUECIMENTO.
Um corpo de massa m, inicialmente no estado sólido e a uma Atenção Calorímetro → É um recipiente termicamente
temperatura T0, ao receber continuamente calor, alteram-se sua isolado.
temperatura e estado como mostra a curva de aquecimento
abaixo. Exemplo: Caixa de isopor, garrafa térmica, etc
Temperatura 2. TROCAS DE CALOR.
T F
(vaporização) Dois ou mais corpos, com temperaturas diferentes, quando
líq. gás. Gasoso colocados no interior de um calorímetro, trocam calor entre si
P.E.
D Patamar E até atingirem o equilíbrio térmico (mesma temperatura).
(fusão)
P.F. sól. líq. Líquido Calorímetro Calorímetro
B Patamar C Após o
T A > TB equilíbrio Mesma
Sólido térmico temperatura
T0 A TA Calor TB T T
A B A B
Calor
0 Q1 Q2 Q3 Q4 Q5
QS S QL F QS L QL V QS G
¾ LEI GERAL DAS TROCAS DE CALOR:
Análise da curva de aquecimento:
A soma das quantidades de calor trocadas pelos corpos, até
1o) No trecho AB, o corpo recebe uma quantidade de calor atingirem o equilíbrio térmico, é nula.
sensível no estado sólido (Qss) até atingir o ponto de fusão
(P.F.). ∑Q = 0
No exemplo acima, pela Lei Geral das Trocas de Calor, teremos:
∑Q = 0 Q A + QB = 0
o
2 ) No trecho BC (Patamar de fusão), o corpo recebe uma
quantidade de calor latente de fusão (QLF), passando do estado
sólido para o estado líquido. APLICAÇÕES
01. O diagrama representa a curva de aquecimento de 20
gramas de uma substância inicialmente no estado líquido. O
calor latente de vaporização da substância é:
3o) No trecho CD, o corpo recebe uma quantidade de calor
sensível no estado líquido (QSL) até atingir o ponto de ebulição
(P.E.).
4o) No trecho DE (Patamar de vaporização), o corpo recebe uma
quantidade de calor latente de vaporização (QLV), passando do
estado líquido para o estado gasoso.
a) 10 cal/g c) 30 cal/g e) 40 cal/g
b) 20 cal/g d) 25 cal/g
5o) No trecho EF, o corpo recebe uma quantidade de calor
sensível no estado gasoso (QSG) até atingir uma temperatura 02. Derramando-se 50 cm3 de café quente (80 0C) em um copo
final T. de leite morno (40 0C), obtém-se 200 cm3 de café com leite a
uma temperatura aproximada de:
0
a) 20 C. c) 50 0C. e) 120 0C.
b) 40 0C. d) 80 0C.
cG → calor específico do corpo no estado gasoso.
Fale conosco www.portalimpacto.com.br
03. Um corpo troca calor exclusivamente com 150 g de água,
inicialmente a 40 0C. A temperatura inicial do corpo é 200 0C e o A massa desse gelo é:
equilíbrio térmico ocorre a 50 0C. A capacidade térmica desse
0
corpo, em cal/ C, é igual a: a) 1,0 g
b) 10 g
a) 2 c) 7 e) 15
c) 1,0 . 102 g
b) 5 d) 10
d) 1,0 Kg
e) 10 Kg
REVISÃO
01. O gráfico representa a temperatura θ de uma substância de
massa 20 g, inicialmente sólida, em função da quantidade de
calor recebido Q. Podemos afirmar que a capacidade térmica no
estado sólido, o calor latente de fusão e o calor específico no
estado líquido dessa substância valem, respectivamente:
05. No interior de um calorímetro adiabático contendo 500 g de
água a 20 0C, são colocados 100 g de chumbo a 200 0C. O calor
específico da água é 1 cal/g. 0C e o do chumbo é 0,031 cal/g. 0C.
A temperatura final de equilíbrio é aproximadamente:
0
a) 31 C. c) 25,30C. e) 21,10C.
b) 28,4 0C. d) 23,50C.
06. No interior de um calorímetro de capacidade térmica 60
cal/0C há 200 g de água (calor específico = 1 cal/g. 0C).
Fornecendo 3000 cal ao sistema, observa-se que sua
0
temperatura sofre uma variação de 10 C. A quantidade de calor
0 .0
a) 5 cal/ C; 10 cal/g; 0,5 cal/g C perdido por esse sistema nesse processo é de:
0 .0
b) 10 cal/ C; 5 cal/g; 1 cal/g C
c) 4 cal/0C; 2 cal/g; 5 cal/g.0C a) 400 cal. c) 1000 cal. e) 2000 cal.
0
d) 5 cal/ C; 0,5 cal/g; 10 cal/g C
.0 b) 600 cal. d) 1600 cal.
e) 10 cal/0C; 5 cal/g; 0,25 cal/g.0C 07. Dois corpos, A e B se encontram a uma mesma temperatura
de 10 0C. Cedendo a mesma quantidade de calor a cada corpo
02. O diagrama representa a variação de temperatura de uma obtemos temperaturas diferentes,
0
40 C e 800C,
substância pura em função da quantidade de calor que lhe é respectivamente. Qual será a temperatura de equilíbrio se
fornecida. O calor de vaporização é conhecido e vale 4,0 cal/g. ambos os corpos forem colocados em contato térmico?
As informações obtidas a partir do diagrama permitem calcular o
0
calor específico da substância antes da vaporização (trecho AB) a) 50 C. c) 60 0C. e) 80 0C.
e a sua massa. Os valores encontrados para essas grandezas, b) 52 0C. d) 62 0C.
em cal/g.0C e em gramas, são, respectivamente:
08. Um corpo de massa m a 270 0C é colocado em um
recipiente, onde existe idêntica massa de água a 500C, obtendo-
0
se uma temperatura de equilíbrio igual a 70 C. Admitindo que
somente houve trocas de calor entre o corpo e a água, o calor
específico do corpo, em cal/g 0C, é igual a:
a) 0,010 c) 0,054 e) 0,20
b) 0,030 d) 0,10
09. Um calorímetro ideal de capacidade térmica desprezível
contém 300 g de óleo (c = 0,5 cal/g. 0C). Colocando no interior
a) 0,33 e 200. c) 0,03 e 250. e) 0,05 e 400. desse calorímetro 600g de água (c = 1 cal/g. 0C) a 80 0C, a
0
b) 0,66 e 500. d) 0,84 e 300. temperatura de equilíbrio térmico da mistura passa a ser 75 C.
A temperatura inicial do óleo era:
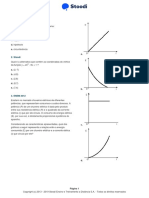
03. O gráfico representa a variação de temperatura de uma
a) 55 0C c) 65 0C e) 75 0C
amostra de 20 g de um líquido, a partir de 0 0C, em função do 0
b) 60 C d) 70 0C
calor por ela absorvido. O calor específico cL do líquido e o seu
calor específico cG na fase gasosa guardam a seguinte relação: 10. Quando 600 g de chumbo (c = 0,0306 cal/g. 0C) a 1000C é
colocado em um calorímetro de alumínio (c = 0,22 cal/g. 0C) de
massa 120 g que contém 200 g de azeite de oliva a 20 0C, a
0
temperatura final da mistura é 30,6 C. O calor específico do
0
azeite, em cal/g. C, é:
a) 0,25 c) 0,47 e) 0,68
b) 0,32 d) 0,55
0
11. A menor massa de água (Calor específico = 1 cal/g C) a 20
0
C que devemos colocar em um recipiente que contém 300 g de
0 0
água a 80 C, para obtermos água a 40 C, é:
a) cL = cG. c) cL = 2. cG. e) n.d.a. a) 200g c) 400g e) 600g
b) cL = cG/2. d) cL = 2. cG/3 b) 300g d) 500g
04. A quantidade de calor que um bloco de gelo (água no estado Gabarito
sólido), inicialmente a –40 0C recebe para chegar a ser vapor a 01. e 03. b 05. e 07. b 09. a 11. e
02. c 04. d 06. a 08. d 10. c
120 0C é dada pelo gráfico abaixo.
Fale conosco www.portalimpacto.com.br
Вам также может понравиться
- ADE - Matemática - 3 Série Do Ensino MédioДокумент11 страницADE - Matemática - 3 Série Do Ensino MédioCoordenação Allyrio BrasilОценок пока нет
- Ficha Prática Nº5 - Matrizes - Sistemas de Equações Lineares - DeterminantesДокумент5 страницFicha Prática Nº5 - Matrizes - Sistemas de Equações Lineares - DeterminantesPeRe9Оценок пока нет
- Dilatação Térmica de Sólidos e LíquidosДокумент28 страницDilatação Térmica de Sólidos e LíquidosLuiz Carlos da RochaОценок пока нет
- Exercícios Polias 1Документ1 страницаExercícios Polias 1Adicleison Vela SilvaОценок пока нет
- Fisica - PSCII - CalorimetriaДокумент6 страницFisica - PSCII - CalorimetriaRaquel Filippi de SouzaОценок пока нет
- Exercícios - 2023 - Hidrostática 2Документ12 страницExercícios - 2023 - Hidrostática 2guinsrburnsОценок пока нет
- Conservação de Escalas TermométricasДокумент10 страницConservação de Escalas TermométricasNessa SoaresОценок пока нет
- Aula 1 Transcal 2 PDFДокумент57 страницAula 1 Transcal 2 PDFCaroline AlvesОценок пока нет
- Lista de Exercicios CalorimetriaДокумент4 страницыLista de Exercicios CalorimetriaRafaela TatianeОценок пока нет
- Lista de Exercícios 58 - ConeДокумент2 страницыLista de Exercícios 58 - ConeJose CohenОценок пока нет
- Lista de DilataçãoДокумент19 страницLista de DilataçãoWeslley Alves0% (1)
- Lista CalorimetriaДокумент1 страницаLista CalorimetriaFelipe Castilho de SouzaОценок пока нет
- Calorimetria QuestõesДокумент7 страницCalorimetria QuestõesAlex AquinoОценок пока нет
- Termologia, CALORIMETRIAДокумент23 страницыTermologia, CALORIMETRIAReginaldo CoelhoОценок пока нет
- Exercícios de Fixação - 2º AnoДокумент2 страницыExercícios de Fixação - 2º AnoIgor Maciel100% (1)
- Exercicios GasesДокумент4 страницыExercicios GasesManuela Sampaio0% (1)
- Questões Queda Livre e Lançamento VerticalДокумент1 страницаQuestões Queda Livre e Lançamento VerticalRebeca CristinaОценок пока нет
- Apostila de Física - 1 SérieДокумент17 страницApostila de Física - 1 SérieFelipe R. BuenoОценок пока нет
- Aula 6 - Quantidade de Calor Sensível Quantidade de Calor Latente e Propagação de CalorДокумент7 страницAula 6 - Quantidade de Calor Sensível Quantidade de Calor Latente e Propagação de CalorMateus SouzaОценок пока нет
- Atividades Complementares - 8º AnosДокумент2 страницыAtividades Complementares - 8º AnosAlessandraBaldanzaОценок пока нет
- Aula 34 - 9º Ano Aula ParanáДокумент22 страницыAula 34 - 9º Ano Aula ParanáAna Paula FerreiraОценок пока нет
- Lista Exercícios - Dilatação Térmica de Sólidos e Líquidos 02-1CДокумент2 страницыLista Exercícios - Dilatação Térmica de Sólidos e Líquidos 02-1CElson GuerraОценок пока нет
- Eletroquimica - Rumo Ao ITAДокумент3 страницыEletroquimica - Rumo Ao ITAAgenor NobregaОценок пока нет
- GABProf Walter Tadeu Conicas Aula 272016Документ6 страницGABProf Walter Tadeu Conicas Aula 272016Márcio BezerraОценок пока нет
- Exercícios de TermologiaДокумент21 страницаExercícios de TermologiaMarcio AndreiОценок пока нет
- Pressão Hidrostatica - ExerciciosДокумент4 страницыPressão Hidrostatica - ExerciciosWagner SindiciОценок пока нет
- LisExtExponenciais EM3 MatemДокумент3 страницыLisExtExponenciais EM3 MatemjeizzzonОценок пока нет
- Calor Sensível 9º Ano Panosso 2013Документ2 страницыCalor Sensível 9º Ano Panosso 2013Ananda FreitasОценок пока нет
- Ebook Exatas - Semana 5 PDFДокумент229 страницEbook Exatas - Semana 5 PDFadasdaОценок пока нет
- Posições Relativas de Duas Retas No Plano CartesianoДокумент3 страницыPosições Relativas de Duas Retas No Plano CartesianoAlessandra Duarte PeixotoОценок пока нет
- Atividades - Nivelamento - 9º Ano - Teorema de TalesДокумент1 страницаAtividades - Nivelamento - 9º Ano - Teorema de TalesCARLOS ROBERTO RODRIGUESОценок пока нет
- Calorimetria Lista de Exercícios 01Документ6 страницCalorimetria Lista de Exercícios 01AlbertoAlecioОценок пока нет
- Atividade Extra 4Документ6 страницAtividade Extra 4David PinheiroОценок пока нет
- Pr5ova Calor Sensivel e LatenteДокумент8 страницPr5ova Calor Sensivel e LatenteMarcia Cristina100% (1)
- Fisca Parte1 ExДокумент19 страницFisca Parte1 ExIsmael Teixeira100% (1)
- Grandezas Proporcionais 2021Документ2 страницыGrandezas Proporcionais 2021Felipe RossettoОценок пока нет
- Lei de FourierДокумент2 страницыLei de FourierBruna Borges LealОценок пока нет
- Dilatação Térmica SolidosДокумент3 страницыDilatação Térmica SolidosDiogo CavalcanteОценок пока нет
- Angulos Do TriânguloДокумент4 страницыAngulos Do TriânguloMônica MarraОценок пока нет
- Fisica 2 Exercicios Gabarito 03Документ3 страницыFisica 2 Exercicios Gabarito 03comentadaОценок пока нет
- Círculo e Circunferência - Volume Quarenta CincoДокумент44 страницыCírculo e Circunferência - Volume Quarenta CincoLeonardoSantosОценок пока нет
- Regra de Tres No ENEM PDFДокумент13 страницRegra de Tres No ENEM PDFMarcelo Renato Moreira BaptistaОценок пока нет
- Exercícios CalorimetriaДокумент4 страницыExercícios CalorimetriaMarcelo Barros Villa0% (1)
- Aula 14 Fórmulas de Adição e Subtração de Arcos Exercícios PDFДокумент12 страницAula 14 Fórmulas de Adição e Subtração de Arcos Exercícios PDFDavi AraujoОценок пока нет
- Lista de Exercícios Trigonometria - 2 AnoДокумент2 страницыLista de Exercícios Trigonometria - 2 Anoandresaa_duarteОценок пока нет
- Exercicios Dilatação TérmicaДокумент6 страницExercicios Dilatação TérmicamnlsatОценок пока нет
- AULA 8 Grandezas ProporcionaisДокумент2 страницыAULA 8 Grandezas ProporcionaisMarricia da SharedrОценок пока нет
- Trigonometria Na CircunferênciaДокумент7 страницTrigonometria Na Circunferênciasidney_lanesОценок пока нет
- Aula 04 - Dinâmica de Corpos Rígidos - Parte 1 - TranslaçãoДокумент16 страницAula 04 - Dinâmica de Corpos Rígidos - Parte 1 - TranslaçãoMatheus Gama FonsecaОценок пока нет
- Exercciossobreteoremadetalesesemelhanadetringulos 100919120052 Phpapp02Документ0 страницExercciossobreteoremadetalesesemelhanadetringulos 100919120052 Phpapp02Shirley VianaОценок пока нет
- Lista 8 Progressão GeométricaДокумент4 страницыLista 8 Progressão GeométricaVinicius GonçalvesОценок пока нет
- Função QuadráticaДокумент8 страницFunção QuadráticaAlessandra Duarte PeixotoОценок пока нет
- Dilatação de Líquidos PDFДокумент3 страницыDilatação de Líquidos PDFforte2014Оценок пока нет
- Sistemas de Equaes Adio Substituio CramerДокумент9 страницSistemas de Equaes Adio Substituio CramerKauany BetimОценок пока нет
- Retas Paralelas e Transversais 8 Ano362011162112Документ4 страницыRetas Paralelas e Transversais 8 Ano362011162112Isadora AlmeidaОценок пока нет
- Experimento Da Rampa Com Sensor de TempoДокумент12 страницExperimento Da Rampa Com Sensor de TempoAlice EduardaОценок пока нет
- Dilatação TérmicaДокумент3 страницыDilatação TérmicaItalo Marinho100% (1)
- Apostila de CalorimetriaДокумент13 страницApostila de CalorimetriaJosé SobralОценок пока нет
- Cópia de Simulado ESA EquacionaДокумент4 страницыCópia de Simulado ESA EquacionaAndrey FerreiraОценок пока нет
- Nova ListaДокумент9 страницNova ListaNuricel Villalonga AguileraОценок пока нет
- Prova MagДокумент3 страницыProva MagNuricel Villalonga AguileraОценок пока нет
- Mapa Da EmpatiaДокумент3 страницыMapa Da EmpatiaNuricel Villalonga AguileraОценок пока нет
- 100 Instructive Calculus-Based Physics Examples - The Laws of Motion (Calculus-Based Physics Problems With Solutions) (English Edition) - Ebooks em Inglês NaДокумент5 страниц100 Instructive Calculus-Based Physics Examples - The Laws of Motion (Calculus-Based Physics Problems With Solutions) (English Edition) - Ebooks em Inglês NaNuricel Villalonga AguileraОценок пока нет
- CALORIMETRIAДокумент5 страницCALORIMETRIANuricel Villalonga AguileraОценок пока нет
- Lista de Reforço - Calorimetris 1Документ3 страницыLista de Reforço - Calorimetris 1Nuricel Villalonga AguileraОценок пока нет
- 008 Fisica CalorimetriaДокумент8 страниц008 Fisica CalorimetriaCostaОценок пока нет
- Ondulatória 2Документ10 страницOndulatória 2Nuricel Villalonga AguileraОценок пока нет
- Apostila de Biologia - Impacto PDFДокумент47 страницApostila de Biologia - Impacto PDFNuricel Villalonga AguileraОценок пока нет
- Eurekao 1 17 1998 2013Документ2 425 страницEurekao 1 17 1998 2013Nuricel Villalonga Aguilera100% (1)
- Transmissão de Calor - NoiteДокумент3 страницыTransmissão de Calor - NoiteNuricel Villalonga AguileraОценок пока нет
- VectocardiografíaДокумент7 страницVectocardiografíaJose Rodrigues JuniorОценок пока нет
- I CZC - Livro Do Evento - 2016-With-Cover-Page-V2Документ232 страницыI CZC - Livro Do Evento - 2016-With-Cover-Page-V2Joao FelipeОценок пока нет
- Apostila Vida A DoisДокумент21 страницаApostila Vida A DoisAlex PessoaОценок пока нет
- P.O.P - Rotinas de Limpeza e HigienizaçãoДокумент4 страницыP.O.P - Rotinas de Limpeza e HigienizaçãoLar VicentinoОценок пока нет
- Cap. 04 - Geometria, Ideias Intuitivas.Документ3 страницыCap. 04 - Geometria, Ideias Intuitivas.Douglas OliveiraОценок пока нет
- Leia A Parlenda E Depois Responda À Questão: Com Qual Palavra Rima VeludoДокумент10 страницLeia A Parlenda E Depois Responda À Questão: Com Qual Palavra Rima VeludoWellington SantanaОценок пока нет
- Hipnose Na Prática - Um Guia Com Tudo Que Você Precisa SaberДокумент15 страницHipnose Na Prática - Um Guia Com Tudo Que Você Precisa SaberCleide Helena MacedoОценок пока нет
- Renovaçoes 2022.jan DezДокумент390 страницRenovaçoes 2022.jan DezCamilla DinizОценок пока нет
- Eguns - Ancestralidade e ContinuidadeДокумент5 страницEguns - Ancestralidade e ContinuidadeRac A BruxaОценок пока нет
- Manual Do Aluno IPMIL Versao 2Документ52 страницыManual Do Aluno IPMIL Versao 2Manuela EspinosaОценок пока нет
- Lista de Exercícios - 22 - 10 - 22 UNIVERSALДокумент2 страницыLista de Exercícios - 22 - 10 - 22 UNIVERSALgiselle_azevedo29Оценок пока нет
- Porque Emigram Os PortuguesesДокумент3 страницыPorque Emigram Os Portuguesesceliaestrada100% (1)
- DissertaçãoДокумент111 страницDissertaçãoJM SSОценок пока нет
- Planilha Orçamentária Da ObraДокумент2 страницыPlanilha Orçamentária Da ObraRoberval TelesОценок пока нет
- 50 Tons de Esperar em DeusДокумент3 страницы50 Tons de Esperar em DeusPaulo Henrique Brandão100% (1)
- 9.3 - Ergonomia e Prevenção de AcidentesДокумент4 страницы9.3 - Ergonomia e Prevenção de AcidentesFrancisco FrançaОценок пока нет
- Lancamento Horizontal Dos CorposДокумент12 страницLancamento Horizontal Dos CorposIbraimo Rui Esmael EsmaelОценок пока нет
- Esqueleto-Apendicular Com Imagens para FixaçaoДокумент23 страницыEsqueleto-Apendicular Com Imagens para FixaçaoRosangela FonsecaОценок пока нет
- Apostila de Jogos para SRMДокумент107 страницApostila de Jogos para SRMHenrique J Reis BezerraОценок пока нет
- Anexo VI - Datasheet Módulo Jinko JKM530M-72HL4-TVДокумент1 страницаAnexo VI - Datasheet Módulo Jinko JKM530M-72HL4-TVfernandoОценок пока нет
- Revisão 9ano 3triДокумент4 страницыRevisão 9ano 3trieduarda.cavalcantigsОценок пока нет
- Decreto #9785 de 7 de Maio de 2019Документ27 страницDecreto #9785 de 7 de Maio de 2019nelson during100% (3)
- MCA-P - Manual de ServiçoДокумент13 страницMCA-P - Manual de Serviçocbbrunocesar1989Оценок пока нет
- Vitrine Tupperware 1.2017Документ68 страницVitrine Tupperware 1.2017Tupperware ShowОценок пока нет
- Guião - ENPL 2014Документ1 страницаGuião - ENPL 2014daniel95sousaОценок пока нет
- Modulo2 - Modulo de Resistencia A FlexaoДокумент13 страницModulo2 - Modulo de Resistencia A FlexaoJéssika PauloОценок пока нет
- Elaborar Prova ContextualizadaДокумент16 страницElaborar Prova ContextualizadaAna LouОценок пока нет
- Resina NanoparticuladaДокумент7 страницResina NanoparticuladaWellington ReisОценок пока нет
- Manual de ProjetosДокумент226 страницManual de ProjetosbetobragajrОценок пока нет