Академический Документы
Профессиональный Документы
Культура Документы
BAC S 2018 SUJET Physique Chimie Obli
Загружено:
LETUDIANTАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
BAC S 2018 SUJET Physique Chimie Obli
Загружено:
LETUDIANTАвторское право:
Доступные форматы
BACCALAURÉAT GÉNÉRAL
SESSION 2018
______
PHYSIQUE-CHIMIE
Jeudi 21 juin 2018
Série S
____
DURÉE DE L’ÉPREUVE : 3 h 30 – COEFFICIENT : 6
______
L'usage de tout modèle de calculatrice, avec ou sans mode examen, est autorisé.
Ce sujet ne nécessite pas de feuille de papier millimétré.
Ce sujet comporte trois exercices présentés sur 8 pages numérotées de 1 à 8 y compris
celle-ci.
Le candidat doit traiter les trois exercices qui sont indépendants les uns des autres.
18PYSCOMLR1 Page : 1/8
EXERCICE I - VITAMINE C (4 points)
L'acide ascorbique, communément appelé vitamine C, est un antioxydant présent dans de
nombreux fruits et légumes. Une carence prolongée en vitamine C provoque une maladie
appelée scorbut. En pharmacie, il est possible de trouver l'acide ascorbique, sous forme de
comprimés de vitamine C 500, chacun contenant 500 mg de vitamine C.
L’objectif de l’exercice est d’étudier une voie de synthèse industrielle de l’acide ascorbique
puis de vérifier la valeur de la masse d’acide ascorbique contenue dans un comprimé.
Données :
données de spectroscopie infrarouge :
-1
Liaison Nombre d’onde (cm ) Caractéristiques de la bande d’absorption
O – H alcool 3200 - 3700 forte, large
O – H acide
2500 - 3200 forte à moyenne, large
carboxylique
C–H 2800 - 3100 forte ou moyenne
C=O 1650 - 1740 forte
-1
masse molaire moléculaire de la vitamine C : M(acide ascorbique) = 176 g.mol .
1. Synthèse industrielle de l’acide ascorbique
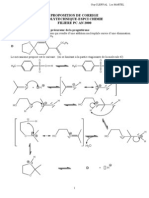
L’acide ascorbique est synthétisé industriellement à partir du D - Glucose. La synthèse selon le procédé
Reichstein se déroule en plusieurs étapes ; un schéma réactionnel simplifié est décrit ci-dessous.
Étape 1 : Étape 2 :
Une oxydation du D - Sorbitol produit le composé (E) de
HO HO formule topologique :
HO
HO HO O
OH OH O
HO
+ H2
HO OH
OH OH HO
OH
O OH
D - Glucose D - Sorbitol OH
Composé (E)
Étape 3 :
HO
O HO
OH
O
OH O + Y
HO O
OH
OH
OH
OH
Composé (E) Acide ascorbique
C 6H 8O 6
1.1. Étape 1 de la synthèse.
1.1.1. Le passage du D - Glucose au D - Sorbitol correspond-il à une modification de chaîne ou de
groupe caractéristique ?
1.1.2. Donner le nom de la catégorie de réaction. Justifier.
18PYSCOMLR1 Page : 2/8
1.2. Étape 3 de la synthèse.
1.2.1. Écrire la formule brute du composé (E).
1.2.2. Identifier l’espèce chimique Y et la nommer.
1.3. Le déroulement de la synthèse peut être contrôlé par spectroscopie infrarouge. Attribuer les spectres A
et B fournis ci-dessous au D - Sorbitol et à l’acide ascorbique. Justifier.
Spectre A Spectre B
2. Titrage de l’acide ascorbique contenu dans un comprimé de vitamine C 500.
On souhaite vérifier l’indication « vitamine C 500 » figurant sur le tube de comprimés.
Pour cela, on dissout un comprimé de vitamine C dans de l’eau distillée afin d’obtenir 100,0 mL de
solution S. On prélève un volume de 10,0 mL de cette solution S que l'on dose par une solution aqueuse
+ - -2 -1
d'hydroxyde de sodium (Na (aq) + HO (aq)) de concentration molaire égale à 2,00 × 10 mol.L . Le titrage
est suivi par pH-métrie (figure 1).
L’équation de la réaction support du titrage est la suivante :
- -
C6H8O6 (aq) + HO (aq) → C6H7O6 (aq) + H2O
pH
12
10
0 VB (mL)
0 5 10 15 20 25 30
Figure 1. Titrage de l’acide ascorbique : évolution du pH en fonction du
volume VB de solution d’hydroxyde de sodium ajouté
2.1. Réaliser un schéma légendé du dispositif expérimental utilisé pour réaliser le titrage.
2.2. Justifier que la réaction support du titrage est une réaction acido-basique.
2.3. Déterminer la concentration molaire en acide ascorbique dans la solution S.
2.4. En déduire la masse m de vitamine C contenue dans un comprimé. Comparer la valeur obtenue à
l'indication donnée par le fabricant. Proposer deux sources d’erreurs possibles, liées à la mise en œuvre du
titrage, pouvant expliquer l’écart observé.
18PYSCOMLR1 Page : 3/8
EXERCICE II - SERVICE ET RÉCEPTION AU VOLLEY-BALL (11 points)
Au volley-ball, le service smashé est le type de service pratiqué le plus fréquemment par
les professionnels : le serveur doit se placer un peu après la limite du terrain, lancer très
haut son ballon, effectuer une petite course d'élan puis sauter pour frapper la balle.
D’après : https://fr.wikipedia.org/wiki/Volley-ball
Après la course d’élan, le serveur saute de façon à frapper le ballon en un point B0 situé à
la hauteur h au-dessus de la ligne de fond de terrain. La hauteur h désigne alors l’altitude
initiale du centre du ballon. Le vecteur vitesse initiale ���⃗ v0 du ballon est horizontal et
perpendiculaire à la ligne de fond du terrain (voir figure 1.).
Le mouvement du ballon est étudié dans le référentiel terrestre supposé galiléen muni du
repère (Ox, Oy) et l’instant de la frappe est choisi comme origine des temps : t = 0 s.
Le mouvement a lieu dans le plan (Oxy). Source : FIVB 2012
y Filet
Ligne de fond
B0 ���⃗
v0
H = 2,4 m
h = 3,5 m
O x
Ligne de fond l = 9,0 m
L = 18,0 m
Figure 1. Dimensions du terrain de volley-ball et allure de la trajectoire du ballon.
Le but de cet exercice est de déterminer la valeur de la vitesse initiale du ballon, de vérifier la validité du
service et d’étudier la réception du service par un joueur de l’équipe adverse. Pour cela, on étudie le
mouvement du centre du ballon sans tenir compte de l’action de l’air, de la rotation du ballon sur lui-même et
de ses déformations.
Données :
le ballon de volley-ball a une masse m = 260 g et un rayon r = 10 cm ;
-2
intensité du champ de pesanteur : g = 9,81 m.s ;
la valeur de la célérité c de la lumière dans le vide ou dans l’air est supposée connue du candidat ;
domaines des ondes électromagnétiques en fonction de la longueur d’onde λ :
micro- ondes
rayons γ rayons X UV visible IR ondes radio
10
-12
m
-8
10 m
-3
10 m 1m λ
18PYSCOMLR1 Page : 4/8
1. Mesure de la vitesse initiale du ballon
Afin d’évaluer les performances du serveur, on mesure la valeur de la
vitesse initiale v0 du ballon grâce à un radar portatif (voir figure 2.), que
l’on pointe en direction de la position de frappe B0.
Le manuel du radar portatif indique que celui-ci envoie des ondes
10
électromagnétiques haute fréquence (3,47 × 10 Hz) et mesure la
différence de fréquence entre l’onde émise et l’onde réfléchie sur un objet
en mouvement.
Figure 2. Radar portatif utilisé
lors de la mesure de la vitesse
-1
(indiquée en km.h ).
1.1. Identifier le domaine des ondes électromagnétiques émises par ce radar portatif. Justifier par un calcul.
1.2. Nommer le phénomène à l’origine de la différence de fréquence entre les ondes émise et reçue par le
radar portatif.
1.3. Le radar portatif est positionné face au serveur et vise le ballon. La fréquence de l’onde reçue est-elle
inférieure ou supérieure à celle de l’onde émise ? Justifier.
1.4. Dans les mêmes conditions de mesure que pour la question 1.3, le décalage Δf entre la fréquence fémise
de l’onde émise et la fréquence freçue de l’onde reçue vérifie la relation :
2v0 . fémise
|Δf|=�freçue - fémise �=
c
Le décalage |Δf| mesuré par le radar portatif est de 4,86 kHz.
En déduire la valeur de la vitesse du ballon. Vérifier l’accord avec l’indication de l’écran du radar portatif de
la figure 2.
2. Validité du service
-1
Le service est effectué depuis le point B0 à la vitesse v0 = 21,0 m.s . Le service sera considéré comme
valide à condition que le ballon franchisse le filet sans le toucher et qu’il retombe dans le terrain adverse.
2.1. Montrer que, si on néglige l’action de l’air, les coordonnées du vecteur accélération du centre du ballon
après la frappe sont :
ax(t) = 0 et ay(t) = −g
2.2. Établir que les équations horaires du mouvement du centre du ballon s’écrivent :
gt 2
x(t)= v0 t et y(t) = − +h
2
En déduire que l’équation de la trajectoire reliant x et y s’écrit :
g
y(x)= − 2 x2 + h
2v0
2.3. En admettant que le ballon franchisse le filet, vérifier qu’il touche le sol avant la ligne de fond.
18PYSCOMLR1 Page : 5/8
2.4. Afin de déterminer la vitesse du ballon au moment où il touche le sol, on effectue une étude
énergétique. L’origine de l’énergie potentielle de pesanteur est choisie de la manière suivante : Epp = 0 J
pour y = 0 m.
2.4.1. Rappeler les expressions littérales des énergies cinétique Ec, potentielle de pesanteur Epp et
mécanique Em du ballon en un point quelconque de la trajectoire.
2.4.2. Le graphe de la figure 3 représente l’évolution en fonction du temps des trois énergies
précédentes. Associer chaque courbe 1, 2, 3 à l’une des trois énergies Em, Epp, Ec. Justifier.
Em Ec Epp courbe 3
courbe 2
courbe 1
0 t
Figure 3. Allure de l’évolution des énergies du ballon au cours du temps.
2.4.3. À l’aide de l’étude énergétique précédente, déterminer la valeur de la vitesse du centre du
ballon vsol lorsque le ballon touche le sol.
2.5. En réalité, la vitesse vsol avec laquelle le ballon atteint le sol est plus faible que celle déterminée à la
question 2.4.3. Proposer une explication.
3. Réception du ballon par un joueur de l’équipe adverse
Au moment où le serveur frappe le ballon
(t = 0 s), un joueur de l’équipe adverse est placé
au niveau de la ligne de fond de son terrain. Il
débute sa course vers l’avant pour réceptionner
le ballon en réalisant une « manchette » comme
le montre la figure 4.
Le contact entre le ballon et le joueur se fait au
point R situé à une hauteur de 80 cm au-dessus
du sol.
Figure 4. Réception du ballon.
D’après : http://lesportdauphinois.com
On admet que les équations horaires du mouvement du ballon établies à la question 2.2. restent valables.
Évaluer la vitesse moyenne minimale du déplacement de ce joueur pour qu’il réalise la réception dans la
position photographiée ci-dessus. Ce résultat semble-t-il réaliste ?
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti.
La démarche suivie est évaluée et nécessite donc d’être correctement présentée.
18PYSCOMLR1 Page : 6/8
EXERCICE III - CRÈME ANESTHÉSIANTE (5 points)
Certains actes médicaux sont douloureux ; le confort du patient peut être amélioré par une anesthésie
locale.
L’objectif de cet exercice est d’étudier la synthèse d’un anesthésiant, la lidocaïne, et quelques
caractéristiques d’une crème anesthésiante contenant ce principe actif.
Données :
-1
masse molaire moléculaire de la lidocaïne : 234,3 g.mol ;
le rendement usuel de la synthèse de la lidocaïne est supérieur à 70 % ;
-3
masse volumique de la crème anesthésiante : ρc = 1,0 g.cm .
1. Étude de la molécule de lidocaïne
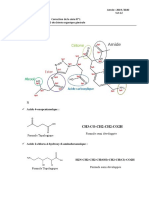
Formules topologiques de la lidocaïne Formule semi-développée simplifiée de la lidocaïne
Formule topologique complète (formule 1)
O
(formule 3)
N
NH CH3
O H2C
R C N CH3
Formule topologique simplifiée (formule 2) NH CH2 CH2
O R est un groupement d’atomes
R N
NH
R est un groupement d’atomes
1.1. Recopier, sur la copie, la formule topologique simplifiée de la molécule de lidocaïne (formule 2),
entourer les groupes caractéristiques et nommer les familles chimiques correspondantes.
Le tableau ci-dessous résume certaines informations contenues dans le spectre de RMN du proton de la
lidocaïne. Les protons du groupement d’atomes R ne sont pas pris en compte.
Déplacement
Multiplicité des signaux
chimique
δ = 1,1 ppm triplet
δ = 2,7 ppm quadruplet
δ = 3,2 ppm singulet
δ = 8,9 ppm singulet
D’après : National Institute of Advance Industrial Science and Technology – http://sdbs.db.aist.go.jp
1.2. Recopier, sur la copie, la formule semi-développée simplifiée de la molécule de lidocaïne (formule 3).
Identifier sur cette formule le(s) groupe(s) de protons équivalents correspondant au quadruplet situé à
2,7 ppm et ceux correspondant au triplet situé à 1,1 ppm sur le spectre de RMN. Justifier.
18PYSCOMLR1 Page : 7/8
2. Synthèse de la lidocaïne
L’équation de la réaction de synthèse de la lidocaïne est la suivante :
O O
R Cl R N +
H2N -
NH + 2 HN → NH + + Cl
A diéthylamine lidocaïne (L) chlorure de
diéthylammonium
Protocole expérimental de la synthèse :
-2
• Étape 1 : introduire 6,0 g (3,0 × 10 mol) de N-(2,6-diméthylphényl)chloroacétamide, noté A, dans
-1
un ballon de 250 mL. Ajouter 60 mL de toluène (solvant) et 15 mL (1,5 × 10 mol) de diéthylamine
puis chauffer à reflux sous agitation pendant 1 h 30 min.
• Étape 2 : après élimination de la diéthylamine restante et du chlorure de diéthylammonium formé du
mélange réactionnel, traiter le milieu restant par ajout de 30 mL d’une solution aqueuse d’acide
chlorhydrique concentré. À l’aide d’une ampoule à décanter, récupérer la phase aqueuse qui
renferme la forme acide associée à la lidocaïne synthétisée.
• Étape 3 : faire précipiter la lidocaïne à l’aide d’une solution d’hydroxyde de sodium.
• Étape 4 : après filtration et séchage, on obtient une masse de lidocaïne mL = 5,6 g.
2.1. Mise en œuvre du protocole expérimental
2.1.1. Indiquer l’intérêt du chauffage à reflux utilisé dans l’étape 1.
2.1.2. Vérifier que le réactif A est le réactif limitant du protocole mis en œuvre.
2.1.3. Déterminer la valeur du rendement de la synthèse effectuée. Commenter.
2.2. Mécanisme réactionnel de la synthèse
Première étape du mécanisme de la synthèse de la lidocaïne :
O (2) O
+
R Cl R NH
HN NH -
NH + → + Cl
(1)
2.2.1. Que représentent les flèches courbes figurant sur cette première étape du mécanisme ?
2.2.2. Identifier le site accepteur et le site donneur associés à la flèche (1).
3. Étude d’une crème anesthésiante
La crème étudiée contient 2,5 % en masse de lidocaïne.
Lorsque la crème est appliquée sur la peau, les principes actifs diffusent à travers les couches de la peau
-7 2
avant d’atteindre des terminaisons nerveuses. On admet qu’une quantité de 10 mol de lidocaïne par cm
de peau est suffisante pour l’anesthésie. L’épaisseur de crème généralement appliquée sur la peau est de
l’ordre de 1 mm.
-4
3.1. Vérifier que la quantité de matière de lidocaïne dans la crème étudiée est égale à 1,1 × 10 mol par
centimètre cube de crème.
2
3.2. Montrer qu’une épaisseur de 0,1 mm de crème anesthésiante sur une zone de 1 cm de peau est
suffisante pour anesthésier cette zone.
18PYSCOMLR1 Page : 8/8
Вам также может понравиться
- TD OsesДокумент11 страницTD OsesDEMBA SYLLAОценок пока нет
- PARTIE 1. Biochimie Métabolique (Enregistré Automatiquement) - 1Документ42 страницыPARTIE 1. Biochimie Métabolique (Enregistré Automatiquement) - 1beauty queensОценок пока нет
- U7orgaanacs2 02Документ3 страницыU7orgaanacs2 02Daniel NdОценок пока нет
- Serie de TD ChimieДокумент5 страницSerie de TD Chimieraouf teach 04Оценок пока нет
- Quelques Composés OxygénésДокумент6 страницQuelques Composés OxygénésXray34Оценок пока нет
- Examen 20141 SДокумент7 страницExamen 20141 SElbachaОценок пока нет
- Série 2 Oxydo RéductionДокумент8 страницSérie 2 Oxydo RéductionSection E GPОценок пока нет
- Chimie Organique Fonctionnelle TD Corr 01Документ2 страницыChimie Organique Fonctionnelle TD Corr 01123456789Оценок пока нет
- 2010 CtresEtrang Exo1 Correction Ester Fraise 2 5ptsДокумент1 страница2010 CtresEtrang Exo1 Correction Ester Fraise 2 5ptsla physique selon le programme FrançaisОценок пока нет
- TDДокумент10 страницTDam47Оценок пока нет
- TD Effets Electroniques 8 - SolutionДокумент5 страницTD Effets Electroniques 8 - SolutionDenisco NkemgneОценок пока нет
- BAC STL 2018 Specialité Biotechnologies Sujet Physique ChimieДокумент11 страницBAC STL 2018 Specialité Biotechnologies Sujet Physique ChimieLETUDIANTОценок пока нет
- 2009 Lyon Walchshofer Carbonyles CoursДокумент30 страниц2009 Lyon Walchshofer Carbonyles CoursPride Algerian ツОценок пока нет
- Chimie Organique Fonctionnelle TD Corr 08Документ3 страницыChimie Organique Fonctionnelle TD Corr 08Kouadio Franck Tomasino KouameОценок пока нет
- TD1 S3 SMP 2020Документ4 страницыTD1 S3 SMP 2020Al Hiani AnasОценок пока нет
- EXAMEN 1 CORRIGéДокумент3 страницыEXAMEN 1 CORRIGéSOUFYANE MUSTAPA100% (1)
- TD 1 Glucides 2021Документ1 страницаTD 1 Glucides 2021ECHAIB ibtissam100% (1)
- Emd 1 de Chimie Première Année Médecine Et Médecine DentaireДокумент3 страницыEmd 1 de Chimie Première Année Médecine Et Médecine Dentaireσεφ ΙσλάμОценок пока нет
- 1.2.1-Exercices OsesДокумент1 страница1.2.1-Exercices OsesLy Dia100% (1)
- TD-chimie OrgaДокумент21 страницаTD-chimie OrgaJean AnanОценок пока нет
- TD de Biochimie 2023Документ2 страницыTD de Biochimie 2023Jeance BERTHYОценок пока нет
- ImmuniteДокумент26 страницImmuniteEl Farouk100% (1)
- TD-1 GlucidesДокумент2 страницыTD-1 GlucidesNouhaila darkОценок пока нет
- P39oxbenzoine PersaДокумент8 страницP39oxbenzoine Persaayoub dahbi0% (1)
- BAC STL Bio Physique SUJETДокумент12 страницBAC STL Bio Physique SUJETLETUDIANTОценок пока нет
- Corrigé Contro Continu Chimie 4 2019Документ2 страницыCorrigé Contro Continu Chimie 4 2019evilievОценок пока нет
- Solvants en Chimie OrganiqueДокумент3 страницыSolvants en Chimie OrganiqueMvone100% (2)
- C 00 XP 1 CДокумент13 страницC 00 XP 1 CMihnea GamanОценок пока нет
- SMC4 Examen Juin 2013Документ5 страницSMC4 Examen Juin 2013Yc YacineОценок пока нет
- S6 Hoc TD4 2020Документ2 страницыS6 Hoc TD4 2020donaldОценок пока нет
- Test 1 Corrige 5Документ1 страницаTest 1 Corrige 5ANONYME179Оценок пока нет
- Chap2 Aldéhydes Et CétonesДокумент34 страницыChap2 Aldéhydes Et CétonesEssemlali Abde SamadОценок пока нет
- Chapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESДокумент5 страницChapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESanwar jakriОценок пока нет
- 0 C 40 F 13 A 769 Aef 3 Ca 505Документ4 страницы0 C 40 F 13 A 769 Aef 3 Ca 505api-497754935Оценок пока нет
- Chap.3 ProtéineДокумент46 страницChap.3 ProtéineIngenieur AgroОценок пока нет
- 4 Stereochimie 1Документ17 страниц4 Stereochimie 1Ioana NicolaeОценок пока нет
- Serie 3 PDFДокумент2 страницыSerie 3 PDFElbahi Djaalab0% (2)
- Nomenclature Des Composés OrganiquesДокумент16 страницNomenclature Des Composés OrganiquesRuroniОценок пока нет
- Série N°1-CorrigéeДокумент9 страницSérie N°1-CorrigéeZineb DahmaniОценок пока нет
- Exercice INTI ReponseДокумент4 страницыExercice INTI Reponseyazid haidarani0% (1)
- 4ème Dimanche Carême Année BДокумент2 страницы4ème Dimanche Carême Année BNsangwaОценок пока нет
- 5 1a Correction ConformationДокумент4 страницы5 1a Correction ConformationKenson DEROSANОценок пока нет
- Lip IdesДокумент17 страницLip IdesAhmed100% (1)
- Exo 54 - Dosage Acide Benzoique CДокумент3 страницыExo 54 - Dosage Acide Benzoique CAnis DahnenОценок пока нет
- Alcools CoursДокумент6 страницAlcools CoursOuedraogo Harouna100% (1)
- Correction Série 2 Thermo SMC-S4 2020cДокумент7 страницCorrection Série 2 Thermo SMC-S4 2020cMohamed CHIBANОценок пока нет
- Chimie Analytique (CH1)Документ43 страницыChimie Analytique (CH1)Jaafar ChirigОценок пока нет
- Série-3-Corrigée Chimie4Документ15 страницSérie-3-Corrigée Chimie4poly educationОценок пока нет
- CH Org TD 7Документ8 страницCH Org TD 7Mohammed El Kacem KadraouiОценок пока нет
- Les QCMs de TahsinДокумент11 страницLes QCMs de TahsinmenzoulsemiaОценок пока нет
- Corrigé de Examen Final OrganiqueДокумент2 страницыCorrigé de Examen Final OrganiqueRedOne DerrouazinОценок пока нет
- UntitledДокумент3 страницыUntitledAbdeldjalil MayacheОценок пока нет
- TD 1Документ4 страницыTD 1Abdou HajjajiОценок пока нет
- Série 2 Isomérie 2020-2021Документ3 страницыSérie 2 Isomérie 2020-2021Ayoub HmОценок пока нет
- Cours IsomerieДокумент11 страницCours IsomerieJean-François Abena100% (1)
- S Physique Chimie Obligatoire 2018 Metropole Sujet OfficielДокумент8 страницS Physique Chimie Obligatoire 2018 Metropole Sujet OfficielRudyОценок пока нет
- 2018 Metro Exo1 Sujet VitamineC 4ptsДокумент2 страницы2018 Metro Exo1 Sujet VitamineC 4ptsTessyОценок пока нет
- 2007 NelleCaledo Exo3 Sujet Aspirine 4ptsДокумент3 страницы2007 NelleCaledo Exo3 Sujet Aspirine 4ptsLįfë John'sОценок пока нет
- Activité 4 IbuprofèneДокумент4 страницыActivité 4 IbuprofèneDiego Alves SilvaОценок пока нет
- TD Glucides 2018-2019Документ2 страницыTD Glucides 2018-2019the world العالم0% (2)
- Brevet 2023 Sciences Série GénéraleДокумент8 страницBrevet 2023 Sciences Série GénéraleLETUDIANT80% (10)
- Brevet Grammaire 2023Документ6 страницBrevet Grammaire 2023LETUDIANT78% (9)
- Goupille Naomie ChuДокумент3 страницыGoupille Naomie ChuLETUDIANTОценок пока нет
- Sujet Pro Sciences BrevetДокумент6 страницSujet Pro Sciences BrevetLETUDIANT67% (3)
- Sujets Dictée 2023 FrançaisДокумент2 страницыSujets Dictée 2023 FrançaisLETUDIANT88% (8)
- Brevet Maths ProДокумент8 страницBrevet Maths ProFranceinfo100% (1)
- Corrigé Brevet Hist Geo Emc 2023 Voie GénéraleДокумент4 страницыCorrigé Brevet Hist Geo Emc 2023 Voie GénéraleLETUDIANT100% (2)
- Brevet 2023 Sciences Série GénéraleДокумент8 страницBrevet 2023 Sciences Série GénéraleLETUDIANT80% (10)
- Corrigé Brevet Sciences 2023Документ3 страницыCorrigé Brevet Sciences 2023LETUDIANT56% (9)
- Brevet 2023 Maths GénéralДокумент6 страницBrevet 2023 Maths GénéralLETUDIANT79% (14)
- Brevet 2023 Histoire-Géographie (Série Générale)Документ9 страницBrevet 2023 Histoire-Géographie (Série Générale)deskwebDDM50% (2)
- Corrigé Brevet Francais Dictée Et Rédaction 2023Документ2 страницыCorrigé Brevet Francais Dictée Et Rédaction 2023LETUDIANT100% (14)
- Brevet Histoiregeo ProДокумент7 страницBrevet Histoiregeo ProFranceinfoОценок пока нет
- Corrigé Brevet Maths 2023 CompletДокумент3 страницыCorrigé Brevet Maths 2023 CompletLETUDIANT64% (11)
- Corrigé Brevet Francais 2023Документ5 страницCorrigé Brevet Francais 2023LETUDIANT80% (10)
- Brevet Francais ProДокумент9 страницBrevet Francais ProFranceinfoОценок пока нет
- Brevet 2023 Étranger GrammaireДокумент5 страницBrevet 2023 Étranger GrammaireLETUDIANT50% (8)
- Francais RedactionДокумент2 страницыFrancais RedactionAnonymous d9OucWLSfD100% (2)
- Corrigé Bac Général Français Sujet AДокумент5 страницCorrigé Bac Général Français Sujet ALETUDIANT100% (4)
- Correction Bac Gen Francais CompletДокумент11 страницCorrection Bac Gen Francais CompletLETUDIANT50% (2)
- Brevet 2023 Étranger Français DictéeДокумент2 страницыBrevet 2023 Étranger Français DictéeLETUDIANT100% (2)
- Brevet 2023 Étranger SciencesДокумент6 страницBrevet 2023 Étranger SciencesLETUDIANT100% (2)
- Brevet 2023 Étranger MathématiquesДокумент10 страницBrevet 2023 Étranger MathématiquesLETUDIANT100% (1)
- Epreuve de Français (Bac Général)Документ3 страницыEpreuve de Français (Bac Général)deskwebDDM0% (1)
- Bac Pro Économie-GestionДокумент11 страницBac Pro Économie-GestiondeskwebDDMОценок пока нет
- Correction Bac Pro Éco GestionДокумент5 страницCorrection Bac Pro Éco GestionLETUDIANT67% (3)
- BCP Eco DroitДокумент6 страницBCP Eco DroitLETUDIANT100% (2)
- Correction Complete BacTechno Philo 14-06-23Документ7 страницCorrection Complete BacTechno Philo 14-06-23LETUDIANT100% (2)
- 2023 Bac Pro Corrigé Prévention SantéДокумент3 страницы2023 Bac Pro Corrigé Prévention SantéLETUDIANT100% (3)
- Correction Bac Philo 2023 - Voie GénéraleДокумент5 страницCorrection Bac Philo 2023 - Voie GénéraleLETUDIANT100% (3)
- Coach en Nutrition - Module 1Документ23 страницыCoach en Nutrition - Module 1Adam Coaching ProОценок пока нет
- Cours Tec Sucre Mode Covid 2020Документ170 страницCours Tec Sucre Mode Covid 2020Soumia Jabbour100% (1)
- Palmier Dattier Producteur de SucreДокумент4 страницыPalmier Dattier Producteur de SucretourkiaОценок пока нет
- Intro 1er Chap Eco Le Marche ConcurrentielДокумент25 страницIntro 1er Chap Eco Le Marche ConcurrentielLambert LouisОценок пока нет
- Livret Pedagogique Animateur Alimentation AdosДокумент36 страницLivret Pedagogique Animateur Alimentation AdosInstant PrésentОценок пока нет
- Maman Fait Un Gâteau: Mélanie MaynéДокумент20 страницMaman Fait Un Gâteau: Mélanie Mayné7000dyvezahxoОценок пока нет
- Kristallisation FRZ 3Документ16 страницKristallisation FRZ 3abdОценок пока нет
- Jar Cakes DeluxeДокумент30 страницJar Cakes DeluxeSabrina MonlouisОценок пока нет
- Biéthanol EnigДокумент40 страницBiéthanol EnigamiraОценок пока нет
- EVALUATION DES PERTES EN SUCRE - ABCHIR Ahmed Houssni - 1020 PDFДокумент37 страницEVALUATION DES PERTES EN SUCRE - ABCHIR Ahmed Houssni - 1020 PDFchettibi amiraОценок пока нет
- Serie La Ration AlimentaireДокумент2 страницыSerie La Ration AlimentaireRabab TamouhОценок пока нет
- MillMax® - IAA - Juillet 2007 - 2Документ4 страницыMillMax® - IAA - Juillet 2007 - 2Sidi IbrahimОценок пока нет
- Protocole DiabeteДокумент37 страницProtocole DiabeteFella Mahiddine LouahebОценок пока нет
- Travaux de Recherche 2Документ11 страницTravaux de Recherche 2api-442196428Оценок пока нет
- Memoire Boissons SucreesДокумент41 страницаMemoire Boissons SucreesFa TeneОценок пока нет
- La Pyramide AlimentaireДокумент41 страницаLa Pyramide Alimentairebasmaagmir6Оценок пока нет
- RSE MArocДокумент12 страницRSE MArocYounes El ManzОценок пока нет
- Étude Du Marché Américain de La Confiserie PDFДокумент14 страницÉtude Du Marché Américain de La Confiserie PDFAlexander LeftaracheОценок пока нет
- Dossier Nestle PresentationДокумент19 страницDossier Nestle Presentationhindaoui_mohamed100% (1)
- Boissons Gazeuses, Le Big-Bang ! - Economie EntreprisesДокумент7 страницBoissons Gazeuses, Le Big-Bang ! - Economie EntreprisesSalma RyaniОценок пока нет
- Code Diabete - Prevenir Et Faire Regresser Le Diabete de Type 2 Naturellement.Документ248 страницCode Diabete - Prevenir Et Faire Regresser Le Diabete de Type 2 Naturellement.kadido100% (10)
- Le Régime Végétarien Peut-Il Inverser Le Diabète ?Документ4 страницыLe Régime Végétarien Peut-Il Inverser Le Diabète ?Alexis KomenanОценок пока нет
- Map KenwoodДокумент30 страницMap KenwoodMoraby Bandhoo WardaОценок пока нет
- Soufflé Au ChocolatДокумент38 страницSoufflé Au Chocolatcoco5713Оценок пока нет
- Newtribook 01Документ26 страницNewtribook 01Léa MartinelОценок пока нет
- Gagner Du Muscle Sans Mettre Ton Mode de Vie de CôtéДокумент20 страницGagner Du Muscle Sans Mettre Ton Mode de Vie de CôtéNikoОценок пока нет
- Environnement Agricole IДокумент39 страницEnvironnement Agricole IAdila LaissaouiОценок пока нет
- Cosumar Rapport AnnuelДокумент18 страницCosumar Rapport Annuelsafaa radilОценок пока нет
- Tech Ing Préparation de FruitsДокумент13 страницTech Ing Préparation de Fruitsmamylouche05Оценок пока нет
- PTSCG TSДокумент16 страницPTSCG TSamina imeneОценок пока нет