Академический Документы
Профессиональный Документы
Культура Документы
Ley de Charles
Загружено:
Henry Giampiere Reyna RamosАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Ley de Charles
Загружено:
Henry Giampiere Reyna RamosАвторское право:
Доступные форматы
Ley de Charles
Law of Charles
Henry Giampiere Reyna Ramos
Escuela de Ingeniería Química, Facultad de Ingeniería Química, Universidad Nacional
de Trujillo. Av. Juan Pablo ll s/n, Ciudad Universitaria, Trujillo, Perú.
*Autor correspondiente: hreyna@unitru.edu.pe (H. Reyna)
Fecha de recepción: 24 05 2018. Fecha de aceptación: 31 05 2018
RESUMEN
El siguiente trabajo se ha realizado con el objetivo de estudiar el efecto de un cambio
de temperatura sobre el volumen de un gas a presión y número de moles constantes.
La Ley de Charles es la que relaciona volumen y temperatura bajo esas dos restricciones;
en esta ley, Jacques Charles dice que para una cierta cantidad de gas a una
presión constante, al aumentar la temperatura, el volumen del gas aumenta y al
disminuir la temperatura, el volumen del gas disminuye.
Se hará uso de un aparato de un montaje poco complejo para estudiar esta ley,
usando como gas, el aire. Luego se hará uso de gráficas, para extrapolar valores y
ver si coinciden con los ya demostrados anteriormente.
Palabras Clave: Ley de Charles, temperatura absoluta
ABSTRACT
The following work has been carried out with the objective of studying the effect of a
temperature change on the volume of a gas under pressure and number of constant
moles.
The Law of Charles is the one that relates volume and temperature under those two
restrictions; In this law, Jacques Charles says that for a certain amount of gas at a
constant pressure, as the temperature increases, the volume of the gas increases and
as the temperature decreases, the volume of the gas decreases.
It will make use of an apparatus of a little complex assembly to study this law, using as
gas, the air. Then we will use graphs, to extrapolate values and see if they match those
already demonstrated above.
Keywords: Law of Charles, absolute temperature
H. Reyna
INTRODUCCIÓN En primer lugar, debemos montar el
aparato tal y como se muestra en la
Se sabe que el aire se expande al figura 1.
calentarlo, disminuyendo su densidad.
Por esta razón es que los globos se
elevan cuando se llenan con aire
caliente.
Mucho tiempo después de que Boyle
planteara su ley, Jacques Charles
determinó los efectos que una variación
de temperatura producía en un
volumen de aire. Luego de sus
experimentos, logró encontrar una
relación directa entre volumen y
temperatura, expresando su ley de la
siguiente forma:
V = C (t +273) (1) Figura 1. Aparato para el estudio de la Ley de
Charles
donde,
Siendo:
V, el volumen
A, Matraz Erlenmeyer 250 mL
t, la temperatura en escala Celsius(
sumando “273” nos dará T[k]) B, Tubería conectora
C, constante de proporcionalidad C, Trozo de tubo de vidrio en punta
Para una masa de gas medido a presión D, Vaso de precipitado 500 mL
constante y a diferentes temperaturas, E, Vaso de precipitado 100 mL
la ley queda así:
F, Llave de Mohr
𝑉1 𝑇1
= (2) Luego, calentar el agua de D hasta que
𝑉2 𝑇2
empiece a hervir (F debe estar cerrada),
Cabe resaltar que esta Ley se cumple a dejar hirviendo entre tres y cuatro
presión y numero de moles constantes. minutos, medir la temperatura y anotar
como temperatura 1 ( 1).
MATERIAL Y MÉTODOS
Retirar la mitad del agua de D y llenar
A) MATERIALES con agua fría. Además, verter una
cantidad pequeña de agua en E.
- Matraz Erlenmeyer 250 mL
Colocar A dentro de D y abrir F. Se verá
- Soporte universal
una absorción de agua circulando por
- Vasos de precipitado de 500 y 100 mL B, de E a D.
- Cocina eléctrica Cuando ya no se absorba más agua,
cerrar la llave F, tomar la temperatura
- Termómetro hasta que se mantenga en un valor
B) MÉTODO constante y anotarla como
temperatura 2 ( 2).
H. Reyna
Ahora, verter el agua de A y del tubo B Esto nos lleva a un porcentaje de error
en una probeta, medir su volumen y experimental de 1,17 %
anotar como VA.
B) EXACTITUD EXPERIMENTAL
Para el volumen del gas en el punto de
Representaremos los valores de la tabla
ebullición, este será igual al volumen de
2 y extrapolaremos a volumen 0.
A.
V/cm3 T/K
Finalmente, aplicar diferentes fórmulas
746 373
para hallar el volumen del gas a 646 323
temperatura 2 ( 2). 546 273
446 223
RESULTADOS Y DISCUSIÓN
346 173
Los datos obtenidos experimentalmente 246 123
para dos temperaturas (transformadas 146 73
Tabla 2. Datos de volúmenes de gas con las
a grados Kelvin), se muestran en la tabla temperaturas
1.
En una gráfica queda:
T/K V/mL
1 371 311 V vs T
2 309 256 800
Tabla 1. Datos experimentales
Volumen/mL
600
A) PRUEBAS DE LA LEY DE CHARLES
400
Según la ley de Chales, la relación V/T
debe permanecer constante. De 200
acuerdo a los datos experimentales, ¿se
0
cumple esta relación?
0 100 200 300 400
Aplicando la ecuación (1) Temperatura/K
V1/T1 = 311mL/371K = 0,838 mL/K Ahora graficando nuestros datos
V2/T2 = 256mL/309K = 0,828 mL/K experimentales y extrapolando a
volumen 0:
Podemos apreciar que los valores son
muy cercanos, por lo que si se cumple V vs t
dicha relación. 350
Se ha observado experimentalmente, 300
que el V2 es igual a 256 mL, ¿esto
coincide con el valor calculado? 250
Volumen/mL
V2= 256 mL (Observado) 200
VCALCULADO= (V1*T2)/T1 =259,02 ml (3) 150
Podemos ver que el volumen calculado
100
es un poco mayor, por lo que no
coincide con el observado, notándose 50
un error de:
0
Error experimental= VCALCULADO – V2 (4) -400 -200 0 200
Error experimental = 3.02 mL temperatura/ °C
H. Reyna
Como podemos observar para la
primera gráfica, la temperatura debe
estar en 0 K para que el volumen esté en
cero, mientras que para nuestros datos,
la temperatura debe estar a -272,95 °C.
Por lo tanto si coinciden ambas gráficas.
CONCLUSIONES
Según la Ley de Charles, nos dice que la
temperatura de los gases a volumen
cero es -273° C, según la gráfica de su
experimento que se muestra a
continuación:
Se logró comprobar que el volumen de
un gas es directamente proporcional al
cambio de temperatura a presión
constante.
REFERENCIAS BIBLIOGRÁFICAS
Ira N. Levine (2004) Fisicoquímica, City University of
New York: Brooklyn, New York
Dickerson (1992) Principios de Química,
Barcelona, España
LINKOGRAFÍA
https://es.wikipedia.org/wiki/Ley_de_Charles
http://estquimica.blogspot.com/p/ley-de-
charles_8.html
Вам также может понравиться
- Tippens Fisica 7e Soluciones 09Документ21 страницаTippens Fisica 7e Soluciones 09Manuel Cartagena57% (86)
- Problema 2Документ2 страницыProblema 2Henry Giampiere Reyna Ramos67% (3)
- Plan de Trabajo ElectricoДокумент25 страницPlan de Trabajo Electricojorge100% (1)
- Cargas ElectricasДокумент16 страницCargas Electricasjuan islasОценок пока нет
- Fisica 11Документ4 страницыFisica 11Leonardo Vertel100% (1)
- Leyes de Los GasesДокумент18 страницLeyes de Los GasesDayanebertel100% (1)
- ProblemasДокумент2 страницыProblemasAbel0% (1)
- Ejemplo 4Документ2 страницыEjemplo 4Henry Giampiere Reyna RamosОценок пока нет
- Clase FiltracionДокумент46 страницClase Filtracionvicente peña joaquinОценок пока нет
- Actividad Ley de CharlesДокумент3 страницыActividad Ley de CharlesPaula Denis Gálvez GonzálezОценок пока нет
- Ley de Gas Ideal - Charles y LussacДокумент15 страницLey de Gas Ideal - Charles y LussacAngie CalderonОценок пока нет
- Equivalente Mecanico Del CalorДокумент3 страницыEquivalente Mecanico Del CalorJose Luis Rubio MartinezОценок пока нет
- Gases Ideales LAB FISQUIMДокумент2 страницыGases Ideales LAB FISQUIMCarlosLondoño0% (1)
- Previo 4 TermodinámicaДокумент6 страницPrevio 4 TermodinámicaMaría Fernanda Alonso100% (1)
- Termodinamica Cuestionario Previo 8Документ5 страницTermodinamica Cuestionario Previo 8Cedric Monroy80% (5)
- Cuestionario Previo 4Документ3 страницыCuestionario Previo 4cinty_yuОценок пока нет
- ENTROPIAДокумент11 страницENTROPIAKike RodriguezОценок пока нет
- Previo Practica 8 Termodinamica Fi UnamДокумент1 страницаPrevio Practica 8 Termodinamica Fi UnamraulОценок пока нет
- Cuestionario Previo 8. Ley de CharlesДокумент2 страницыCuestionario Previo 8. Ley de CharlesDiego CárdenasОценок пока нет
- CALORIMETRÍAДокумент25 страницCALORIMETRÍAMartin Eduardo Marchena TiradoОценок пока нет
- Previo 8 Termo PDFДокумент4 страницыPrevio 8 Termo PDFEvander ZtgОценок пока нет
- Practica 4 QUIMICA APLICADA ESIMEZДокумент11 страницPractica 4 QUIMICA APLICADA ESIMEZCamila Mendoza GaonaОценок пока нет
- Previo 9Документ4 страницыPrevio 9Vázquez Escobosa José ArturoОценок пока нет
- Ley de Charles y Gay LussacДокумент5 страницLey de Charles y Gay LussacJhonnSernaGutierrezОценок пока нет
- Ecuaciones de EstadoДокумент12 страницEcuaciones de EstadoDavid IsraelОценок пока нет
- Gases Ideales o PerfectosДокумент31 страницаGases Ideales o PerfectosLuisa M PadovaniОценок пока нет
- Termo 13 EntropiaДокумент44 страницыTermo 13 EntropiaCarlos ChavaОценок пока нет
- Previo 8 - Vázquez Escobosa José ArturoДокумент5 страницPrevio 8 - Vázquez Escobosa José ArturoVázquez Escobosa José Arturo100% (1)
- Practica 8 Ley Cero de La TermodinamicaДокумент6 страницPractica 8 Ley Cero de La TermodinamicaEfrain Gonzalez JimenezОценок пока нет
- Campo ElectricoДокумент6 страницCampo ElectricoVICTORIA TOLEDOОценок пока нет
- LABORATORIO Nro 1 FISICOQUIMICA DETERMINACION DE LA RELACION PRESION-VOLUMEN A TEMPERATURA CONSTANTE (LEY DE BOYLE)Документ7 страницLABORATORIO Nro 1 FISICOQUIMICA DETERMINACION DE LA RELACION PRESION-VOLUMEN A TEMPERATURA CONSTANTE (LEY DE BOYLE)jimy lopez sednaoОценок пока нет
- TEMA1 SeriesДокумент12 страницTEMA1 SeriesAngel Barrios GutierrezОценок пока нет
- Entropia y EntalpiaДокумент2 страницыEntropia y EntalpiaKsОценок пока нет
- Energia Interna y EntalpiaДокумент14 страницEnergia Interna y Entalpiairvin_48911153100% (7)
- Determinacion de Humedad y CenizasДокумент53 страницыDeterminacion de Humedad y CenizasMiguel Angel O. FОценок пока нет
- TERMODINAMICAДокумент20 страницTERMODINAMICAAnonymous 38JYpKgE1Оценок пока нет
- Primera Ley de La TermodinamicaДокумент13 страницPrimera Ley de La TermodinamicaMiguelОценок пока нет
- Practica 2 Capacidad Calorifica de Los SolidosДокумент8 страницPractica 2 Capacidad Calorifica de Los SolidosCarolina RojasОценок пока нет
- Ensayo de AvogadroДокумент6 страницEnsayo de AvogadroLitman andres Bernal100% (1)
- Volumen Molar de Un Gas en Condiciones NormalesДокумент4 страницыVolumen Molar de Un Gas en Condiciones NormalesLuis Felipe Martínez Vargas50% (2)
- Primera Ley de La TermodinamicaДокумент33 страницыPrimera Ley de La TermodinamicaIAN CASTILLO ALONSO100% (1)
- Practica 1 - Mecanismo Excentrico-OsciladorДокумент4 страницыPractica 1 - Mecanismo Excentrico-OsciladorLuisОценок пока нет
- Practica 10 Constante Particular Del AireДокумент7 страницPractica 10 Constante Particular Del AireAlan Arrona100% (1)
- Instituto Politécnico Nacional Escuela Nacional de Ciencias BiológicasДокумент8 страницInstituto Politécnico Nacional Escuela Nacional de Ciencias BiológicasBertario Ríos GarcíaОценок пока нет
- Unidad 2 Segunda Ley de La TermodinamicaДокумент17 страницUnidad 2 Segunda Ley de La TermodinamicaalvaradomatematicoОценок пока нет
- Principios Mec. FluidosДокумент62 страницыPrincipios Mec. FluidoslayalmeОценок пока нет
- Reporte Practica 1 Antecedentes Aplicaciones deДокумент52 страницыReporte Practica 1 Antecedentes Aplicaciones deALDO URIEL FLORES DE LA ROSAОценок пока нет
- Biografias BalancesДокумент35 страницBiografias BalancesJuan Manuel Hernández Reyes100% (1)
- ENTROPIAДокумент9 страницENTROPIANevsaint MartinezОценок пока нет
- Práctica 12 Laboratorio de TermodinámicaДокумент5 страницPráctica 12 Laboratorio de TermodinámicaFranz Antik GarciaОценок пока нет
- Gases IdealesДокумент16 страницGases IdealesAlonso Ortega100% (1)
- Ley de Graham IPNДокумент6 страницLey de Graham IPNAlan MichelОценок пока нет
- Gases IdealesДокумент11 страницGases IdealesGustavo FerroОценок пока нет
- Cuestionario de Calorimetria!Документ2 страницыCuestionario de Calorimetria!AlexisPro93% (15)
- ESTEQUIOMETRIAДокумент21 страницаESTEQUIOMETRIAIsaac MejíaОценок пока нет
- Práctica 2 ReporteДокумент17 страницPráctica 2 ReporteJAVIER ARELLANO BRAVOОценок пока нет
- Cuestionario Previo 8 (Ley de Charles) - 1 - 278Документ9 страницCuestionario Previo 8 (Ley de Charles) - 1 - 278Alan Alberth OHОценок пока нет
- Práctica #10 TermodinámicaДокумент7 страницPráctica #10 TermodinámicaTona SanchezОценок пока нет
- Previo 8Документ3 страницыPrevio 8Edna Odette Melo UscangaОценок пока нет
- Variación de EntropíaДокумент8 страницVariación de EntropíaCuasar PulsarОценок пока нет
- HIDROSTATICAДокумент23 страницыHIDROSTATICApablo_anzenОценок пока нет
- Ecuaciones y Unidades para Variables TermodinámicasДокумент8 страницEcuaciones y Unidades para Variables TermodinámicasJosé BarajasОценок пока нет
- Previo Práctica 6 Electricidad y MagnetismoДокумент6 страницPrevio Práctica 6 Electricidad y MagnetismoJazmin ArellanoОценок пока нет
- Informe 9Документ4 страницыInforme 9juan lopez100% (1)
- Ejercicio 9.1-Transferencia de Masa IiДокумент11 страницEjercicio 9.1-Transferencia de Masa IiHenry Giampiere Reyna RamosОценок пока нет
- Corrosión Atmosférica de La Costa Norte Del PerúДокумент5 страницCorrosión Atmosférica de La Costa Norte Del PerúHenry Giampiere Reyna RamosОценок пока нет
- Borrar DespuésДокумент3 страницыBorrar DespuésHenry Giampiere Reyna RamosОценок пока нет
- Ensayo-La PersonalidadДокумент5 страницEnsayo-La PersonalidadHenry Giampiere Reyna RamosОценок пока нет
- Borrar DespuésДокумент2 страницыBorrar DespuésHenry Giampiere Reyna RamosОценок пока нет
- Leyes de GestaldДокумент2 страницыLeyes de GestaldHenry Giampiere Reyna RamosОценок пока нет
- Matlab-T. CalorДокумент17 страницMatlab-T. CalorHenry Giampiere Reyna RamosОценок пока нет
- EstДокумент1 страницаEstHenry Giampiere Reyna RamosОценок пока нет
- Reactor PFRДокумент2 страницыReactor PFRHenry Giampiere Reyna RamosОценок пока нет
- DESARROLLO DE LA PRÁCTICA DE AULA TermdinamicaДокумент18 страницDESARROLLO DE LA PRÁCTICA DE AULA TermdinamicaHenry Giampiere Reyna RamosОценок пока нет
- TP 8Документ8 страницTP 8Henry Giampiere Reyna Ramos100% (1)
- Ejercicio 9.1Документ9 страницEjercicio 9.1Henry Giampiere Reyna RamosОценок пока нет
- Leyes de GestaldДокумент2 страницыLeyes de GestaldHenry Giampiere Reyna RamosОценок пока нет
- AnaliticaДокумент68 страницAnaliticaHenry Giampiere Reyna RamosОценок пока нет
- Cantidad de TrabajadoresДокумент10 страницCantidad de TrabajadoresDarwin Paul Otiniano LuisОценок пока нет
- 10 Consejos para Siempre Mantener Una Actitud PositivaДокумент8 страниц10 Consejos para Siempre Mantener Una Actitud PositivaHenry Giampiere Reyna RamosОценок пока нет
- Personalidad, Carácter y Temperamento - ENSAYOДокумент6 страницPersonalidad, Carácter y Temperamento - ENSAYOHenry Giampiere Reyna RamosОценок пока нет
- LABORATORIOДокумент1 страницаLABORATORIOHenry Giampiere Reyna RamosОценок пока нет
- Presión de Vapor Del AguaДокумент2 страницыPresión de Vapor Del AguaHenry Giampiere Reyna RamosОценок пока нет
- Evaluación de Los Contenidos de Álcalis Totales en ClínkerДокумент6 страницEvaluación de Los Contenidos de Álcalis Totales en ClínkerHenry Giampiere Reyna RamosОценок пока нет
- Leyes de GestaldДокумент2 страницыLeyes de GestaldHenry Giampiere Reyna RamosОценок пока нет
- TP 3Документ7 страницTP 3Henry Giampiere Reyna RamosОценок пока нет
- 10 Tips para Tener Una Actitud Positiva - Apuntes y Mon... en Taringa!Документ4 страницы10 Tips para Tener Una Actitud Positiva - Apuntes y Mon... en Taringa!Henry Giampiere Reyna RamosОценок пока нет
- Practica 1 y 2 Estadistica General 2017Документ6 страницPractica 1 y 2 Estadistica General 2017Henry Giampiere Reyna RamosОценок пока нет
- IntercambiadorДокумент3 страницыIntercambiadorHenry Giampiere Reyna RamosОценок пока нет
- ButanoДокумент4 страницыButanoHenry Giampiere Reyna RamosОценок пока нет
- Leyes de GestaldДокумент2 страницыLeyes de GestaldHenry Giampiere Reyna RamosОценок пока нет
- Ensayo La PersonalidadДокумент5 страницEnsayo La PersonalidadHenry Giampiere Reyna RamosОценок пока нет
- Problemario Calculo DiferencialДокумент63 страницыProblemario Calculo DiferencialFridaCervantesCastilloОценок пока нет
- Informe Carga y Descarga Del Acero Grupo 9Документ24 страницыInforme Carga y Descarga Del Acero Grupo 9Santiago PadillaОценок пока нет
- Movimientos Terrestres (Rotación y Traslación)Документ4 страницыMovimientos Terrestres (Rotación y Traslación)AMPUEROОценок пока нет
- RÚBRICA ANALÍTICA DE DESEMPEÑO-2medioДокумент3 страницыRÚBRICA ANALÍTICA DE DESEMPEÑO-2medioRAÚL RAMÍREZ100% (1)
- Manual de Practica-Determinacion Optica de Sustancias AzucaradasДокумент8 страницManual de Practica-Determinacion Optica de Sustancias AzucaradasZeila Georgina Falcon RamirezОценок пока нет
- Baltuano Edwin Diseño Maquina Compactadora Latas Bebidas Aluminio AnexosДокумент62 страницыBaltuano Edwin Diseño Maquina Compactadora Latas Bebidas Aluminio AnexosbrayanОценок пока нет
- Clases de Hysys 3 Equipos de Transferencia de MasaДокумент136 страницClases de Hysys 3 Equipos de Transferencia de MasaRocio Becerra CastilloОценок пока нет
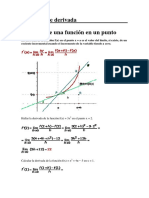
- Concepto de DerivadaДокумент98 страницConcepto de DerivadaJhonhy Terra VilaОценок пока нет
- Presentación Ley Del SenoДокумент18 страницPresentación Ley Del SenoAnne McKyntireОценок пока нет
- Laboratorio N 3 NRC 3587 Armas David Ruiz StevenДокумент7 страницLaboratorio N 3 NRC 3587 Armas David Ruiz StevenAndrés AmoresОценок пока нет
- Adhesivos para Protesis Dentales PDFДокумент2 страницыAdhesivos para Protesis Dentales PDFaprmasterОценок пока нет
- Informe de Quimica GeneralДокумент10 страницInforme de Quimica Generalferfleon_800% (1)
- Curvas Tipo RameyДокумент9 страницCurvas Tipo RameyViancaОценок пока нет
- Fundamentos de Puesta A Tierra PDFДокумент8 страницFundamentos de Puesta A Tierra PDFRoberto ZavaletaОценок пока нет
- Guia No 1 - Educacion Ambiental - UndecimoДокумент1 страницаGuia No 1 - Educacion Ambiental - UndecimoMichell RiveraОценок пока нет
- Laboratorio 3 Ley de Tensiones de Kirchoff y Divisor de TensionДокумент6 страницLaboratorio 3 Ley de Tensiones de Kirchoff y Divisor de TensionCristian J. Tamayo Peña100% (1)
- Manual Del Estudiante HidraulicoДокумент53 страницыManual Del Estudiante HidraulicoSaul Huayhua100% (1)
- Examen PHДокумент2 страницыExamen PHBeatriz Sanchéz LopesОценок пока нет
- Ejercicios Electrotecnia 3Документ3 страницыEjercicios Electrotecnia 3OTTOОценок пока нет
- Mantenimiento A Motores ElectricosДокумент41 страницаMantenimiento A Motores ElectricosIvan Jacob80% (5)
- Tarea 2 - UNIDAD Aplicación 2 Ley de Newton-fricción-mcu-ToRSORДокумент5 страницTarea 2 - UNIDAD Aplicación 2 Ley de Newton-fricción-mcu-ToRSORVictor Hernandez33% (3)
- Taller Tabla PeriodicaДокумент2 страницыTaller Tabla PeriodicaClaudio OrdonezОценок пока нет
- QU0430 - 2020-1C - Clase 1-2 - D-Radiación Gamma y Conversión InternaДокумент11 страницQU0430 - 2020-1C - Clase 1-2 - D-Radiación Gamma y Conversión InternaPaul RamirezОценок пока нет
- Circuito de Disparo Basico PWM para MOSFET en Un Sistema de CDДокумент5 страницCircuito de Disparo Basico PWM para MOSFET en Un Sistema de CDDaniel Armando Lopez RodriguezОценок пока нет
- Deduccion de La Ecuacion para Panhandle1internetДокумент17 страницDeduccion de La Ecuacion para Panhandle1internetMikhail LópezОценок пока нет