Академический Документы
Профессиональный Документы
Культура Документы
Pemba Has An
Загружено:
FadillaLovianaIrwanАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Pemba Has An
Загружено:
FadillaLovianaIrwanАвторское право:
Доступные форматы
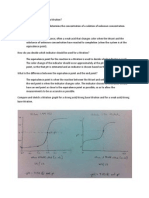
Percobaan 1 Percobaan 2
Pembahasan
Penetapan kadar larutan asam dan basa dapat dilakukan melalui suatu prosedur percobaan
yang disebut titrasi asam basa. Istilah titrasi berarti penetapan liter atau kadar. Titrasi asam-basa
adalah titrasi yang berdasarkan penetralan asam basa. Kadar larutan asam ditentukan dengan
menggunakan larutan basa yang diketahui kadarnya, dan sebaliknya, kadar larutan basa ditentukan
dengan menggunakan larutan asam yang diketahui kadarnya
Dalam percobaan yang telah dilakukan, kami akan menentukan kadar suatu HCl dengan
menggunakan larutan NaOH 0,1 M. Dengan tujuan tersebut, kita perlu mengetahui berapa volum
larutan NaOH yang ekivalen dengan volum tertentu larutan HCl tersebut. Untuk itu, kami
menempatkan 10mL HCl yang sudah ditetesi 1 tetes fenolftalein dalam labu erlenmeyer,kemudian
ditetesi dengan larutan NaOH 0,1 M (dalam buret) sehingga keduanya ekivalen (tepat habis
bereaksi). Titik ekivalen dapat diketahui dengan bantuan indikator, yang dalam percobaan ini
fenolftalein digunakan sebagai indikator karena perubahan warna indikator fenolftalein lebih tajam (
lebih mudah diamati), maka indikator fenolftalein sering digunakan. Titrasi (penetesan) dihentikan
tepat pada saat indikator menunjukkan perubahan warna yang disebut titik akhir titrasi.
Titik ekivalen : pH pada saat asam dan basa tepat ekivalen. Titik akhir titrasi : pH pada saat
indikator berubah warna. Untuk memperoleh ketepatan hasil titrasi yang tinggi, maka diusahakan
titik akhir titrasi sedekat mungkin dengan titik ekivalen. Oleh karena itu, harus dipilih indikator yang
mengalami perubahan warna di sekitar titik ekivalen. Jika asam ditetesi basa, maka pH larutan akan
naik. Sebaliknya, jika basa ditetesi dengan asam, maka pH larutan akan menurun. Grafik perubahan
pH dalam titrasi asam-basa disebut kurva titrasi. Dalam percobaan ini merupakan titrasi asam kuat
(HCl) dan basa kuat (NaOH).
Вам также может понравиться
- TheoryДокумент1 страницаTheoryapi-203606735Оценок пока нет
- The Chemistry of Fertilisers and Manure - Including Information on the Chemical Constituents and Types of Fertilisers and ManuresОт EverandThe Chemistry of Fertilisers and Manure - Including Information on the Chemical Constituents and Types of Fertilisers and ManuresРейтинг: 5 из 5 звезд5/5 (1)
- HCL + Naoh Nacl + H O: (Aq) (Aq) (Aq) 2 (L)Документ3 страницыHCL + Naoh Nacl + H O: (Aq) (Aq) (Aq) 2 (L)Ilmiati ZakinahОценок пока нет
- Detection of Ions in Solutions Using Acid/Base Chemistry: A Quality Control TestДокумент4 страницыDetection of Ions in Solutions Using Acid/Base Chemistry: A Quality Control TestRuchika Sood100% (1)
- A Further Investigation of the Symmetrical Chloride of Paranitroorthosulphobenzoic AcidОт EverandA Further Investigation of the Symmetrical Chloride of Paranitroorthosulphobenzoic AcidОценок пока нет
- Acid Base TitrationДокумент16 страницAcid Base TitrationsyazaismailОценок пока нет
- WINSEM2022-23 BBIT206P LO VL2022230503900 Reference Material I 23-12-2022 Experiment 2 Acid-Base Titration PH Meter FAДокумент4 страницыWINSEM2022-23 BBIT206P LO VL2022230503900 Reference Material I 23-12-2022 Experiment 2 Acid-Base Titration PH Meter FAGravity JaiОценок пока нет
- Fourth International Conference on Non-Aqueous Solutions: Vienna 1974От EverandFourth International Conference on Non-Aqueous Solutions: Vienna 1974V. GutmannОценок пока нет
- Standardization of A Primary Standard and Determination of Concentration by Acid-Base TitrationДокумент2 страницыStandardization of A Primary Standard and Determination of Concentration by Acid-Base TitrationTheophilus FrimpongОценок пока нет
- Experiment 7Документ4 страницыExperiment 7Vinitra PillaiОценок пока нет
- Experiment A7 - Titration.v2Документ13 страницExperiment A7 - Titration.v2adel malikОценок пока нет
- Name: Yambesa Surname: Mphathiswa STUDENT NUMBER: 202250111 Group D1 Experiment 3Документ10 страницName: Yambesa Surname: Mphathiswa STUDENT NUMBER: 202250111 Group D1 Experiment 3YAMBESA MphathiswaОценок пока нет
- Reading Material For Experiment 3Документ4 страницыReading Material For Experiment 3Abdallah AlhasanОценок пока нет
- Lec Week 11 Neutralization Titrations - Sample Calculations - For ClassДокумент50 страницLec Week 11 Neutralization Titrations - Sample Calculations - For ClassTrisha PurcaОценок пока нет
- Buffers and Salts Hydrolysis: 3-1. Preparation of Ammonium BufferДокумент3 страницыBuffers and Salts Hydrolysis: 3-1. Preparation of Ammonium BufferaisarachemОценок пока нет
- Determination of The Concentration of Acetic Acid in VinegarДокумент16 страницDetermination of The Concentration of Acetic Acid in VinegarFirdaus HaziqОценок пока нет
- TP 3 AnglaisДокумент5 страницTP 3 AnglaisjosbenachenhouОценок пока нет
- Acid-Base TitrationsДокумент34 страницыAcid-Base TitrationsAisha IltafОценок пока нет
- Acid Base TitrationДокумент22 страницыAcid Base Titrationnorewa9632Оценок пока нет
- Titration Lab ReportДокумент5 страницTitration Lab ReportAngelica71% (21)
- Determining Molarity Through AcidДокумент10 страницDetermining Molarity Through Acidapi-284534960Оценок пока нет
- Post Lab 5Документ7 страницPost Lab 5Heinrich SolivenОценок пока нет
- Experiment 2Документ8 страницExperiment 2Alok VermaОценок пока нет
- Publication 2 8978 1091Документ13 страницPublication 2 8978 1091زياد المرسوميОценок пока нет
- Btech Lab Manual With Assignments - 240303 - 163040Документ34 страницыBtech Lab Manual With Assignments - 240303 - 163040devrajmaji457Оценок пока нет
- Fakulty of Sustainable Agriculture RT10303 Chemistry For Agriculture Dr. Lum Mok Sam Practical 2Документ5 страницFakulty of Sustainable Agriculture RT10303 Chemistry For Agriculture Dr. Lum Mok Sam Practical 2Noor AmyrahОценок пока нет
- Titration Lab Report: Accelerated ChemistryДокумент25 страницTitration Lab Report: Accelerated Chemistryapi-439858777Оценок пока нет
- THanna StudentversionДокумент10 страницTHanna StudentversionMahesh KhamitkarОценок пока нет
- Back Titration ZincДокумент3 страницыBack Titration ZincSteve RodriguesОценок пока нет
- Titration: Lab ReportДокумент18 страницTitration: Lab Reportapi-327697210Оценок пока нет
- Chem - Lab Report 3Документ11 страницChem - Lab Report 3mahzebОценок пока нет
- Instrumental Analytical Methods Experiment 9 - Ph-Metric Titration of Acetic AcidДокумент3 страницыInstrumental Analytical Methods Experiment 9 - Ph-Metric Titration of Acetic Acidapi-235187189Оценок пока нет
- AP Chemistry Investigation 4 - Judy, Paul, AnthonyДокумент13 страницAP Chemistry Investigation 4 - Judy, Paul, AnthonyAnthony HowerОценок пока нет
- Exercise 0 TitrationДокумент6 страницExercise 0 TitrationMINVILU JUNEN BUSAINGОценок пока нет
- Laporan Kimdal Percobaan Unit 1Документ7 страницLaporan Kimdal Percobaan Unit 1rulmadhaniОценок пока нет
- Acid Base TitrationДокумент14 страницAcid Base TitrationOktaviana Al-fajrОценок пока нет
- Experiment 10Документ1 страницаExperiment 10SELEUCIDОценок пока нет
- Kimling I - 5Документ16 страницKimling I - 5AriezalОценок пока нет
- TITRATIONДокумент14 страницTITRATIONGezem GigantoОценок пока нет
- Potentiometric TitrationДокумент3 страницыPotentiometric TitrationDaniele Joseph HizonОценок пока нет
- The Ka & Molar Mass of A Monoprotic Weak AcidДокумент7 страницThe Ka & Molar Mass of A Monoprotic Weak AcidLeslie Sarah100% (1)
- Acid-Base Titration LabДокумент8 страницAcid-Base Titration LabErica Jenson100% (4)
- Titration of A Poliprotic AcidДокумент7 страницTitration of A Poliprotic AcidRaduОценок пока нет
- Lab Report 4Документ1 страницаLab Report 4bjddjkОценок пока нет
- EquilibriumДокумент3 страницыEquilibriumShayna FollingtonОценок пока нет
- Acid-Base Lab ReportДокумент6 страницAcid-Base Lab Reportapi-279614944Оценок пока нет
- Preparation of Buffer SolutionДокумент8 страницPreparation of Buffer SolutionESTHER WONG TZE YIING -Оценок пока нет
- Lab Experiment 3 - PH TitrationДокумент1 страницаLab Experiment 3 - PH Titrationfive shadowsОценок пока нет
- Lab 1Документ18 страницLab 1Syah MieОценок пока нет
- Acid Base TitrationДокумент12 страницAcid Base TitrationMsfaeza HanafiОценок пока нет
- Standardization of A Naoh Solution With Potassium Hydrogen Phthalate (KHP) and Titration of Vinegar With Standardized NaohДокумент4 страницыStandardization of A Naoh Solution With Potassium Hydrogen Phthalate (KHP) and Titration of Vinegar With Standardized NaohSantino MusaОценок пока нет
- QuestionsДокумент3 страницыQuestionsapi-203606735Оценок пока нет
- Phosphorus Acid TitrationДокумент2 страницыPhosphorus Acid TitrationJoséMaríaMoreОценок пока нет
- Titration LABДокумент20 страницTitration LABapi-359167484Оценок пока нет
- Hse Plustwo Chemistry Svolumetric Analysis Anil HssliveДокумент4 страницыHse Plustwo Chemistry Svolumetric Analysis Anil HssliveAryan ThakurОценок пока нет
- Sinha TitrationcurvesДокумент11 страницSinha TitrationcurvesRadu StafiОценок пока нет
- When We Applied Back TitrationДокумент3 страницыWhen We Applied Back TitrationHanaa Abo SweirhОценок пока нет
- OpiniДокумент1 страницаOpiniFadillaLovianaIrwanОценок пока нет
- Laskar PelangiДокумент5 страницLaskar PelangiFadillaLovianaIrwanОценок пока нет
- Tugas BingДокумент2 страницыTugas BingFadillaLovianaIrwanОценок пока нет
- Spontaneous Uterine Rupture in Pregnancy: January 2014Документ3 страницыSpontaneous Uterine Rupture in Pregnancy: January 2014FadillaLovianaIrwanОценок пока нет
- Overview#a8: Uterine Rupture in PregnancyДокумент13 страницOverview#a8: Uterine Rupture in PregnancyFadillaLovianaIrwanОценок пока нет
- Ipi 328318 DДокумент5 страницIpi 328318 DRobertus HajaiОценок пока нет
- 3 IdiotsДокумент1 страница3 IdiotsFadillaLovianaIrwanОценок пока нет
- Ouch! That Was Hurt It Is Painful It Hurts Me I've Got Abackache/toothache/stomachache I Feel Sore All Over My Eyes HurtДокумент2 страницыOuch! That Was Hurt It Is Painful It Hurts Me I've Got Abackache/toothache/stomachache I Feel Sore All Over My Eyes HurtFadillaLovianaIrwanОценок пока нет
- Prey: Immigration, Islam, and the Erosion of Women's RightsОт EverandPrey: Immigration, Islam, and the Erosion of Women's RightsРейтинг: 4.5 из 5 звезд4.5/5 (14)
- The Secret of the Golden Flower: A Chinese Book Of LifeОт EverandThe Secret of the Golden Flower: A Chinese Book Of LifeРейтинг: 5 из 5 звезд5/5 (4)
- Seeking Allah, Finding Jesus: Third Edition with Bonus Content, New ReflectionsОт EverandSeeking Allah, Finding Jesus: Third Edition with Bonus Content, New ReflectionsРейтинг: 5 из 5 звезд5/5 (1058)
- Secrets of Divine Love: A Spiritual Journey into the Heart of IslamОт EverandSecrets of Divine Love: A Spiritual Journey into the Heart of IslamРейтинг: 5 из 5 звезд5/5 (117)
- Women and Gender in Islam: Historical Roots of a Modern DebateОт EverandWomen and Gender in Islam: Historical Roots of a Modern DebateРейтинг: 5 из 5 звезд5/5 (2)
- The Tao of Influence: Ancient Wisdom for Modern Leaders and EntrepreneursОт EverandThe Tao of Influence: Ancient Wisdom for Modern Leaders and EntrepreneursРейтинг: 4.5 из 5 звезд4.5/5 (9)
- The Bible and the Qur'an: A Comparative StudyОт EverandThe Bible and the Qur'an: A Comparative StudyРейтинг: 5 из 5 звезд5/5 (10)
- The Essence of the Bhagavad Gita: Explained by Paramhansa Yogananda as remembered by his disciple, Swami KriyanandaОт EverandThe Essence of the Bhagavad Gita: Explained by Paramhansa Yogananda as remembered by his disciple, Swami KriyanandaРейтинг: 4.5 из 5 звезд4.5/5 (40)
- The Gift of Rumi: Experiencing the Wisdom of the Sufi MasterОт EverandThe Gift of Rumi: Experiencing the Wisdom of the Sufi MasterРейтинг: 4 из 5 звезд4/5 (9)
- Mad Monk Manifesto: A Prescription for Evolution, Revolution and Global AwakeningОт EverandMad Monk Manifesto: A Prescription for Evolution, Revolution and Global AwakeningРейтинг: 5 из 5 звезд5/5 (19)
- Arabic Course for English Speaking Students Madina Islamic UniversityОт EverandArabic Course for English Speaking Students Madina Islamic UniversityОценок пока нет
- The Essence of Self-Realization: The Wisdom of Paramhansa YoganandaОт EverandThe Essence of Self-Realization: The Wisdom of Paramhansa YoganandaРейтинг: 4.5 из 5 звезд4.5/5 (43)
- A Doubter's Guide to World Religions: A Fair and Friendly Introduction to the History, Beliefs, and Practices of the Big FiveОт EverandA Doubter's Guide to World Religions: A Fair and Friendly Introduction to the History, Beliefs, and Practices of the Big FiveРейтинг: 4.5 из 5 звезд4.5/5 (7)
- Taoism for Beginners: Understanding and Applying Taoist History, Concepts, and PracticesОт EverandTaoism for Beginners: Understanding and Applying Taoist History, Concepts, and PracticesРейтинг: 5 из 5 звезд5/5 (1)
- Shakti Rising: Embracing Shadow and Light on the Goddess Path to WholenessОт EverandShakti Rising: Embracing Shadow and Light on the Goddess Path to WholenessРейтинг: 5 из 5 звезд5/5 (21)