Академический Документы
Профессиональный Документы
Культура Документы
Obtencion Benzoina
Загружено:
Lili RosalesОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Obtencion Benzoina
Загружено:
Lili RosalesАвторское право:
Доступные форматы
CONDENSACIÓN DEL BENZALDEHÍDO PARA LA OBTENCIÓN DE BENZOÍNA
RESUMEN.-
La reactividad del grupo carbonilo es consecuencia de la diferencia de electronegatividad entre el átomo de carbono y
el átomo de oxígeno. Reacción más común es la adición nucleofílica, consiste en adición de un nucleófilo y de un protón
al doble enlace C=O. Los aldehídos aromáticos en presencia de un ion cianuro se dimerizan catalíticamente para formar
la α-hidroxicetona correspondiente (reacción reversible), recibe el nombre de condensación benzoica (especialmente el
benzaldehído). La reacción es catalizada el anión cianuro o un carbeno N-heterocíclico. Método anterior por el cual se
obtiene la Benzoína. Usos industriales contemporáneos de Benzoína incluyen suplementos alimenticios,perfumes e
inciensos.Aplicación más popular es como inhalación, aunque también se ingiere,en cantidades pequeñas.Siendo
repelente natural para insectos, su olor dulce y parecido al de Vainilla resulta en un incienso, dulce y suave.
OBJETIVOS:
Obtener una hidroxicetona (benzoina) a partir de un aldehído.
Interpretar las reacciones de carbaniones e identificar el producto obtenido.
PROPIEDADES FISICAS Y QUIMICAS DE REACTIVOS Y PRODUCTOS.-
Propiedades KCN Benzaldehído Etanol Benzoina
liquido inflamables olor a solido
Edo. físico y color sólido blanco liquido incoloro
almendras amarillo
Peso molecular g/mol 65.11 106.13 46.07 212.2
Punto de ebullición °c - 178 78.5 344
Punto de fusión 634 -56.5 - 137
Densidad (g/ml) 1.988 1.046 .816 1.31
Agua Fría y caliente si si no
Solubilidad Solvent Éter, acetona y
Etanol Etanol,éter,acetona,benceno Éter
es benceno
Altamente toxico
Intoxicación
Toxicidad por ingestión y Por inhalación e ingestión Por ingestión
por contacto
absorción
MECANISMO DE REACCION.-
CÁLCULOS.-
Calculo Estequiométrico
2𝑛𝑏𝑒𝑛𝑧𝑎𝑙𝑑𝑒ℎ𝑖𝑑𝑜 ⟹ 𝑛𝐵𝑒𝑛𝑧𝑜𝑖𝑛𝑎
𝑔
𝑚 𝑉∗𝜌 3𝑚𝑙 ∗ 1.046 ⁄𝑚𝑙 ∗ 0.98 3.074𝑔
𝑛𝑏𝑒𝑛𝑧𝑎𝑙𝑑𝑒ℎ𝑖𝑑𝑜 = ( ) =( ) = 𝑔 = 𝑔 = 0.0290 𝑚𝑜𝑙
𝑃𝑀 𝑏𝑒𝑛𝑧𝑎𝑙𝑑𝑒ℎ𝑖𝑑𝑜 𝑃𝑀 𝑏𝑒𝑛𝑧𝑎𝑙𝑑𝑒ℎ𝑖𝑑𝑜 106 ⁄𝑚𝑜𝑙 106 ⁄𝑚𝑜𝑙
Por la relación estequiometrica
𝑛𝑏𝑒𝑛𝑧𝑎𝑙𝑑𝑒ℎ𝑖𝑑𝑜 0.0290 𝑚𝑜𝑙
𝑛𝐵𝑒𝑛𝑧𝑜𝑖𝑛𝑎 = = = 0.0145 𝑚𝑜𝑙
2 2
𝑔
𝑚𝐵𝑒𝑛𝑧𝑜𝑖𝑛𝑎,𝑡𝑒𝑜𝑟𝑖𝑐𝑜 = 𝑛𝐵𝑒𝑛𝑧𝑜𝑖𝑛𝑎 ∗ 𝑃𝑀 = 0.0145 𝑚𝑜𝑙 ∗ 212 ⁄𝑚𝑜𝑙 = 3.074𝑔
𝑚𝐵𝑒𝑛𝑧𝑜𝑖𝑛𝑎,𝑝𝑟𝑎𝑐𝑡𝑖𝑐𝑜 = 𝑚𝑝𝑎𝑝𝑒𝑙+𝑓𝑖𝑙𝑡𝑟𝑎𝑑𝑜 − 𝑚𝑝𝑎𝑝𝑒𝑙 = 3.36𝑔 − 0.8𝑔 = 2.56𝑔
𝑚𝐵𝑒𝑛𝑧𝑜𝑖𝑛𝑎,𝑝𝑟𝑎𝑐𝑡𝑖𝑐𝑜 2.56𝑔
𝜂= ∗ 100 = ∗ 100 = 𝟖𝟑. 𝟐𝟖% 𝜂 = 𝟖𝟑. 𝟐𝟖%
𝑚𝐵𝑒𝑛𝑧𝑜𝑖𝑛𝑎,𝑡𝑒𝑜𝑟𝑖𝑐𝑜 3.074𝑔
Selectividad
𝑚𝐵𝑒𝑛𝑧𝑜𝑖𝑛𝑎,𝑝𝑟𝑎𝑐𝑡𝑖𝑐𝑜 2.56𝑔
𝑆= ∗ 100 = 83.28 = 𝟗𝟗. 𝟗𝟗% 𝑆 = 𝟗𝟗. 𝟗𝟗%
𝑚𝐵𝑒𝑧𝑜𝑖𝑛𝑎 ∗𝜂 3.074𝑔∗
100
Eficiencia
𝜂∗𝑆
𝐸= = 𝟖𝟑. 𝟐𝟕%
100
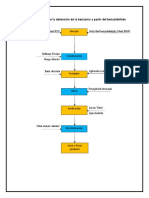
DESARROLLO EXPERIMENTAL.-
CONDENSACION.- PURIFICACION DEL
2.- Reflujar la mezcla PRODUCTO.-
calentando a fuego directo 5.-Lavar con 20 ml de agua
PREPARACION DE durante 30 minutos, helada para eliminar
REACTIVOS.- comenzando a contar el
tiempo cuando cae la primera
excedente de Cianuro de
1.-Disolver en matraz balón potasio (KCN). Se observa
0.2 g de Cianuro de potasio gota del reflujo.
que el producto se
(KCN) en 5ml de agua y 3.- colocar el contenido del presenta en forma de
agregar una solucion de 3ml matraz en un vaso de
de benzaldehido en 10 ml de precipitados.
sólido el cual se purifica
etanol. por recristalizacion en 20
4.- Enfriar el contenido del ml de etanol caaliente.
vaso en baño de hielo,
agitando constantemente y 6.- Secar y pesar el
filtrar el precipitado formado. producto.
ANÁLISIS DE RESULTADOS.-
De acuerdo a los resultados obtenidos, se encontró que se obtuvo una eficiencia de 83.28%, lo que afirma que
el trabajo realizado durante la experimentacion fue buena, ya que un porcentaje arriba del 60% es demasiado
aceptable, por otro lado los porcentajes de selectividad y eficiencia también fueron altos, con todo esto, puede
decirse que si se logró obtener lo esperado de benzoina.
RECOMENDACIONES.-
Durante la experimentación, los parámetros más importantes a considerar son la temperatura, cuidando no rebasar
los 78 °C, ya que es la temperatura a la cual el Etanol llega a su punto de ebullición, considerando que éste es el
medio de reacción. Mantener fría el agua de reflujo, para obtener un condensado y evitar pérdidas de reactivos,
colocar la mezcla de reactivos a fuego directo y en reflujo durante el tiempo de reacción indicado (20-30 minutos),
después de transcurrido el tiempo de reacción vaciar inmediatamente la mezcla en un baño inverso para obtener
el precipitado.
CONCLUSIONES.-
El benzaldehído en presencia de iones cianuro, sufre una única reacción de condensación, llamada condensación
benzoica, de la que se obtiene una beta-hidroxicetona llamada Benzoína,se obtiene por dimerización del
benzaldehído en presencia de cantidades catalíticas de cianuro, al final de la experimentacion se obtuvo la
benzoina como precipitado a partir de la reaccion descrita, aunque en varios casos este producto no se obtuvo
debido a que la temperatura con que se trabajo y mantuvo la mezcla no fue la correcta, con lo que no se logró la
reacción.
BIBLIOGRAFÍA:
http://www.ciens.ucv.ve/quimicaorg/PRACTICAS/GUIA%20bloque%20ii.pdf
http://docencia.izt.uam.mx/cuhp/QuimOrgIII/PracLabQO3.pdf
H. DUPONT DURST,GEORGE W. GOKEL; QUIMICA ORGANICA EXPERIMENTAL;ED. REVERTE; ESPAÑA;MAYO
DE 2007.
Вам также может понравиться
- Cuestionario Unidad 5-Ciclo RankineДокумент6 страницCuestionario Unidad 5-Ciclo RankineOscar Andrade100% (2)
- Memoria de Calculo Inst GasДокумент6 страницMemoria de Calculo Inst Gascatalinabellop100% (2)
- Obtención de AnilinaДокумент26 страницObtención de AnilinaAlejandro Gómez50% (2)
- Actividad Superficial de Alcoholes AlifaticosДокумент13 страницActividad Superficial de Alcoholes AlifaticosFlor Carrera67% (3)
- Practica 2 QOIДокумент3 страницыPractica 2 QOINadia Montero GonzálezОценок пока нет
- Benzoato de Etilo Equipo 3 2IM45Документ14 страницBenzoato de Etilo Equipo 3 2IM45PaolaОценок пока нет
- Dibenzalacetona p-2Документ4 страницыDibenzalacetona p-2Enrique Flores OlivaresОценок пока нет
- Practica 3 Dibenzalacetona Equipo 2Документ14 страницPractica 3 Dibenzalacetona Equipo 2Josue CarmonaОценок пока нет
- Práctica 2Документ11 страницPráctica 2Paola Morales PerezОценок пока нет
- 2 FenilindolДокумент10 страниц2 FenilindolLuisa Fernanda Sierra Montes100% (1)
- Practica 4 Benzoato de Metilo Organica 2Документ5 страницPractica 4 Benzoato de Metilo Organica 2Elie floresОценок пока нет
- Determinacion Masa Molécular Por Elevación de Punto de EulliciónДокумент4 страницыDeterminacion Masa Molécular Por Elevación de Punto de EulliciónAlexia AguilarОценок пока нет
- P4 Diels-AlderДокумент12 страницP4 Diels-AlderMarlen Hernández ArellanoОценок пока нет
- Benzofenona Equipo 3 2IM45Документ15 страницBenzofenona Equipo 3 2IM45PaolaОценок пока нет
- PreInforme Química Orgánica: Destilación Por Arrastre de VaporДокумент5 страницPreInforme Química Orgánica: Destilación Por Arrastre de VaporDiego Fernando TorresОценок пока нет
- Previo Ácido-BencilicoДокумент5 страницPrevio Ácido-BencilicoJose Emmanuel ChemaОценок пока нет
- Practica 3 Equipo 2Документ14 страницPractica 3 Equipo 2López Morales Alejandra AremiОценок пока нет
- DibenzalacetonaДокумент11 страницDibenzalacetonaDiego ValenciaОценок пока нет
- Practica 3 Diels-AldersДокумент12 страницPractica 3 Diels-AldersJosue CarmonaОценок пока нет
- Práctica 3. Síntesis de PiridinasДокумент5 страницPráctica 3. Síntesis de PiridinasAde TimОценок пока нет
- Practica 2 DibenzalacetonaДокумент13 страницPractica 2 DibenzalacetonaAndrea CastilloОценок пока нет
- Condensación de Claisen-Schmidt. 2Документ8 страницCondensación de Claisen-Schmidt. 2Edward AlexanderОценок пока нет
- Informe 2 de Sintesis 2019Документ9 страницInforme 2 de Sintesis 2019Tatiana CastañoОценок пока нет
- Informe 3 QOIIДокумент8 страницInforme 3 QOIICarlos David CumbaОценок пока нет
- Reporte Diels AlderДокумент13 страницReporte Diels AlderEmanuel Ja-OsОценок пока нет
- Informe Práctica Diferenciación de IsómerosДокумент8 страницInforme Práctica Diferenciación de IsómerosANDERSON FABIER MOJICA LAVERDEОценок пока нет
- Eter-Metilnaftilico Mariana KarenДокумент21 страницаEter-Metilnaftilico Mariana KarenPepe Arturo GonzalezОценок пока нет
- Obtencion de Anhidrido Ftalico A Traves PDFДокумент10 страницObtencion de Anhidrido Ftalico A Traves PDFJhoan Piermattey DittaОценок пока нет
- Laboratorio 8 OrgánicaДокумент8 страницLaboratorio 8 OrgánicaRicardoRochaCardonaОценок пока нет
- Informe Destilacion DiferencialДокумент7 страницInforme Destilacion DiferencialHugo Armando Iral Maldonado100% (2)
- Industrial 21 FEBДокумент9 страницIndustrial 21 FEBDiego ValenciaОценок пока нет
- Organica IndustrialДокумент9 страницOrganica IndustrialDiego ValenciaОценок пока нет
- Datos, Calculos de Destilacion Sencilla y FraccionadaДокумент3 страницыDatos, Calculos de Destilacion Sencilla y FraccionadaquimicadesextoОценок пока нет
- Informe de Laboratorio 1Документ3 страницыInforme de Laboratorio 1MARIA DEL MAR LOPEZ LONDOÑOОценок пока нет
- Fluidos Newtonianos Lizano Moreno TelenchanaДокумент7 страницFluidos Newtonianos Lizano Moreno TelenchanaVanessa PerezОценок пока нет
- Deber Soluciones y Coligativas PDFДокумент8 страницDeber Soluciones y Coligativas PDFBBОценок пока нет
- Informe Destilacion FraccionadaДокумент6 страницInforme Destilacion FraccionadaAlejandra Carvajal DiazОценок пока нет
- Costos y Fenómenos ExpoiquiДокумент5 страницCostos y Fenómenos Expoiquilola pickmanОценок пока нет
- Practica 3 AiДокумент7 страницPractica 3 AiBrian Negrete sanchezОценок пока нет
- Equilibrio Líquido Vapor en Sistemas BinariosДокумент32 страницыEquilibrio Líquido Vapor en Sistemas BinariosAranza SantosОценок пока нет
- Destilacion Sencilla y FraccionadaДокумент6 страницDestilacion Sencilla y Fraccionadaangie santanaОценок пока нет
- Informe 3 DestilaciónДокумент10 страницInforme 3 DestilaciónNicolas BuitragoОценок пока нет
- Miscibilidad Parcial MutuaДокумент8 страницMiscibilidad Parcial MutuaSantiagoОценок пока нет
- CCP02 - Propiedades Del Estado LíquidoДокумент3 страницыCCP02 - Propiedades Del Estado Líquidocelestechinchilla27Оценок пока нет
- Informe 2 DibenzalcetonaДокумент10 страницInforme 2 DibenzalcetonaSerwin Elias Suazo BajañaОценок пока нет
- Wuolah Free PRACTICA 2Документ4 страницыWuolah Free PRACTICA 2Eduardo CerezoОценок пока нет
- Practica 3. Determinación de Carbonatos y Bicarbonatos en Mexcla de AmbosДокумент12 страницPractica 3. Determinación de Carbonatos y Bicarbonatos en Mexcla de AmbosGabriela RamirezОценок пока нет
- Reporte 4Документ3 страницыReporte 4DAVID EMMANUEL PEREZ CRUZОценок пока нет
- Destilacion Simple y FracionadaДокумент9 страницDestilacion Simple y Fracionadaanon_219390624Оценок пока нет
- Diels AldersДокумент14 страницDiels AldersMiguel MGОценок пока нет
- 2-Extraccion Directa A Reflujo en SoxhleДокумент6 страниц2-Extraccion Directa A Reflujo en SoxhleHector Villarroel0% (1)
- Practica 5 Obtencion de AnilinaДокумент2 страницыPractica 5 Obtencion de AnilinaBenjamin CastilloОценок пока нет
- 2 FenilindolДокумент20 страниц2 FenilindolAna Soffia Gomez AriasОценок пока нет
- ADA1. Problemario Introducción A QAДокумент7 страницADA1. Problemario Introducción A QAAlejandrp Josue Cardeña BenitezОценок пока нет
- Torres, O.Maldonado, E.Efecto de La Temperatura y Tiempo Sobre El Contenido de Antocianinas (AOAC, 2005.2)Документ4 страницыTorres, O.Maldonado, E.Efecto de La Temperatura y Tiempo Sobre El Contenido de Antocianinas (AOAC, 2005.2)Oswaldo TorresОценок пока нет
- Bernal Domenica-Practica 2Документ5 страницBernal Domenica-Practica 2DOMENICA MICAELA BERNAL AVILAОценок пока нет
- Informe 5Документ8 страницInforme 5mayledОценок пока нет
- Informe 5Документ6 страницInforme 5MariaPaulaGonzalezRojasОценок пока нет
- Obtencion BenzoinaДокумент2 страницыObtencion BenzoinaLili RosalesОценок пока нет
- ABSORCIÓNДокумент2 страницыABSORCIÓNLili RosalesОценок пока нет
- Generador de Hidruros - Interferencia de IonizaciónДокумент22 страницыGenerador de Hidruros - Interferencia de IonizaciónLili RosalesОценок пока нет
- Interferencia de Ionizacion (Final)Документ17 страницInterferencia de Ionizacion (Final)Lili RosalesОценок пока нет
- Interferencia de Ionizacion (Final)Документ17 страницInterferencia de Ionizacion (Final)Lili RosalesОценок пока нет
- Practica 1 BenzhidrolДокумент12 страницPractica 1 BenzhidrolLili RosalesОценок пока нет
- Generador de HidrurosДокумент1 страницаGenerador de HidrurosLili RosalesОценок пока нет
- Propiedades de La FenolftaleínaДокумент3 страницыPropiedades de La FenolftaleínaLili RosalesОценок пока нет
- Metodo de Hardy CrossДокумент16 страницMetodo de Hardy CrossRaul Del Castillo PerezОценок пока нет
- Azucar 2019Документ25 страницAzucar 2019Reynaldo Carlos MendozaОценок пока нет
- LIPIDOSДокумент1 страницаLIPIDOSJacqueline Susana Sedano SotoОценок пока нет
- Carro Seguidor de LineaДокумент18 страницCarro Seguidor de LineaJorgeОценок пока нет
- FORMALIZACIONДокумент3 страницыFORMALIZACIONMARIOОценок пока нет
- Molalidad y MolaridadДокумент4 страницыMolalidad y Molaridadfelixdavidleiva6520Оценок пока нет
- Practica 9 - Quimica Organica Analitica FuncionalДокумент21 страницаPractica 9 - Quimica Organica Analitica FuncionalcristianОценок пока нет
- Conservación de Los AlimentosДокумент2 страницыConservación de Los AlimentosAndres BgОценок пока нет
- Anexo 01Документ57 страницAnexo 01ricardodelatorreОценок пока нет
- Nom 014 Scfi 1997Документ15 страницNom 014 Scfi 1997isidriskyОценок пока нет
- Concreto Armado II Semana 4Документ40 страницConcreto Armado II Semana 4Yan Carlo Huaman QuispeОценок пока нет
- Historia Herbolaria y PiratasДокумент14 страницHistoria Herbolaria y PiratasMauricio Toledo100% (1)
- Modelación de La Calidad Del AireДокумент10 страницModelación de La Calidad Del AireWilmanJavierCaceresLunaОценок пока нет
- Cta3-2018-Sesion 09 Tabla Periódica Practica CalificadaДокумент7 страницCta3-2018-Sesion 09 Tabla Periódica Practica CalificadaAnnye VicntОценок пока нет
- Hidrodestilacion Asistida Por MicroondasДокумент5 страницHidrodestilacion Asistida Por MicroondasNelly Johanna Soto Castañeda100% (2)
- Estudio de SuelosДокумент55 страницEstudio de SuelosRamiro GarciaОценок пока нет
- Bombeo Por Cavidades ProgresivasДокумент33 страницыBombeo Por Cavidades ProgresivaseliaslandivarОценок пока нет
- PreinformeДокумент14 страницPreinformeMaria Isabel Hurtado BernalОценок пока нет
- CCNN - 1 ESO - MEC - Adaptacion Curricular PDFДокумент13 страницCCNN - 1 ESO - MEC - Adaptacion Curricular PDFCarmen Peña ValtueñaОценок пока нет
- Producción de Yogur A Nivel IndustrialДокумент4 страницыProducción de Yogur A Nivel Industrialstev1990Оценок пока нет
- Estructuras de Concreto PresforzadoДокумент71 страницаEstructuras de Concreto PresforzadoGustavo CervantesОценок пока нет
- Guía #4 SUSTANCIAS PURAS Y MEZCLAS 7° BÁSICOДокумент5 страницGuía #4 SUSTANCIAS PURAS Y MEZCLAS 7° BÁSICObarbaraОценок пока нет
- Usmp Sem Lipidos 2011Документ4 страницыUsmp Sem Lipidos 2011Juan Miguel Del SolarОценок пока нет
- Presentacion ProducДокумент36 страницPresentacion ProducLimbert Contacayo Apaza100% (1)
- GD 2001-2002 MedicinaДокумент331 страницаGD 2001-2002 MedicinaAlexander León Puello0% (1)
- Ecuación de Clapeyron-ClausiusДокумент4 страницыEcuación de Clapeyron-ClausiusLitzy HernandezОценок пока нет
- Problema 1un Recipiente de 120 ML de Capacidad Contiene Una Cierta Cantidad de Gas A 35Документ7 страницProblema 1un Recipiente de 120 ML de Capacidad Contiene Una Cierta Cantidad de Gas A 35Anonymous 4W67juldОценок пока нет
- Laboratorio 1Документ13 страницLaboratorio 1Mark Escalante CotrinaОценок пока нет