Академический Документы
Профессиональный Документы
Культура Документы
Equilibrio Quimico KC e KP
Загружено:
jparaty0 оценок0% нашли этот документ полезным (0 голосов)
210 просмотров2 страницыEquilibrio Quimico Kc e Kp
Оригинальное название
Equilibrio Quimico Kc e Kp
Авторское право
© © All Rights Reserved
Доступные форматы
PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документEquilibrio Quimico Kc e Kp
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
210 просмотров2 страницыEquilibrio Quimico KC e KP
Загружено:
jparatyEquilibrio Quimico Kc e Kp
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 2
EQUILÍBRIO QUÍMICO Kc
EQUILÍBRIO QUÍMICO: É a particular situação para a OBSERVAÇÕES:
qual tendem os sistemas de reações reversíveis em que a 1 – Substâncias em solução aquosa e gases aparecem
velocidade da reação direta (v1) iguala-se à velocidade da na expressão da constante de equilíbrio(Kc).
reação inversa (v2), sob uma temperatura constante. 2 – Substâncias gasosas aparecem na expressão da
constante de equilíbrio em termos de pressões
REAÇÃO REVERSÍVEL: É a reação que ocorre no parciais(Kp).
3 – Substâncias sólidas e líquidas(solventes) não
sentido direto, quando os reagentes formam os produtos,
aparecem na expressão da constante de equilíbrio.
e no sentido inverso, quando os produtos reagem entre si
4 – Kc não varia com a concentração nem com a pressão,
para formar os reagentes.
mas varia com a temperatura.
5 – Quanto maior o Kc, maiores são as concentrações dos
produtos em relação às dos reagentes, no equilíbrio.
CARACTERÍSTICAS GERAIS DE UM SISTEMA EM
Dizemos que essa reação é reversível e representamos EQUILÍBRIO:
essa reação com duas flechas em sentido contrário: 1. A velocidade da reação direta tem que ser igual à
velocidade da reação inversa.
2. O equilíbrio é dinâmico e não estático como aparenta
aA + bB cC + dD ser.
3. Após atingir o equilíbrio químico, as concentrações de
Em que V1 expressa a velocidade da reação direta e V2 à cada participante no equilíbrio não mais se alteram.
velocidade da reação inversa. Essas velocidades após
certo tempo se igualam, e quando isso acontecer, CLASSIFICAÇÃO DO EQUILÍBRIO QUÍMICO
teremos um equilíbrio e podemos escrever. 1. QUANTO AO TIPO DE SISTEMA:
A) EQUILÍBRIO HOMOGÊNEO – Trata-se de um
equilíbrio constituído de uma única fase (monofásico).
Exemplo:
H2(g) + CO2(g) → H2O(g) + CO(g)
B) EQUILÍBRIO HETEROGÊNEO – Trata-se de um
sistema em equilíbrio constituído por mais de uma fase.
Exemplo:
C(s) + H2O(g) → H2(g) + CO(g)
2. QUANTO À NATUREZA DAS PARTÍCULAS EM
EQUILÍBRIO:
CONSTANTE DE EQUILÍBRIO-keq: Se no gráfico A) EQUILÍBRIO MOLECULAR – Trata-se de um
acima V1 e V2 se igualam num determinado tempo (t) sistema em equilíbrio constituído somente por moléculas.
podemos escrever a constante de equilíbrio em termos de Exemplo:
concentrações molares (Kc) ou pressões parciais (Kp). 2NO2(g) → N2O4(g)
Escrevemos então:
:
B) EQUILÍBRIO IÔNICO – Trata-se de um sistema em
equilíbrio, em que há pelo menos um íon.
Exemplo:
2CrO2-4(aq)+ 2H3O1+(aq) → Cr2O2-7(aq)+3H2O(l)
EXERCÍCIOS PARA OS VENCEDORES:
01. Bicarbonato de sódio sólido é usado como fermento
químico porque se decompõe termicamente, formando
gás carbônico, de acordo com a reação representada pela
equação química:
2NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(g)
Escreva a expressão matemática para a constante de
equilíbrio expressa em termos de concentração (Kc) e em
termos de pressões parciais (Kp).
01. Os óxidos de nitrogênio desempenham um papel RESOLUÇÕES:
chave na formação de "smog fotoquímico". A queima de
combustíveis a alta temperatura é a principal fonte de
óxidos de nitrogênio. Quantidades detectáveis de óxido
nítrico são produzidas pela reação em equilíbrio:
N2(g) + 02(g) ↔ 2NO(g)
Supondo o sistema em equilíbrio e que numa
determinada temperatura as pressões parciais dos gases
em equilíbrio são iguais a: PNO=0,1atm; PN2 = 0,2atm; PO2
= 0,01atm, indique o valor correto da constante de
equilíbrio (Kp).
02. Há dois sistemas gasosos em equilíbrio, cujas
constantes de equilíbrio são dadas pelas expressões (I) e
(II) a seguir:
Nessas condições escreva a equação química para cada
um dos sistemas em equilíbrio.
03. Atualmente, o processo industrial utilizado para a
fabricação de H2SO4 é chamado "processo de contacto".
Nesse processo, o enxofre é queimado originando SO2(g).
Este gás, juntamente com O2(g), é introduzido num
conversor catalítico, quando ocorre a reação:
2 SO2(g) + O2(g) → 2 SO3(g)
Supondo que o espaço livre do conversor seja de 400
litros e nele estejam confinados 80 mol SO2, 120mol de
O2 e 200mol de SO3 sob dadas condições de pressão e
temperatura, calcule o valor de Kc para a reação acima
representada.
04. A altas temperaturas, N2 reage com O2 produzindo
NO, um poluente atmosférico:
N2(g) + O2(g) → 2NO(g)
À temperatura de 2000 kelvins, a constante do equilíbrio
acima é igual a 4,0x10-4. Nesta temperatura, se as
concentrações de equilíbrio de N2 e O2 forem,
respectivamente, 4,0x10-3 e 1,0x10-3mol/L, qual será a de
NO?
05. A decomposição em fase gasosa, a 250°C,
representada pela equação PCl5(g) → PCl3(g) + Cl2(g)
apresenta uma constante de equilíbrio Kc = 0,04. A
respeito da reação foram levantados os seguintes dados
de concentrações molares no equilíbrio:
[PCl5(g)] = 1,5 mol/L, [Cl2(g)] = 0,3 mol/L
A concentração molar de PCl3(g) no equilíbrio é:
a) 125 mol/L
b) 37,2 mol/L
c) 1,2 mol/L
d) 0,3 mol/L
e) 0,2 mol/L
REVISÃO IMPACTO - A CERTEZA DE VENCER!!!
Вам также может понравиться
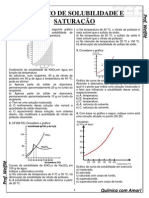
- Coeficiente de Solubilidade e Tipos de SaturaçãoДокумент5 страницCoeficiente de Solubilidade e Tipos de SaturaçãoWelff Junior100% (2)
- Soluções São Misturas HomogêneasДокумент6 страницSoluções São Misturas HomogêneasMabelle Pereira Costa PaivaОценок пока нет
- (Apostila) Química Orgânica - CETEBДокумент110 страниц(Apostila) Química Orgânica - CETEBEduardo Bandeira50% (2)
- Lista Nº1 2º Ano 2014 GabaritoДокумент8 страницLista Nº1 2º Ano 2014 GabaritoMarcelo Nunes da PaixãoОценок пока нет
- Apostila Físico-Química1Документ29 страницApostila Físico-Química1Diego E MarinaОценок пока нет
- Soluções (Slide)Документ58 страницSoluções (Slide)Felipe QueirozОценок пока нет
- Lista - Química TermoquímicaДокумент3 страницыLista - Química Termoquímicaothonf2Оценок пока нет
- Funções Inorgânicas ApostilaДокумент11 страницFunções Inorgânicas ApostilaPriscila Tibúrcio100% (1)
- (AULA 08 E 09) Reações Orgânicas (Adição, Substituição, Eliminação)Документ7 страниц(AULA 08 E 09) Reações Orgânicas (Adição, Substituição, Eliminação)Jonathan AraujoОценок пока нет
- Reações Químicas - Classificação e BalanceamentoДокумент41 страницаReações Químicas - Classificação e BalanceamentoJoão Valdir Miranda100% (1)
- Lista de Exercícios Termoquímica Profa. RegianeДокумент8 страницLista de Exercícios Termoquímica Profa. RegianeCaroline Paglia Nadal0% (1)
- NomenclaturadoshidrocarbonetosДокумент24 страницыNomenclaturadoshidrocarbonetossidneypcostaОценок пока нет
- Lista Exercícios Intro Química OrgânicaДокумент6 страницLista Exercícios Intro Química OrgânicaCarlos WestrupОценок пока нет
- Revisão de Leis Ponderais ProfДокумент2 страницыRevisão de Leis Ponderais ProfClebson RamosОценок пока нет
- Química - Propriedades Da Matéria - Teste AprofundamentoДокумент12 страницQuímica - Propriedades Da Matéria - Teste AprofundamentoJakline GuittonОценок пока нет
- Reações Orgânicas - Classificação - 15 QuestõesДокумент7 страницReações Orgânicas - Classificação - 15 QuestõesProfAlexandreOliveiraIIОценок пока нет
- Cinetica Quimica UniДокумент6 страницCinetica Quimica UnicarlostucupiОценок пока нет
- EQUILÍBRIO QUÍMICO GpsДокумент52 страницыEQUILÍBRIO QUÍMICO GpsVindictae50% (4)
- Química Lista 02 - Propriedades ColigativasДокумент14 страницQuímica Lista 02 - Propriedades ColigativasHugo CimehrioОценок пока нет
- Atividade Classificação Das Soluções - NoturnoДокумент2 страницыAtividade Classificação Das Soluções - NoturnoMarina Ramos100% (1)
- Reações Orgânicas de Oxidação e Redução - SLIDESДокумент36 страницReações Orgânicas de Oxidação e Redução - SLIDESAndré Mauricio De Oliveira100% (1)
- Bloco 2 Aula 14 Termoquímica Lei de HessДокумент3 страницыBloco 2 Aula 14 Termoquímica Lei de HessMax NunesОценок пока нет
- Introdução Organica ProfessorДокумент45 страницIntrodução Organica ProfessorHerivelton XavierОценок пока нет
- Malu Fisica e Quimica 9o MarcoДокумент26 страницMalu Fisica e Quimica 9o MarcoClaudiaPennaОценок пока нет
- Resumo Sobre SoluçõesДокумент19 страницResumo Sobre SoluçõesFabíola FelixОценок пока нет
- EnsMed Quimica 3ano Slides Aula 01Документ49 страницEnsMed Quimica 3ano Slides Aula 01Antonio WesleyОценок пока нет
- Exericicios InorganicaДокумент3 страницыExericicios InorganicaRones DiasОценок пока нет
- Gama - Módulo 35 PDFДокумент23 страницыGama - Módulo 35 PDFVanessa Menezes TheodoroОценок пока нет
- Ligações Químicas 2 Resumo e Exercícios - GabaritoДокумент5 страницLigações Químicas 2 Resumo e Exercícios - GabaritoMonteiroОценок пока нет
- Bloco 2 Aula 11 e 12 Propriedades ColigativasДокумент5 страницBloco 2 Aula 11 e 12 Propriedades ColigativasMax NunesОценок пока нет
- Cinetica QuimicaДокумент24 страницыCinetica QuimicaAdriana Bemstar100% (1)
- Questões Sobre TermoquímicaДокумент7 страницQuestões Sobre Termoquímicagrodriguesbaltica17Оценок пока нет
- Reacoes QuimicasДокумент42 страницыReacoes Quimicasmagno garciaОценок пока нет
- Marista - Química - 2 Série - 1 Etapa - Atividade 1 - Tipos de MassasДокумент2 страницыMarista - Química - 2 Série - 1 Etapa - Atividade 1 - Tipos de MassasRenan Barcelos MendesОценок пока нет
- Eletroquimica - PilhasДокумент7 страницEletroquimica - PilhasMeu MundinhoОценок пока нет
- 244936-Apostila de Exercícios ORGÃNICA SUBSEQUENTEДокумент28 страниц244936-Apostila de Exercícios ORGÃNICA SUBSEQUENTEClarissa Mapelli CorassaОценок пока нет
- Molaridade Ou Concentração em Quantidade de MatériaДокумент3 страницыMolaridade Ou Concentração em Quantidade de MatériaRafaella da Costa BonalumeОценок пока нет
- 22 TermoquimicaДокумент5 страниц22 TermoquimicaLuma MagnagoОценок пока нет
- Exercicios o Carbono e CadeiasДокумент7 страницExercicios o Carbono e Cadeiasjbarb2011Оценок пока нет
- Quimica Teoria18 Cinetica QuimicaДокумент3 страницыQuimica Teoria18 Cinetica Quimicaana_nery100% (1)
- Lista de Quantidade de MatériaДокумент2 страницыLista de Quantidade de MatériaRtyu IuytОценок пока нет
- ED Dispersão CorreçãoДокумент1 страницаED Dispersão CorreçãoClayton LuizОценок пока нет
- Substâncias Puras - Fundamentos e Diagrama de FasesДокумент15 страницSubstâncias Puras - Fundamentos e Diagrama de FasesJamily JardimОценок пока нет
- Química - Pré-Vestibular Impacto - Agente Oxidante e Agente RedutorДокумент2 страницыQuímica - Pré-Vestibular Impacto - Agente Oxidante e Agente RedutorQuímica QuiОценок пока нет
- Gama - Módulo 44Документ29 страницGama - Módulo 44Anonymous aVit0RyXОценок пока нет
- Cinética Química Parte I - 2º AnoДокумент18 страницCinética Química Parte I - 2º AnoAlessandra Valença100% (1)
- Modelos Atomicos ListaДокумент5 страницModelos Atomicos ListaAlan BaloniОценок пока нет
- Lista de Exercícios - TermoquímicaДокумент9 страницLista de Exercícios - TermoquímicaalexchacalОценок пока нет
- Aula #01 - SoluçõesДокумент14 страницAula #01 - SoluçõesAnna Luiza LopesОценок пока нет
- Preparo de SoluçõesДокумент36 страницPreparo de SoluçõesJanice Ferreira100% (1)
- Thomas Vest F2 Aula 22 Equilibrio Quimico Kce KPДокумент2 страницыThomas Vest F2 Aula 22 Equilibrio Quimico Kce KPPaula AyabeОценок пока нет
- Equilíbrio QuímicoДокумент43 страницыEquilíbrio QuímicoSarah MartinsОценок пока нет
- Apostila Equilíbrio QuímicoДокумент5 страницApostila Equilíbrio QuímicoAmanda SoteroОценок пока нет
- Química Analítica Qualitativa I (3a Aula Equilibrio) PDFДокумент37 страницQuímica Analítica Qualitativa I (3a Aula Equilibrio) PDFJonatha SantosОценок пока нет
- Equilíbrio Químico 2Документ52 страницыEquilíbrio Químico 2Sergio Gabriel Souza ZanonОценок пока нет
- 5 - Equilíbrio QuímicoДокумент40 страниц5 - Equilíbrio QuímicoAdemir PereiraОценок пока нет
- 151417-AULA - IFRN-equil - Quim - 1 - 1Документ41 страница151417-AULA - IFRN-equil - Quim - 1 - 1Débora WeberОценок пока нет
- Equilibrio QuimicoДокумент44 страницыEquilibrio QuimicoJohnatas MathewsОценок пока нет
- Equilibrio Químico 1pptДокумент73 страницыEquilibrio Químico 1pptamanda mirandaОценок пока нет
- Equilibrio Quimico 1Документ7 страницEquilibrio Quimico 1Leonel PaulinoОценок пока нет
- DISPERSOESДокумент32 страницыDISPERSOESjparatyОценок пока нет
- Propriedades Periodicas 2Документ30 страницPropriedades Periodicas 2jparatyОценок пока нет
- Leis PonderaisДокумент30 страницLeis PonderaisjparatyОценок пока нет
- Calculo Estequiometrico 3Документ34 страницыCalculo Estequiometrico 3jparatyОценок пока нет
- OXIDOSДокумент38 страницOXIDOSjparatyОценок пока нет
- Principio de LechatelierДокумент34 страницыPrincipio de LechatelierjparatyОценок пока нет
- Cinetica RadioativaДокумент38 страницCinetica RadioativajparatyОценок пока нет
- Acidos 2Документ32 страницыAcidos 2jparatyОценок пока нет
- Ac Carboxilico e EterДокумент30 страницAc Carboxilico e EterjparatyОценок пока нет
- Acidos 2Документ32 страницыAcidos 2jparatyОценок пока нет
- Propriedades Periodicas 2Документ30 страницPropriedades Periodicas 2jparatyОценок пока нет
- Calculo Estequiometrico 3Документ34 страницыCalculo Estequiometrico 3jparatyОценок пока нет
- Balanceamento RedoxДокумент40 страницBalanceamento RedoxjparatyОценок пока нет
- Química - Pré-Vestibular Impacto - Estrutura AtômicaДокумент2 страницыQuímica - Pré-Vestibular Impacto - Estrutura AtômicaQuímica Qui100% (5)
- 64 20isomeria 20espacial 20 C3 B3pticaДокумент11 страниц64 20isomeria 20espacial 20 C3 B3pticajparatyОценок пока нет
- Química - Pré-Vestibular Impacto - Introdução Às ReaçõesДокумент2 страницыQuímica - Pré-Vestibular Impacto - Introdução Às ReaçõesQuímica Qui100% (1)
- Quimica Pre Vestibular Impacto Oxidacao e ReducaoДокумент2 страницыQuimica Pre Vestibular Impacto Oxidacao e ReducaojparatyОценок пока нет
- Química - Pré-Vestibular Impacto - Ligação CovalenteДокумент2 страницыQuímica - Pré-Vestibular Impacto - Ligação CovalenteQuímica Qui100% (1)
- Spicer Diferenciais PDFДокумент30 страницSpicer Diferenciais PDFBrunoMarrocosMouraОценок пока нет
- Química - Pré-Vestibular Impacto - Introdução Às ReaçõesДокумент2 страницыQuímica - Pré-Vestibular Impacto - Introdução Às ReaçõesQuímica Qui100% (1)
- LISTA DE EXERCÍCIOS - Isomeria Óptica PDFДокумент5 страницLISTA DE EXERCÍCIOS - Isomeria Óptica PDFjparatyОценок пока нет
- Isomeria Óptica PDFДокумент80 страницIsomeria Óptica PDFjparatyОценок пока нет
- Pilar 1Документ3 страницыPilar 1jparatyОценок пока нет
- Isomeria Óptica PDFДокумент80 страницIsomeria Óptica PDFjparatyОценок пока нет
- Velocidade Média de Uma ReaçãoДокумент34 страницыVelocidade Média de Uma ReaçãoDébora Alvim0% (1)
- Experimentos Virtuais Na Área de Química Com Realidade AumentadaДокумент76 страницExperimentos Virtuais Na Área de Química Com Realidade AumentadajparatyОценок пока нет
- Mol E Massa MolarДокумент79 страницMol E Massa MolarLuciana De Oliveira LinoОценок пока нет
- Lista de Química p1 1 Série 2 BimestreДокумент6 страницLista de Química p1 1 Série 2 BimestrejparatyОценок пока нет
- Lista de Exercicios Cinetica QuimicaДокумент4 страницыLista de Exercicios Cinetica QuimicaRodrigo MontesОценок пока нет
- Alcoois 01Документ5 страницAlcoois 01jparatyОценок пока нет
- Curriculo Basico 3 Edicao 2015Документ294 страницыCurriculo Basico 3 Edicao 2015Alessandra Santos FrazatoОценок пока нет
- Area de Uma Regiao Limitada Por Duas CurvasДокумент15 страницArea de Uma Regiao Limitada Por Duas CurvasLuiz Rogério Monteiro LimaОценок пока нет
- Capitulo9 - Correias Shigley PDFДокумент12 страницCapitulo9 - Correias Shigley PDFJohn HavaianoОценок пока нет
- A Existencia Encarnada de MounierДокумент17 страницA Existencia Encarnada de MounierRubensОценок пока нет
- Dimensionamento de BateriasДокумент50 страницDimensionamento de BateriasLécio G. Matos Matos100% (1)
- Catalogo - IOM CGAD (CGAD SVN02 PT0712)Документ107 страницCatalogo - IOM CGAD (CGAD SVN02 PT0712)inggavОценок пока нет
- SDFДокумент5 страницSDFVinicius VozniekОценок пока нет
- Mrotaer 20140102sssssДокумент61 страницаMrotaer 20140102sssssDiego GomesОценок пока нет
- Capitulo 6Документ31 страницаCapitulo 6Geraldo NetoОценок пока нет
- FPS 2019.2 2º Dia ProvaДокумент13 страницFPS 2019.2 2º Dia ProvaPriscilla LimaОценок пока нет
- Educação Física BNCCДокумент5 страницEducação Física BNCCEuder Pereira100% (1)
- ABNT NBR 7187 21 Projeto de Pontes de Concreto Armado e de Concreto ProtendidoДокумент82 страницыABNT NBR 7187 21 Projeto de Pontes de Concreto Armado e de Concreto Protendidokuroski201075% (4)
- Verniz Renner BT 0848Документ3 страницыVerniz Renner BT 0848Suelen MilanezОценок пока нет
- Análise Temática PDFДокумент13 страницAnálise Temática PDFGeraldo Martins100% (3)
- Oceanografia - Aula 1 GeomorfologiaДокумент53 страницыOceanografia - Aula 1 GeomorfologiaJadson FreireОценок пока нет
- 16 - Lista 7 - Física IIIДокумент4 страницы16 - Lista 7 - Física IIIItalo RiccelliОценок пока нет
- LajesДокумент4 страницыLajesAltair AlvesОценок пока нет
- Cat Obra PublicaДокумент70 страницCat Obra Publicaec04017Оценок пока нет
- Aula Entropia PDFДокумент22 страницыAula Entropia PDFAlexandre vilãoОценок пока нет
- Apostila Armamento CFSDДокумент34 страницыApostila Armamento CFSDRamon Domingues WellnerОценок пока нет
- Metodo de Gauss PDFДокумент5 страницMetodo de Gauss PDFFrancisca Silva100% (1)
- Monografia Conclusao de Curso de Comunicaçao SocialДокумент54 страницыMonografia Conclusao de Curso de Comunicaçao SocialMasurf100% (7)
- 3 TandenДокумент3 страницы3 TandenRomulo PimentaОценок пока нет
- A Correlação Corpo-Alma Platônica, Uma Interpretação PossívelДокумент12 страницA Correlação Corpo-Alma Platônica, Uma Interpretação PossíveljoaquicarlosОценок пока нет
- Prática 3 - Dosagem Do Concreto de Alto Desempenho (Cad) - Converted - by - AbcdpdfДокумент7 страницPrática 3 - Dosagem Do Concreto de Alto Desempenho (Cad) - Converted - by - AbcdpdfDiego SulinoОценок пока нет
- Date A Live Volume 4Документ218 страницDate A Live Volume 4Matheus GomesОценок пока нет
- Apdd 735 - 125-200hp Serie BДокумент48 страницApdd 735 - 125-200hp Serie BsmcompressoresОценок пока нет
- Ssa 1 - 2014Документ4 страницыSsa 1 - 2014Silvia Campos CamposОценок пока нет
- Nouvelle Vague SoviéticaДокумент85 страницNouvelle Vague SoviéticaEwerton BelicoОценок пока нет
- CNS 045 13Документ1 страницаCNS 045 13engenharia_carlosОценок пока нет