Академический Документы
Профессиональный Документы
Культура Документы
Activité Suivi Temporel Par Titrage
Загружено:
Aicha Daou100%(1)100% нашли этот документ полезным (1 голос)
1K просмотров1 страницаmkjjj
Авторское право
© © All Rights Reserved
Доступные форматы
PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документmkjjj
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF, TXT или читайте онлайн в Scribd
100%(1)100% нашли этот документ полезным (1 голос)
1K просмотров1 страницаActivité Suivi Temporel Par Titrage
Загружено:
Aicha Daoumkjjj
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 1
CHIMIE / Unité :1
LA TRANSF. D'UN
SYSTEME CHIMIQUE
EST-ELLE TOUJOURS
RAPIDE
Technique de titrage
A l’instant t = 0 s, on mélange dans un erlenmeyer un volume V1=50,0mL d’eau oxygénée H2O2 (solution
réaction étudié
aqueuse de peroxyde d’hydrogène), de concentration C1= 0,056.mol.L-1, avec un volume V2 =50,0mL de
solution aqueuse d’iodure de potassium (K+(aq)+I-(aq)) , de concentration en soluté apporté C2=0,20mol.L-1,
ainsi que 1mL d’acide sulfurique de concentration [H+(aq)] =3,0 mol.L-1.On répartit le mélange réactionnel
dans 10 béchers, à raison d’un volume V=10,0mL par bécher.
1-Ecrire l’équation bilan de la réaction étudié (1), sachant que les couples mise en jeu est : I2/I- ; H2O2/H2O .
A l’instant de date t = 60s, on ajoute rapidement de l’eau glacée dans le premier
bécher et on dose le diiode formé à l’aide d’une solution aqueuse de thiosulfate
de potassium (2K+ + S2O32-) de concentration en soluté apporté C=0,04 mol.L-1
Technique de mesure
en présence de quelques gouttes d’empois d’amidon (qui colore en bleu une
solution contenant du diiode).
Soit VE le volume de thiosulfate versé pour atteindre l’équivalence. On
renouvelle l’opération successivement sur le deuxième puis sur le troisième
bécher, etc. les résultat est donné au tableau ci-dessous
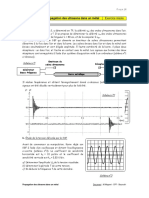
t(s) 0 60 160 270 360 510 720 900 1080 1440 1800
VE(mL) 0 2,2 4,8 6,5 7,5 9,0 10,5 11,6 12,3 13,5 14,0
2-La transformation mise en jeu dans le titrage est rapide, totale, Ecrire son équation. (transformation (2) de
technique )on donne les couples S4O62-/S2O32- et I2/I-
3- Pourquoi ajoute-t-on de l’eau glacée rapidement à l’instant t dans chaque bécher ?
4- A partir de l’équation de la réaction de titrage (2), écrire la relation donnant la quantité de matière de
diiode n’(I2) apparu dans chaque bécher à l’instant t en fonction de la concentration de réactif titrant C et du
volume versé à l’équivalence VE, puis en déduire la quantité de matière de diiode n(I2) apparu dans le
mélange réactionnel à l’instant t
5-Dresser le tableau d’avancement de la réaction correspond à la transformation étudiée (1) et déterminer
l’expression de la quantité de matière n (I2) du diiode formée à l’instant t en fonction de l’avancement x .
5- Préciser la relation entre l’avancement de la réaction (1) à chaque instant et la quantité de matière de
diiode formé, et complété le tableau
t(s) 0 60 160 270 360 510 720 900 1080 1440 1800
x(mol)
- A l’aide des résultats expérimentaux et d’un tableur on obtient le graphe x = f (t) ci-contre
Les résultats
6-Déterminer graphiquement la vitesse volumique de réaction à l’instant t=0 et t=1000s,
7- Comment varie la vitesse au cours du temps lors de cette transformation chimique ? Donner une interprétation
de cette variation.
8- déterminer graphiquement le temps de demi-réaction t1/2 : « temps au bout duquel l’avancement a atteint la moitié
de sa valeur maximale ».
www.hammoumouna.jimdo.com
Вам также может понравиться
- Exercice 9 Suivi Temporel Dune Transformation ChimiqueДокумент1 страницаExercice 9 Suivi Temporel Dune Transformation ChimiqueCatuk Ella100% (2)
- Série D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDДокумент8 страницSérie D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDMoulayMouly100% (6)
- Série Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Документ4 страницыSérie Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Aicha DaouОценок пока нет
- Série N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Документ14 страницSérie N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Ltaief Chayma100% (2)
- Série D'exercices Vitesse de RéactionДокумент4 страницыSérie D'exercices Vitesse de Réactionothmane GbОценок пока нет
- 02-Vitesse SerieДокумент5 страниц02-Vitesse SerieboustakatbОценок пока нет
- Devoir 2 1 Bac SM PDFДокумент3 страницыDevoir 2 1 Bac SM PDFAddi Yakooubi50% (2)
- Cont 1 s1 PC 2 Bac Prof - Filali (WWW - Pc1.ma)Документ1 страницаCont 1 s1 PC 2 Bac Prof - Filali (WWW - Pc1.ma)said youssfiОценок пока нет
- Les Exams Nationaux PC 2008-2019Документ164 страницыLes Exams Nationaux PC 2008-2019바드 에딘Оценок пока нет
- Cours de Soir Biof Final 2 SemestreДокумент88 страницCours de Soir Biof Final 2 SemestreMohamed El OuahdaniОценок пока нет
- Examens de MécaniqueДокумент18 страницExamens de MécaniqueAicha DaouОценок пока нет
- Physique Cours 1 BAC BIOF WWW - Chtoukaphysique - 3Документ35 страницPhysique Cours 1 BAC BIOF WWW - Chtoukaphysique - 3Nourii Nour-dine0% (1)
- Resumé Suivi Temporel D'une Transformation ChimiqueДокумент1 страницаResumé Suivi Temporel D'une Transformation ChimiqueZakaria BelaaroussiОценок пока нет
- Examen Blanc Physique Chimie Bac DДокумент4 страницыExamen Blanc Physique Chimie Bac Dkouassi hermann ulrich koffi100% (1)
- 1bac Biof Exos de ChimieДокумент1 страница1bac Biof Exos de Chimierihab100% (2)
- Ultrasons MétalДокумент4 страницыUltrasons MétalAicha Daou100% (6)
- TD Lorentz 2019 LSLL WahabdiopДокумент4 страницыTD Lorentz 2019 LSLL Wahabdiopbip100% (1)
- Lois de Newton Exercices Non Corriges 2 2Документ6 страницLois de Newton Exercices Non Corriges 2 2hicham lahdissouОценок пока нет
- DC3 (19 04 08)Документ6 страницDC3 (19 04 08)Seif Souid100% (3)
- 2Bm 16-17-S1 Ds1A Belkhatir FRДокумент3 страницы2Bm 16-17-S1 Ds1A Belkhatir FRBaba Mhd Yara0% (1)
- Cours - Chimie - RESUME DU COUR ESTERIFICATION - Bac Sciences Exp (2015-2016) MR Daghsni SahbiДокумент3 страницыCours - Chimie - RESUME DU COUR ESTERIFICATION - Bac Sciences Exp (2015-2016) MR Daghsni SahbiMohamed Hamdene100% (2)
- Devoir N 1SII 2021 Bac BiofДокумент4 страницыDevoir N 1SII 2021 Bac Biofالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Série D'exercices - Sciences Physiques Dipôle RC - Bac Technique (2011-2012) MR FRADIДокумент2 страницыSérie D'exercices - Sciences Physiques Dipôle RC - Bac Technique (2011-2012) MR FRADIWiem Benchahboun0% (1)
- C2Phy Ondes Mecaniques Progressives Periodiques PDFДокумент2 страницыC2Phy Ondes Mecaniques Progressives Periodiques PDFAzizElheniОценок пока нет
- Devoir 2 Hikma 2020 2bac SM Prof - Kraidy (WWW - Pc1.ma)Документ4 страницыDevoir 2 Hikma 2020 2bac SM Prof - Kraidy (WWW - Pc1.ma)Majed Gharib100% (1)
- 1bac SM Biof Devoir Maison Physique Theoreme de L'energie Cinetique 29-11-2020Документ1 страница1bac SM Biof Devoir Maison Physique Theoreme de L'energie Cinetique 29-11-2020brinimed06gmail.com100% (1)
- c1 s1 2BAC A Prof - Habib (WWW - Pc1.ma)Документ4 страницыc1 s1 2BAC A Prof - Habib (WWW - Pc1.ma)elmrabatmohamed96100% (2)
- (WWW - Al7ibre - Com) Exercices Mouvement de Rotation D'un Solide Autour D'un Axe Fixe Serie 2Документ2 страницы(WWW - Al7ibre - Com) Exercices Mouvement de Rotation D'un Solide Autour D'un Axe Fixe Serie 2Abdellah Belhassane100% (1)
- Contrôle 28 (PR Jenkal Rachid)Документ4 страницыContrôle 28 (PR Jenkal Rachid)Mouhibi AbdellahОценок пока нет
- Série 1 - Équilibre ChimiqueДокумент6 страницSérie 1 - Équilibre ChimiqueMed RT100% (1)
- Controle 1 - 8 S1 PC 1bac FRДокумент2 страницыControle 1 - 8 S1 PC 1bac FRMalak MalakchakdiОценок пока нет
- Evaluation Diagnostique 4 - 1bac FR (WWW - Pc1.ma)Документ2 страницыEvaluation Diagnostique 4 - 1bac FR (WWW - Pc1.ma)alamiОценок пока нет
- Exercice Corrige Pendule Elastique PDFДокумент7 страницExercice Corrige Pendule Elastique PDFHarakat ElhoucineОценок пока нет
- Physique 1 Et 2-Fi12999646Документ58 страницPhysique 1 Et 2-Fi12999646الغزيزال الحسن EL GHZIZAL HassaneОценок пока нет
- Energie Interne Et Calorimètre Exercices FR 16Документ2 страницыEnergie Interne Et Calorimètre Exercices FR 16Yassir Rochd100% (1)
- Les Ondes Mécaniques Progressives Périodiques2Документ10 страницLes Ondes Mécaniques Progressives Périodiques2Papeterie BmaОценок пока нет
- Exercices RotationДокумент4 страницыExercices RotationAnass El Mansouri50% (2)
- Dans Un BallonДокумент11 страницDans Un BallonMohamed Elouakil100% (1)
- Série D'exercices - Physique Les Ondes Mécaniques - Bac Sciences Exp (2012-2013) MR BARHOUMI Ezedine PDFДокумент3 страницыSérie D'exercices - Physique Les Ondes Mécaniques - Bac Sciences Exp (2012-2013) MR BARHOUMI Ezedine PDFMohamed El Ouahdani100% (1)
- Transformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Документ3 страницыTransformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Ibtihel BoughanmiОценок пока нет
- Exercices 1 Ondes Mécaniques Progressives PeriodiquesДокумент1 страницаExercices 1 Ondes Mécaniques Progressives PeriodiquesAyoub Laanait NV100% (1)
- Série 02 Mise À Niveau Bac SC MathsДокумент4 страницыSérie 02 Mise À Niveau Bac SC Mathspage educateurОценок пока нет
- Controle 2 - 1 S1 PC 1bac FRДокумент3 страницыControle 2 - 1 S1 PC 1bac FRbrinimed06gmail.comОценок пока нет
- Controle 2 - 3 S2 PC 1bac FRДокумент2 страницыControle 2 - 3 S2 PC 1bac FRAlae AnouarОценок пока нет
- 2004-Polynesie QCM OndesДокумент2 страницы2004-Polynesie QCM OndesanasronaldoОценок пока нет
- Logique Serie SM FRДокумент2 страницыLogique Serie SM FRFFFFFFFFFFFFFFFFFFFFFE100% (1)
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2015-2016) MR Maalej Med HabibДокумент6 страницDevoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2015-2016) MR Maalej Med HabibMustapha ElhafiОценок пока нет
- Les Transformations Lentes Et Les Transformations Rapides Exercices Non Corriges 1Документ2 страницыLes Transformations Lentes Et Les Transformations Rapides Exercices Non Corriges 1Faysal Douhdouh0% (2)
- Exercice SolutionДокумент2 страницыExercice SolutionMeryem Chakri0% (1)
- Ds1 s1 2spcf 2020-2021 s1 Type C P.izaran (WWW - Pc1.ma)Документ4 страницыDs1 s1 2spcf 2020-2021 s1 Type C P.izaran (WWW - Pc1.ma)إلياس بنعثمان75% (4)
- Examen - Blanc - 1 - SM - Biof 2020Документ9 страницExamen - Blanc - 1 - SM - Biof 2020Omar Erraji100% (3)
- Devoir 1 PCДокумент2 страницыDevoir 1 PCMouhibi Abdellah100% (2)
- Examen Blanc SM FR 2020 2021Документ8 страницExamen Blanc SM FR 2020 2021Abderrazzak Elhaimer100% (1)
- Dérivation RésuméДокумент2 страницыDérivation RésuméIlyass GueroihiОценок пока нет
- Série D'exercices N°1 - Sciences Physiques Mouvements Circulaires - 3ème Math (2008-2009) PDFДокумент1 страницаSérie D'exercices N°1 - Sciences Physiques Mouvements Circulaires - 3ème Math (2008-2009) PDFKhairedine Latamna100% (4)
- MouvtRotaionExercices PDFДокумент3 страницыMouvtRotaionExercices PDFGoprohs100% (2)
- Analyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2От EverandAnalyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2Оценок пока нет
- Dosage Acido-Basique FRДокумент3 страницыDosage Acido-Basique FRAicha DaouОценок пока нет
- Examens de MécaniqueДокумент18 страницExamens de MécaniqueAicha DaouОценок пока нет
- Evolution SpontaneДокумент6 страницEvolution SpontaneAicha DaouОценок пока нет
- PhysiqueДокумент175 страницPhysiquepeleleroidufoot83% (6)
- D - Croissance Radioactive BIOF PDFДокумент8 страницD - Croissance Radioactive BIOF PDFAicha DaouОценок пока нет
- 1ers - Chap 13 - CoursДокумент3 страницы1ers - Chap 13 - CoursAicha DaouОценок пока нет
- Bac s1 2013 1g SN SujetДокумент5 страницBac s1 2013 1g SN SujetAicha DaouОценок пока нет
- Examens de MécaniqueДокумент18 страницExamens de MécaniqueAicha DaouОценок пока нет
- Exercice ChimieДокумент2 страницыExercice ChimieAicha DaouОценок пока нет
- 2 Année SMA Série 1: Les Ondes Mécaniques 2017/2018Документ4 страницы2 Année SMA Série 1: Les Ondes Mécaniques 2017/2018Aicha DaouОценок пока нет
- Exercice ChimieДокумент2 страницыExercice ChimieAicha DaouОценок пока нет
- Doc1 Activite Suivi ChimieДокумент1 страницаDoc1 Activite Suivi ChimieAicha DaouОценок пока нет
- 2 Année SMA Série 1: Les Ondes Mécaniques 2017/2018Документ4 страницы2 Année SMA Série 1: Les Ondes Mécaniques 2017/2018Aicha DaouОценок пока нет
- Exercice D'application OndeДокумент1 страницаExercice D'application OndeAicha DaouОценок пока нет
- 6 SuperpositionДокумент1 страница6 SuperpositionAicha DaouОценок пока нет
- Courbe D'astonДокумент1 страницаCourbe D'astonAicha DaouОценок пока нет
- 2éme Bac StmeДокумент3 страницы2éme Bac StmeAicha Daou100% (1)
- Exercice ChimieДокумент2 страницыExercice ChimieAicha DaouОценок пока нет
- Suite Cours Mouvement Des Planètes Et Des SatellitesДокумент3 страницыSuite Cours Mouvement Des Planètes Et Des SatellitesAicha DaouОценок пока нет
- Devoir 1Документ2 страницыDevoir 1Aicha Daou100% (3)
- 1 Exercices Les Ondes Mecaniques ProgressivesДокумент7 страниц1 Exercices Les Ondes Mecaniques ProgressivesHAMADA197270% (10)
- Cahier de TexteДокумент1 страницаCahier de TexteAicha Daou100% (1)
- Exo SuiviДокумент1 страницаExo SuiviAicha DaouОценок пока нет
- 2 Année SMA Série 1: Les Ondes Mécaniques 2017/2018Документ4 страницы2 Année SMA Série 1: Les Ondes Mécaniques 2017/2018Aicha DaouОценок пока нет
- Activite ChimieДокумент4 страницыActivite ChimieAicha DaouОценок пока нет
- Doc1 Activite Suivi ChimieДокумент1 страницаDoc1 Activite Suivi ChimieAicha DaouОценок пока нет
- 2BAC Ex Prog Lumins BIOFДокумент1 страница2BAC Ex Prog Lumins BIOFAicha Daou100% (1)
- A05 Mouvement Dans BДокумент4 страницыA05 Mouvement Dans BAicha DaouОценок пока нет
- M4TD eДокумент3 страницыM4TD eAicha DaouОценок пока нет
- Theoremes Generaux PDFДокумент37 страницTheoremes Generaux PDFAyoub Hwité100% (1)
- Fiche Technique GE 400 KVAДокумент8 страницFiche Technique GE 400 KVAnoureddine loukiliОценок пока нет
- Gnomique ProteomiqueДокумент52 страницыGnomique ProteomiqueAsma PrettyangelОценок пока нет
- 3 2013 Antilles Exo3 Correction e M Electron 5ptsДокумент2 страницы3 2013 Antilles Exo3 Correction e M Electron 5ptsalbert einschteinОценок пока нет
- Duree: 1H Exercice N°1: La Lampe Euréka Electronique:: 0.5pt 1pt 0.5pt 2ptsДокумент2 страницыDuree: 1H Exercice N°1: La Lampe Euréka Electronique:: 0.5pt 1pt 0.5pt 2ptsAyman Benamer0% (1)
- TP D'électricité: I) Circuit en Série Ou en DérivationДокумент7 страницTP D'électricité: I) Circuit en Série Ou en Dérivationmanuelimbert79Оценок пока нет
- I PhystatM1Документ41 страницаI PhystatM1Juan Camilo GallegoОценок пока нет
- SpeachДокумент17 страницSpeachra-harinanjaОценок пока нет
- TP (3) Biochimie AlimentaireДокумент8 страницTP (3) Biochimie AlimentaireAnissa DERDERОценок пока нет
- Science Des Materiaux 1Документ10 страницScience Des Materiaux 1Colin WilbaОценок пока нет
- Ekasit 028 (FT)Документ4 страницыEkasit 028 (FT)mostafa boujaataОценок пока нет
- Chapitre 1 Définitions, Désignations Et ApllicationsДокумент12 страницChapitre 1 Définitions, Désignations Et Apllicationsabdelmoumen hidouri100% (1)
- GranulationДокумент71 страницаGranulationyfermachОценок пока нет
- Cours 2 Conduction Modifié ING1 (PDF - Io)Документ7 страницCours 2 Conduction Modifié ING1 (PDF - Io)FofanaОценок пока нет
- 0.TP CH02Документ6 страниц0.TP CH02Naouma ChahdОценок пока нет
- Dtu 39 P3Документ63 страницыDtu 39 P3goncalvesОценок пока нет
- Katadyn PowerSurvivor 40E - ManualДокумент40 страницKatadyn PowerSurvivor 40E - ManualCaroline Delire-DieuОценок пока нет
- ResumeThermodynamique 4 PDFДокумент2 страницыResumeThermodynamique 4 PDFSaihi OussemaОценок пока нет
- Chapitre 001 - Proprietes de Base - 2Документ7 страницChapitre 001 - Proprietes de Base - 2youcefОценок пока нет
- 2018 TOU30165 AДокумент209 страниц2018 TOU30165 AWido PikalОценок пока нет
- CR TP Magnétismes Moumene Ka AzzaouiДокумент12 страницCR TP Magnétismes Moumene Ka AzzaouiYahya MoumeneОценок пока нет
- Les RoulementsДокумент20 страницLes RoulementsmathisОценок пока нет
- Transformateur Mono À Deux Colonnes de SecuritéДокумент1 страницаTransformateur Mono À Deux Colonnes de Securitéarbi jridiОценок пока нет
- Des Crat' Eres Dans Du Gel: Rapport de Stage Exp ErimentalДокумент20 страницDes Crat' Eres Dans Du Gel: Rapport de Stage Exp ErimentalEspoirVungingaByawendeОценок пока нет
- Etinc Cours 2ac PC GuideДокумент37 страницEtinc Cours 2ac PC GuideXi Do86% (81)
- II - Ecoulements Ideaux L3ENGДокумент18 страницII - Ecoulements Ideaux L3ENGBilal BouakrifОценок пока нет
- Mecanique Des Fluides-Be8153Документ18 страницMecanique Des Fluides-Be8153Mouhamed Rassoul GueyeОценок пока нет
- Exercice 1 (7 Points) Odeur Désagréable de PoissonsДокумент4 страницыExercice 1 (7 Points) Odeur Désagréable de Poissonsveronica.1.moussallemОценок пока нет
- Poly OUM1Документ43 страницыPoly OUM1Houcine BendaoudОценок пока нет
- AM1 TD2 2020 2021 CorrigéДокумент5 страницAM1 TD2 2020 2021 CorrigéSusan DaОценок пока нет