Академический Документы
Профессиональный Документы
Культура Документы
1b Reacciones Redox
Загружено:
EdGab PiedraMaza0 оценок0% нашли этот документ полезным (0 голосов)
41 просмотров1 страницаredox
Оригинальное название
1b Reacciones redox
Авторское право
© © All Rights Reserved
Доступные форматы
PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документredox
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
41 просмотров1 страница1b Reacciones Redox
Загружено:
EdGab PiedraMazaredox
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 1
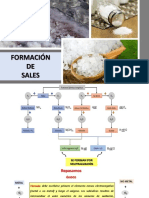
Definición de reacción redox
Oxidación
CONCEPTOS GENERALES Reducción
Agente oxidante
Agente reductor
Definición
NÚMERO DE OXIDACIÓN
Reglas
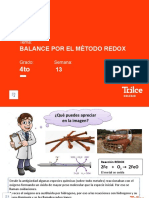
El oxígeno elemental se convierte en
algún compuesto de oxígeno (CO2, H2O)
Combustión
con generación de flama y liberación de
calor
Es una reacción de desplazamiento
A + BX --> AX + B
El ion en disolución es desplazado o
sustituido por un elemento que se oxida
TIPOS DE REACCIONES REDOX
Reacción metal-ácido o metal-sal a) METAL + ÁCIDO ==> SAL + H2
La ecuación anterior, podría escribirse de
forma abreviada como...
Es decir, el ión cloruro es únicamente un ión expectante
b) METAL1 + SAL ==> SAL + METAL2
¿Cómo se podría predecir si un metal se
oxidará en presencia de un ácido o una
sal dada?
La reacción arriba anotada indica que no
Reacciones REDOX se debería almacenar sales de níquel en
Antecedentes
un frasco de hierro, pues este último de
oxidaría y carcomería
Fenómenos como éste, dan lugar a
corrosión que afectan a piezas y partes
metálicas
Los metales varían en cuanto a su
facílidad de oxidarse (ceder De allí que un metal puede, incluso, oxidar a otro
electrones)
Un metal puede ser oxidado por otro
SERIE DE ACTIVIDAD que se encuentre por debajo de él
Un metal puede oxidar a cualquiera que
esté por encima de él en la lista
Los metales de la parte superior se
Serie de actividad se denomina a la
denominan "activos"
lista de metales ordenados de
acuerdo a su facilidad de oxidación Los metales ubicados hacia abajo de la
lista son denominados "nobles"
Solamente los metales que están
ubicados por sobre el hidrógeno pueden
reaccionar con ácidos, para formar sales
e H2
Ejemplos:
1b Reacciones redox.mmap - 7/11/2017 -
Вам также может понравиться
- REDOXДокумент12 страницREDOXedgar3009Оценок пока нет
- Wuolah Free QUIMICA 2oBACH 2Документ41 страницаWuolah Free QUIMICA 2oBACH 2Monica Martínez de diosОценок пока нет
- 5reacciones RedoxДокумент25 страниц5reacciones RedoxRamón Eliseo Flores EspinalОценок пока нет
- Reacciones Quimicas 2-2 PDFДокумент4 страницыReacciones Quimicas 2-2 PDFManuel Jesus Aquino EliasОценок пока нет
- Reacciones RedoxДокумент12 страницReacciones RedoxCarlos Alfonso Jara Benites100% (5)
- Química 5to Secundaria 18Документ19 страницQuímica 5to Secundaria 18Metade Marvel A ChОценок пока нет
- Resumen Unidad 8 ElectroquimicaДокумент30 страницResumen Unidad 8 ElectroquimicaJavier HerreraОценок пока нет
- Funcion OxidoДокумент2 страницыFuncion OxidoferrerОценок пока нет
- Práctica de Reacción Redox 04 - 05 - 15Документ4 страницыPráctica de Reacción Redox 04 - 05 - 15Jhony Becerra SanchezОценок пока нет
- Guia de QuimicaДокумент5 страницGuia de QuimicaJulio AngelОценок пока нет
- Balanceo RedoxДокумент1 страницаBalanceo RedoxLuis Angel Galicia100% (1)
- P6°-05-CE-Tema 16 y LABORATORIOДокумент4 страницыP6°-05-CE-Tema 16 y LABORATORIOPeggy CapacoilaОценок пока нет
- Capitulo Nº18Документ19 страницCapitulo Nº18Roger Calizaya HuancaОценок пока нет
- Q - 08 REDOX Ejercicios IntroductoriosДокумент8 страницQ - 08 REDOX Ejercicios IntroductoriosFef Re fefОценок пока нет
- Oxigen A DosДокумент2 страницыOxigen A DosLucia ToribioОценок пока нет
- Ejercicios Tipos de Reacciones QuímicasДокумент4 страницыEjercicios Tipos de Reacciones QuímicasJOSE ENRIQUE AGUILAR VALDIVIAОценок пока нет
- 18 - Reacciones Químicas IIДокумент8 страниц18 - Reacciones Químicas IIBelen Saffie ContrerasОценок пока нет
- Q - 4to - Balance Por Método Redox (Con Audio)Документ26 страницQ - 4to - Balance Por Método Redox (Con Audio)Edwin FloresОценок пока нет
- Guia Reacciones RedoxДокумент5 страницGuia Reacciones RedoxdanielaОценок пока нет
- RedoxДокумент12 страницRedoxJavier Andrés Torres DíazОценок пока нет
- Filemd5798-2023-08-16 13-01-36Документ35 страницFilemd5798-2023-08-16 13-01-36Renzo BabilonioОценок пока нет
- Métodos Volumétricos Por Oxido ReducciónДокумент27 страницMétodos Volumétricos Por Oxido ReducciónEdouard50% (2)
- 5 Oxidos y PeroxidosДокумент5 страниц5 Oxidos y PeroxidosJair Lopez RosalesОценок пока нет
- Redox - Poster PDFДокумент2 страницыRedox - Poster PDFVictoria Vizcaíno GarcíaОценок пока нет
- Redox Mayo Junio 2020 PDFДокумент100 страницRedox Mayo Junio 2020 PDFCristian BurgosОценок пока нет
- Biblio - s18 - Quimica, R. Chang 10°ed.-Pages-168-171Документ4 страницыBiblio - s18 - Quimica, R. Chang 10°ed.-Pages-168-171William VasquezОценок пока нет
- REDOXДокумент1 страницаREDOXPaulina Garrido BenitezОценок пока нет
- Ejerccios de QuimicaДокумент6 страницEjerccios de QuimicaDavid saul Oviedo mamaniОценок пока нет
- Clase REDOX Qui-223Документ53 страницыClase REDOX Qui-223JacquelineLisetVargasVergaraОценок пока нет
- Reacciones QuímicasДокумент34 страницыReacciones QuímicasAustin HackmanОценок пока нет
- Química Orgánica Ácidos Carboxilicos y DerivadosДокумент2 страницыQuímica Orgánica Ácidos Carboxilicos y DerivadosAndrés GamerosОценок пока нет
- Nomenclatura InorgÁnica IntroducciÓn La Química Tiene SuДокумент7 страницNomenclatura InorgÁnica IntroducciÓn La Química Tiene Surgrtumaco100% (2)
- 1) Tema Func Oxidos y Anhidridos 2021Документ4 страницы1) Tema Func Oxidos y Anhidridos 2021Dianira Fuentes CamposОценок пока нет
- Unidad 5.6 - RefinaciónДокумент40 страницUnidad 5.6 - RefinaciónHELEN ROSALBA PEREZ ARANCIBIAОценок пока нет
- 08 Electroquimica I (Pilas) PDFДокумент72 страницы08 Electroquimica I (Pilas) PDFRenzo JahnОценок пока нет
- Nomenclatura Inorgánica I: C H A P T E RДокумент7 страницNomenclatura Inorgánica I: C H A P T E RFua compuatdora13Оценок пока нет
- Informe VolumetriaДокумент18 страницInforme VolumetriakaylaniariannequispecuizaОценок пока нет
- 7K - Sem 11 - Química - PRДокумент4 страницы7K - Sem 11 - Química - PRJeshu YTОценок пока нет
- Procesos de ReducciónДокумент65 страницProcesos de ReducciónDaniel Eduardo Cortez GonzálezОценок пока нет
- Redox TeoríaДокумент55 страницRedox TeoríaHugo SánchezОценок пока нет
- Diapo 25 RXQ IIДокумент18 страницDiapo 25 RXQ IICarlos Ernesto Calderon RamirezОценок пока нет
- Guia-Oxidacion y Reduccion-Qui-4mДокумент4 страницыGuia-Oxidacion y Reduccion-Qui-4mXime Lucero JaraОценок пока нет
- 1 Chemistry - Course Companion - Oxford 2014-219-221Документ16 страниц1 Chemistry - Course Companion - Oxford 2014-219-221manuel angelОценок пока нет
- Química Química: 2º Bachillerato TEMA 7: Oxidación º Bachillerato Oxidación-Reducción ReducciónДокумент17 страницQuímica Química: 2º Bachillerato TEMA 7: Oxidación º Bachillerato Oxidación-Reducción ReducciónManuelОценок пока нет
- Formación de Sales Iem B 2022Документ18 страницFormación de Sales Iem B 2022Pablo Ricardo PeressottiОценок пока нет
- Semana 06 2017 IДокумент4 страницыSemana 06 2017 IANAОценок пока нет
- Flipped OXIDO REDUCCION pdf-1Документ5 страницFlipped OXIDO REDUCCION pdf-1JAGER ZETRAОценок пока нет
- Nomenclatura Oxidos e Hidroxidos Quimica 10Документ5 страницNomenclatura Oxidos e Hidroxidos Quimica 10Adriana Castro100% (1)
- Diapositivas Redox Primera ParteДокумент25 страницDiapositivas Redox Primera ParteSol PolitanoОценок пока нет
- Guia Nomenclatura DécimoДокумент5 страницGuia Nomenclatura DécimojaimehernanpabloОценок пока нет
- Reacciones 1Документ10 страницReacciones 1Zareth ChargoyОценок пока нет
- Rayos Catodicos Heuristica 1Документ3 страницыRayos Catodicos Heuristica 1Estiben CamachoОценок пока нет
- 3ro. SecДокумент11 страниц3ro. SecYesenia FernándezОценок пока нет
- TEMA 13 - Equilibrios y Volumetrias Redox - Moles (Imprimir)Документ9 страницTEMA 13 - Equilibrios y Volumetrias Redox - Moles (Imprimir)Alexandra MarkovichОценок пока нет
- Teoría Nomenclatura InorgánicaДокумент4 страницыTeoría Nomenclatura InorgánicaVerónica Miriam Espinosa SalasОценок пока нет
- Tema+7 RedoxДокумент23 страницыTema+7 RedoxJose De Posada VelaОценок пока нет
- Mapa Mental PDFДокумент1 страницаMapa Mental PDFWilliam Velasquez Reyes100% (1)
- FormulaciónДокумент23 страницыFormulaciónMaria WenceslaОценок пока нет
- Tema Nomenclatura InorganicaДокумент12 страницTema Nomenclatura Inorganica앨런 안티Оценок пока нет
- Formato de CarátulaДокумент1 страницаFormato de CarátulaEdGab PiedraMazaОценок пока нет
- LaboratorioДокумент6 страницLaboratorioEdGab PiedraMazaОценок пока нет
- Manual de Información Técnica de NeumáticosДокумент27 страницManual de Información Técnica de NeumáticosSnowcorn75% (4)
- Batería Niquel Cadmio - Metal HidruroДокумент21 страницаBatería Niquel Cadmio - Metal HidruroEdGab PiedraMazaОценок пока нет
- Manual de Información Técnica de NeumáticosДокумент27 страницManual de Información Técnica de NeumáticosSnowcorn75% (4)
- Deber Intro RedoxДокумент3 страницыDeber Intro RedoxEdGab PiedraMazaОценок пока нет
- Dext2dcvs46460 Specguideupdate2014 SP RevДокумент9 страницDext2dcvs46460 Specguideupdate2014 SP RevEdGab PiedraMazaОценок пока нет
- Informe de ProyectoДокумент24 страницыInforme de ProyectoEdGab PiedraMazaОценок пока нет
- Manual de Información Técnica de NeumáticosДокумент27 страницManual de Información Técnica de NeumáticosSnowcorn75% (4)
- A CordesДокумент3 страницыA CordesEdGab PiedraMazaОценок пока нет
- DEXT2DCVS46460 SpecGuideUpdate2014 SP REV PDFДокумент40 страницDEXT2DCVS46460 SpecGuideUpdate2014 SP REV PDFmvalleОценок пока нет
- METODLOGIA (Autoguardado)Документ41 страницаMETODLOGIA (Autoguardado)EdGab PiedraMaza0% (1)
- Intro A RedoxДокумент7 страницIntro A RedoxLuis NaulaОценок пока нет
- Silabo Analisis IIДокумент8 страницSilabo Analisis IIEdGab PiedraMazaОценок пока нет
- LR TB2000 DatasheetДокумент5 страницLR TB2000 DatasheetEDUARDO NICOLASОценок пока нет
- Transmision Por CadenaДокумент22 страницыTransmision Por CadenaAnonymous Bdt0OGhОценок пока нет
- CLASE 12 y 14-04-2021-SECCION 797Документ10 страницCLASE 12 y 14-04-2021-SECCION 797guillermo0% (1)
- Cytochrome P450 Dynamics - En.esДокумент20 страницCytochrome P450 Dynamics - En.esPaola LopezОценок пока нет
- Ciencia y Ambiente 2do Primaria II TrimДокумент75 страницCiencia y Ambiente 2do Primaria II Trimyelina HuamánОценок пока нет
- 2.8 (2) Criterios para Seleccion de Un SensorДокумент4 страницы2.8 (2) Criterios para Seleccion de Un SensorJUAN ALBERTO GUTIÉRREZ LOPEZОценок пока нет
- Farmacos Antianemicos y Factores Estimulantes Del Crecimiento HematopoyeticoДокумент33 страницыFarmacos Antianemicos y Factores Estimulantes Del Crecimiento HematopoyeticoAbrahan HCОценок пока нет
- Cartilla Comparativa AMI 2021Документ12 страницCartilla Comparativa AMI 2021Katherine Pretel RuizОценок пока нет
- Rabia CaninaДокумент16 страницRabia Caninarube beltran rico100% (1)
- Rods, Mullions, BudingДокумент4 страницыRods, Mullions, BudingjavialphaОценок пока нет
- Resumen Capitulo 7 Ray XДокумент1 страницаResumen Capitulo 7 Ray XxlkoОценок пока нет
- Los ColoresДокумент19 страницLos ColoresJULIAОценок пока нет
- Porfidosdel ExtranjeroДокумент21 страницаPorfidosdel ExtranjeroAngello Rivera CalleОценок пока нет
- Alerta de Seguridad IADCДокумент2 страницыAlerta de Seguridad IADCAnonymous YTiBI3P3tОценок пока нет
- Taller TLCДокумент13 страницTaller TLCjavierbaronaОценок пока нет
- 2-1 - Sociales - Monica - Sem 15 de Junio Al 26 de JunioДокумент3 страницы2-1 - Sociales - Monica - Sem 15 de Junio Al 26 de JunioAstrid Yuleimy JAIMES VILLAMIZARОценок пока нет
- Ejercicios de CoherenciaДокумент2 страницыEjercicios de CoherenciaNiña Roja100% (1)
- Garrido, Traducción Anotada de La Risalat de Ibn Masarra-10-26Документ17 страницGarrido, Traducción Anotada de La Risalat de Ibn Masarra-10-26Vale PepinoОценок пока нет
- Internet de Las Cosas (IoT)Документ8 страницInternet de Las Cosas (IoT)Ivan Molina CáceresОценок пока нет
- La Imagen de La Divina Pastora de Cantillana P Álvaro Román VillónДокумент183 страницыLa Imagen de La Divina Pastora de Cantillana P Álvaro Román VillónLuis Pilar MorenoОценок пока нет
- Kendall y KendallДокумент3 страницыKendall y KendallSilvana D'Agosto100% (1)
- Funcionamiento Del Mecanismo de Un PistonДокумент3 страницыFuncionamiento Del Mecanismo de Un PistonStalin LeonОценок пока нет
- Guia No 1 EventosДокумент7 страницGuia No 1 EventosYUSLENDYS QUINTERO CAMARGOОценок пока нет
- Clase II - ResumenДокумент5 страницClase II - ResumenJuliana AgueroОценок пока нет
- Una Investigación Sobre El Hombre Más Controvertido de La Historia - Parte 2Документ3 страницыUna Investigación Sobre El Hombre Más Controvertido de La Historia - Parte 2Xavier Talavera CabezasОценок пока нет
- Presentacion - Caso OdebrechtДокумент20 страницPresentacion - Caso OdebrechtTatito2000100% (1)
- SentenciaAccidente de Tránsito CONTENEDOR Culpas Concurrentes ACOSTA C BustosДокумент66 страницSentenciaAccidente de Tránsito CONTENEDOR Culpas Concurrentes ACOSTA C Bustosgomezpalavecino100% (1)
- CASO CLÍNICO PicnodisostosisДокумент2 страницыCASO CLÍNICO PicnodisostosisStefy TorresОценок пока нет
- Simpson 1/3Документ3 страницыSimpson 1/3Star Black0% (1)
- Rep Junior - Vallejos Aplicacion - De.la - Metodologia.pmbokДокумент121 страницаRep Junior - Vallejos Aplicacion - De.la - Metodologia.pmbokkarkateraОценок пока нет