Академический Документы
Профессиональный Документы
Культура Документы
Síntese de glicose a partir de compostos como lactato e alanina
Загружено:
patrickdrheonix0 оценок0% нашли этот документ полезным (0 голосов)
27 просмотров2 страницы1) A gliconeogênese é a síntese de glicose no fígado a partir de compostos como lactato e alanina, utilizando ATP.
2) Há três etapas modificadas em relação à glicólise: conversão de piruvato a fosfoenolpiruvato, frutose 1,6-bisfosfato a frutose 6-fosfato, e glicose 6-fosfato a glicose.
3) A via é regulada por hormônios como insulina e glucagon que agem sobre en
Исходное описание:
resumido
Оригинальное название
Gliconeogênese
Авторское право
© © All Rights Reserved
Доступные форматы
DOC, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документ1) A gliconeogênese é a síntese de glicose no fígado a partir de compostos como lactato e alanina, utilizando ATP.
2) Há três etapas modificadas em relação à glicólise: conversão de piruvato a fosfoenolpiruvato, frutose 1,6-bisfosfato a frutose 6-fosfato, e glicose 6-fosfato a glicose.
3) A via é regulada por hormônios como insulina e glucagon que agem sobre en
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOC, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
27 просмотров2 страницыSíntese de glicose a partir de compostos como lactato e alanina
Загружено:
patrickdrheonix1) A gliconeogênese é a síntese de glicose no fígado a partir de compostos como lactato e alanina, utilizando ATP.
2) Há três etapas modificadas em relação à glicólise: conversão de piruvato a fosfoenolpiruvato, frutose 1,6-bisfosfato a frutose 6-fosfato, e glicose 6-fosfato a glicose.
3) A via é regulada por hormônios como insulina e glucagon que agem sobre en
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOC, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 2
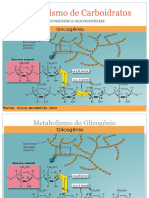
Gliconeogênese
A gliconeogênese é a síntese de glicose a partir de compostos como lactato, alanina e
glicerol, com o consumo de ATP. É realizada nas células hepáticas, e o ATP utilizado é
proveniente principalmente da oxidação de ácidos graxos.
Com a glicólise e a gliconeogênese são vias praticamente opostas, e que compartilham a
maioria de suas enzimas, é necessário que uma funcione quando a outra estiver inativada.
A gliconeogênese inicia com a transformação de alanina e lactato em piruvato (alanina
aminotransferase e lactato desidrogenase), que entra na mitocôndria através de uma
translocase. A partir daí, existem 3 etapas da glicólise que são modificadas.
Etapa1: conversão de piruvato a fosfoenolpiruvato.
Na glicólise, esta etapa ocorre em apenas uma reação, já na gliconeogênese, ocorre em duas
reações, a primeira que transforma piruvato em oxaloacetato (será é mandando para fora da
mitocôndria através de uma lançadeira), através da piruvato quinase (que contém biotina), e
a segunda que transforma oxaloacetato em fosfoenolpiruvato, através da fosfoenolpiruvato
carboxilase.
O fosfoenolpiruvato se transforma em frutose 1,6-bisfosfato.
Etapa 2: conversão de frutose 1,6-bisfosfato a frutose 6-fosfato, através da frutose 1,6-
bisfosfatase.
Etapa 3: conversão de glicose 6-fosfato a glicose, através da glicose 6-fosfatase.
Regulação
Piruvato carboxilase + fosfoenolpiruvato x piruvato quinase
A glicólise é estimulada pela presença de frutose 1,6-bisfosfato, e inibida por ATP e alanina
(esta impede que fosfoenolpiruvato possa ser convertida a piruvato novamente). O
glucagon estimula a via da PKA, inativando a piruvato quinase e estimulando a
fosfoenolpiruvato carboxilase. Quando ocorre hiperglicemia e existe insulina no meio, esta
causa a desfosforilação da piruvato quinase, estimulando a glicólise.
Acetil-CoA estimula a piruvato carboxilase, em que se forma oxaloacetato necessária para
o funcionamento do ciclo de krebs. ADP sempre age como inibidor da gliconeogênese.
Frutose 1,6-bisfosfatase x fosfofrutoquinase 1
Frutose 1,6-bisfosfatase é inibida pela presença de AMP e frutose 2,6-bisfosfato.
Fosfofrutoquinase 1 é inibida por ATP e citrato (devido ao ciclo de krebs) e é estimulada
por AMP e frutose 1,6-bisfosfato.
A produção de frutose 2,6-bisfosfatase é inibida pelo aumento da concentração de
fosfoenolpiruvato, e portanto estimula a gliconeogênese, além disso, é inibida também pela
presença de glucagon e epinefrina, que fosforilam a enzima responsável pela sua síntese.
Glicose 6-fosfatase x glicoquinase
Вам также может понравиться
- GliconeogeneseДокумент4 страницыGliconeogeneseAline PereiraОценок пока нет
- Prolactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoОт EverandProlactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoОценок пока нет
- Atividade GliconeogêneseДокумент5 страницAtividade GliconeogêneseGatodo FabaОценок пока нет
- Topologia dos Principais Transportadores de Açúcares: uma abordagem sobre a estrutura e função dos GLUT'sОт EverandTopologia dos Principais Transportadores de Açúcares: uma abordagem sobre a estrutura e função dos GLUT'sОценок пока нет
- Metabolismo de carboidratos: gliconeogênese e regulação hormonalДокумент20 страницMetabolismo de carboidratos: gliconeogênese e regulação hormonalAna SilvaОценок пока нет
- Gliconeogenese e Metabolismo Do GlicogênioДокумент27 страницGliconeogenese e Metabolismo Do GlicogênioRicardo BorgesОценок пока нет
- Glicolise e GliconeogeneseДокумент49 страницGlicolise e GliconeogeneseAlline RodriguesОценок пока нет
- Biossintese de Carboidratos BioquímicaДокумент6 страницBiossintese de Carboidratos BioquímicaMarcela Lima de BritoОценок пока нет
- Metabolismo EnergéticoДокумент7 страницMetabolismo EnergéticoMariana PaesОценок пока нет
- Neoglicogênese: síntese de glicose no fígado e rinsДокумент4 страницыNeoglicogênese: síntese de glicose no fígado e rinsMary FreitasОценок пока нет
- Metabolismo Dos CarboidratosДокумент31 страницаMetabolismo Dos CarboidratosRenata AdonesОценок пока нет
- Regulação do metabolismo dos carboidratos e armazenamento do glicogênioДокумент33 страницыRegulação do metabolismo dos carboidratos e armazenamento do glicogêniowandersom costa de souzaОценок пока нет
- BIOQUÍMICA II 02 - Glicólise e GliconeogêneseДокумент8 страницBIOQUÍMICA II 02 - Glicólise e GliconeogêneseTúlio MaranhãoОценок пока нет
- Bioquímica-Fisiológica-Exame 210129 010644Документ7 страницBioquímica-Fisiológica-Exame 210129 010644Joana Carolina Teixeira RibeiroОценок пока нет
- Aula 14 - GluconeogéneseДокумент24 страницыAula 14 - GluconeogéneseaptgaptgОценок пока нет
- Gliconeogênese: formação de glicose a partir de não-carboidratosДокумент25 страницGliconeogênese: formação de glicose a partir de não-carboidratosAnderson SilveiraОценок пока нет
- Glicogênese e Glicogenólise OKДокумент3 страницыGlicogênese e Glicogenólise OKlau24bronzattoОценок пока нет
- Farmácia - Bioquimica - Vias Metabolicas - Panorama GeralДокумент4 страницыFarmácia - Bioquimica - Vias Metabolicas - Panorama GeraljackspolОценок пока нет
- Uma Panorâmica Geral Das Vias MetabólicasДокумент4 страницыUma Panorâmica Geral Das Vias MetabólicasVanessa TomazОценок пока нет
- Resumos BioquímicaДокумент14 страницResumos BioquímicaGabrieli HoepersОценок пока нет
- Glicogênese, Glicenolise, GliconeogeneseДокумент3 страницыGlicogênese, Glicenolise, GliconeogeneseLaryssa KlugeОценок пока нет
- Resumos de BioquimicaДокумент42 страницыResumos de BioquimicaAna Carolina Soares EstevesОценок пока нет
- Resumo - GlicóliseДокумент11 страницResumo - Glicólisemaelson100% (2)
- Metabolismo Do GlicogênioДокумент6 страницMetabolismo Do GlicogênioSara EsterОценок пока нет
- Bioquímica Fisiológica Exame B - 210129 - 103356Документ5 страницBioquímica Fisiológica Exame B - 210129 - 103356Joana Carolina Teixeira RibeiroОценок пока нет
- Glicose: digestão, glicólise e regulação dos níveis no sangueДокумент8 страницGlicose: digestão, glicólise e regulação dos níveis no sanguelaviОценок пока нет
- Resposta Estudo Dirigido BqiiДокумент13 страницResposta Estudo Dirigido BqiiVitor Ferreira ValenteОценок пока нет
- Gliconeogênese e Metabolismo de Glicídios - RespostasДокумент2 страницыGliconeogênese e Metabolismo de Glicídios - RespostasMirella DannaОценок пока нет
- BioquimiscДокумент7 страницBioquimiscJuca Do sabugueiro loucoОценок пока нет
- Metabolismo do glicogênio: quebra e sínteseДокумент3 страницыMetabolismo do glicogênio: quebra e sínteseAlice AlencarОценок пока нет
- Metabolismo Do GlicogênioДокумент20 страницMetabolismo Do Glicogênioamandinha_fc100% (6)
- Metabolismo de CH II (Odonto)Документ17 страницMetabolismo de CH II (Odonto)Fernanda LacerdaОценок пока нет
- Introdução Ao MetabolismoДокумент6 страницIntrodução Ao MetabolismoLuanaОценок пока нет
- Metabolismo dos Glicídios: Digestão, Absorção e CirculaçãoДокумент4 страницыMetabolismo dos Glicídios: Digestão, Absorção e CirculaçãoMariana BarbosaОценок пока нет
- T1 - Glicólise e Oxidação Do PiruvatoДокумент6 страницT1 - Glicólise e Oxidação Do PiruvatochicoОценок пока нет
- Uma Panorâmica Geral Das Vias MetabólicasДокумент4 страницыUma Panorâmica Geral Das Vias Metabólicaskk da quimicaОценок пока нет
- Glícolise e gliconeogêneseДокумент8 страницGlícolise e gliconeogêneseCharles Lameira ValenteОценок пока нет
- Metabolismo de CarboidratosДокумент15 страницMetabolismo de Carboidratosdani_eleine0% (1)
- Gluconeogênese: fonte glicose jejumДокумент3 страницыGluconeogênese: fonte glicose jejumHermes Sales CamposОценок пока нет
- Gliconeogênese no FígadoДокумент33 страницыGliconeogênese no FígadoReinaldo RiquetОценок пока нет
- Bioquímica II - SimuladoДокумент7 страницBioquímica II - SimuladoManu DenckОценок пока нет
- Glicolise 2011 - Final - Leticia 2011Документ42 страницыGlicolise 2011 - Final - Leticia 2011Ana ReginaОценок пока нет
- Síntese de glicose a partir de não-carboidratosДокумент16 страницSíntese de glicose a partir de não-carboidratosjaraОценок пока нет
- Estudo Dirigido BioquimicaДокумент5 страницEstudo Dirigido Bioquimicaadelsonribeiro100% (4)
- Via GlicolticaДокумент15 страницVia GlicolticaCamila MendesОценок пока нет
- Aula 22 - Neoglicogênese, Ciclo de Cori e de AlaninaДокумент22 страницыAula 22 - Neoglicogênese, Ciclo de Cori e de AlaninaAndré Jason MendesОценок пока нет
- Regulação do metabolismo por enzimas e hormôniosДокумент6 страницRegulação do metabolismo por enzimas e hormôniosJohn FroesОценок пока нет
- Gliconeogênese e metabolismo de carboidratosДокумент5 страницGliconeogênese e metabolismo de carboidratosAna RosaОценок пока нет
- GliconeogêneseДокумент35 страницGliconeogêneseLorraine MattosОценок пока нет
- Metabolismo Do GlicognioДокумент15 страницMetabolismo Do GlicognioDaniel FreireОценок пока нет
- Gliconeogenese ResumoДокумент2 страницыGliconeogenese ResumoHarlyson David BotelhoОценок пока нет
- GlicogêneseДокумент5 страницGlicogêneseLuanaОценок пока нет
- GlicóliseДокумент4 страницыGlicóliseGlen daОценок пока нет
- GLICONEOGÊNESEДокумент10 страницGLICONEOGÊNESESabrina SousaОценок пока нет
- Bioquimica Prova 1 PDFДокумент10 страницBioquimica Prova 1 PDFESTHER DE MELLO ANTONIO100% (1)
- Questionário Glicólise e Catabolismo Das HexosesДокумент6 страницQuestionário Glicólise e Catabolismo Das HexosesRaffael Batista MarquesОценок пока нет
- Metabolismo de CarboidratosДокумент8 страницMetabolismo de CarboidratosGabriel FerreiraОценок пока нет
- Ricota Por Soro de Leite de CabraДокумент4 страницыRicota Por Soro de Leite de CabrapatrickdrheonixОценок пока нет
- Técnicas para produção de derivados do leite na propriedade ruralДокумент33 страницыTécnicas para produção de derivados do leite na propriedade ruralLaisa Ronconi100% (1)
- Artigo DorДокумент4 страницыArtigo DorpatrickdrheonixОценок пока нет
- Os Artefatos de Imagem Na Tomografia Computadorizada PDFДокумент5 страницOs Artefatos de Imagem Na Tomografia Computadorizada PDFpatrickdrheonixОценок пока нет
- Higiene Na Industria de AlimentosДокумент132 страницыHigiene Na Industria de Alimentosmarquespesce100% (2)
- Acidos e AbsesДокумент3 страницыAcidos e AbsespatrickdrheonixОценок пока нет
- História Da HemoterapiaДокумент3 страницыHistória Da HemoterapiapatrickdrheonixОценок пока нет
- SLIDES - Legislacao-Sobre-Qualidade-Do-Leite-No-Brasil - Mayara Souza Pinto - MAPA - 2011 PDFДокумент47 страницSLIDES - Legislacao-Sobre-Qualidade-Do-Leite-No-Brasil - Mayara Souza Pinto - MAPA - 2011 PDFRita AndradeОценок пока нет
- Apostila2IndustriaAlcooleira 2013 PDFДокумент19 страницApostila2IndustriaAlcooleira 2013 PDFcavalc105292Оценок пока нет
- Historia Da Transfusao No BrasilДокумент7 страницHistoria Da Transfusao No BrasilWilliam Roberto SchluchtingОценок пока нет
- Anatomia Do CoraçãoДокумент11 страницAnatomia Do CoraçãopatrickdrheonixОценок пока нет
- MobilidadeДокумент28 страницMobilidadepatrickdrheonixОценок пока нет
- ParasitologiaДокумент8 страницParasitologiapatrickdrheonixОценок пока нет
- Dureza e Moleza Dos Acidos e BasesДокумент39 страницDureza e Moleza Dos Acidos e BasesDanielle SouzaОценок пока нет
- Anatomia Do CoraçãoДокумент11 страницAnatomia Do CoraçãopatrickdrheonixОценок пока нет
- Uso Da Via Subcutanea Geriatria Cuidados Paliativos PDFДокумент56 страницUso Da Via Subcutanea Geriatria Cuidados Paliativos PDFRamiro PamponetОценок пока нет
- Toxicidade Do MetilmercúrioДокумент1 страницаToxicidade Do MetilmercúriopatrickdrheonixОценок пока нет
- Hipodermoclise Artigo PDFДокумент6 страницHipodermoclise Artigo PDFBolos da CatiaОценок пока нет
- Características Gerais Dos Seres VivosДокумент3 страницыCaracterísticas Gerais Dos Seres VivospatrickdrheonixОценок пока нет
- LeiteДокумент55 страницLeitedrigeanini100% (1)
- Biologia - Apostila ANVISA - Módulo 04Документ66 страницBiologia - Apostila ANVISA - Módulo 04Biologia ANVISA100% (3)
- Sem A Participação Do Oxigênio©Документ2 страницыSem A Participação Do Oxigênio©Leila E RickОценок пока нет
- BulaДокумент6 страницBulapatrickdrheonixОценок пока нет
- Apostila2IndustriaAlcooleira 2013 PDFДокумент19 страницApostila2IndustriaAlcooleira 2013 PDFcavalc105292Оценок пока нет
- Manual de Primeiros Socorros - Ministerio Da SaudeДокумент207 страницManual de Primeiros Socorros - Ministerio Da Saudeeniehy97% (30)
- Metabolismo de lipídios e aminoácidosДокумент6 страницMetabolismo de lipídios e aminoácidospatrickdrheonix100% (3)
- Maparisco 140714153933 PhpappДокумент45 страницMaparisco 140714153933 PhpappFernanda AliceОценок пока нет
- Toxoplasma Seminário PDFДокумент31 страницаToxoplasma Seminário PDFpatrickdrheonixОценок пока нет
- Estudo Dirigido Met. Lipidico, de Aa e Integração.Документ2 страницыEstudo Dirigido Met. Lipidico, de Aa e Integração.patrickdrheonixОценок пока нет
- Jogos de Invasão ArtigoДокумент19 страницJogos de Invasão ArtigoBrenno Alves GualbertoОценок пока нет
- Kryon11 Ext PTДокумент29 страницKryon11 Ext PTSampaio JoãoОценок пока нет
- Complexo B - Tratamento de DorДокумент5 страницComplexo B - Tratamento de DorWagner Goncalves100% (1)
- Exercícios dinâmicos para redação técnicaДокумент7 страницExercícios dinâmicos para redação técnicaEdna Patricia Berenguel BerenguelОценок пока нет
- APECA - Exemplo RFAIДокумент277 страницAPECA - Exemplo RFAIOsvaldo DiasОценок пока нет
- As Pedras e as Cartas CiganasДокумент20 страницAs Pedras e as Cartas Ciganascarmemromani100% (2)
- Comparação de valores e aplicações com entradas analógicasДокумент4 страницыComparação de valores e aplicações com entradas analógicasGabriel Maganha100% (1)
- Prova de Língua Portuguesa sobre interpretação textual e uso da vírgulaДокумент2 страницыProva de Língua Portuguesa sobre interpretação textual e uso da vírgulaAlessandra PiresОценок пока нет
- 63 123 1 SMДокумент18 страниц63 123 1 SMjhebetaОценок пока нет
- Ensino da alfabetização no BrasilДокумент10 страницEnsino da alfabetização no BrasilLúcia SchermackОценок пока нет
- Libras - Atividade 3Документ1 страницаLibras - Atividade 3Lorena ReisОценок пока нет
- Educação Especial E Inclusiva E Neuropsicopedagogia Institucional E Clínica 800 HorasДокумент2 страницыEducação Especial E Inclusiva E Neuropsicopedagogia Institucional E Clínica 800 Horaseasports maax0% (1)
- UFCD 7238 Terceira Idade e Velhice ÍndiceДокумент3 страницыUFCD 7238 Terceira Idade e Velhice ÍndiceMANUAIS FORMAÇÃO100% (2)
- Psicologia GeralДокумент2 страницыPsicologia GeralAli Braz Momade MucopotoОценок пока нет
- Eltek Instalação V1Документ71 страницаEltek Instalação V1Anderson Sfredo100% (1)
- Funções de Um Técnico Superior de EducaçãoДокумент1 страницаFunções de Um Técnico Superior de EducaçãoSónia FerreiraОценок пока нет
- Queimar Gordura com Treinos BásicosДокумент6 страницQueimar Gordura com Treinos Básicosmanolo_paganiОценок пока нет
- NEOPLASIASДокумент23 страницыNEOPLASIASAsiloEspinosaОценок пока нет
- 10 Ano Geologia A Terra e Os Seus Subsistemas em Interaco 1223034690877732 8Документ34 страницы10 Ano Geologia A Terra e Os Seus Subsistemas em Interaco 1223034690877732 8pelosirosnanetОценок пока нет
- Foucault GovernabilidadeДокумент2 страницыFoucault GovernabilidadeanacandidapenaОценок пока нет
- Dissídio Retroativo - Cálculos INSS, FGTS e geração da SEFIPДокумент7 страницDissídio Retroativo - Cálculos INSS, FGTS e geração da SEFIPLeopoldoLealОценок пока нет
- Ventosaterapia para dores muscularesДокумент15 страницVentosaterapia para dores muscularesDaniel Da Silva LimaОценок пока нет
- Gestão Ambiental e Energias RenováveisДокумент77 страницGestão Ambiental e Energias RenováveisHugo CarvalhoОценок пока нет
- Quesitos em Medicina LegalДокумент18 страницQuesitos em Medicina LegalTen_SevalhoОценок пока нет
- Lista Hidro 2Документ4 страницыLista Hidro 2Flaviana Martins Conde OliveiraОценок пока нет
- A Importância Da ArgumentaçãoДокумент2 страницыA Importância Da ArgumentaçãoSuMiottoОценок пока нет
- Boate AzulДокумент73 страницыBoate AzulRaphael Marques DinizОценок пока нет
- ABNT NBR 14951defeitos de Pintura PDFДокумент4 страницыABNT NBR 14951defeitos de Pintura PDFrenanskОценок пока нет
- RPG Mundo AnimeДокумент58 страницRPG Mundo Animemalonejesus74Оценок пока нет
- Roteiro Camara EscuraДокумент2 страницыRoteiro Camara Escuracristavo20084412100% (1)