Академический Документы
Профессиональный Документы
Культура Документы
Determinación de Calcio en Agua Mediante Precipitación Homogenea Como Oxalato de Calcio
Загружено:
Jueneto0 оценок0% нашли этот документ полезным (0 голосов)
123 просмотров2 страницыОригинальное название
DETERMINACIÓN DE CALCIO EN AGUA MEDIANTE PRECIPITACIÓN HOMOGENEA COMO OXALATO DE CALCIO.docx
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
123 просмотров2 страницыDeterminación de Calcio en Agua Mediante Precipitación Homogenea Como Oxalato de Calcio
Загружено:
JuenetoАвторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 2
DETERMINACIÓN DE CALCIO EN AGUA MEDIANTE PRECIPITACIÓN HOMOGENEA COMO
OXALATO DE CALCIO
La adición de un agente precipitante, aun gota a gota, produce centros
locales de alta concentración, lo cual causa la formación de muchos
núcleos primarios pequeños. Para evitar la formación de centros de alta
concentración de iones, es posible, algunas veces, producir lentamente el
agente precipitante y de manera uniforme, mediante una reacción química
lenta. De esta forma no es posible que se presente un exceso del reactivo
precipitante, ya que este aparece gradualmente y de manera uniforme en
toda la solución y de inmediato reacciona con el analito. Como
consecuencia la sobresaturación relativa se mantiene baja durante toda la
precipitación. Las reacciones más aplicadas para este tipo de
precipitación son las hidrólisis de ciertos compuestos y algunas
reacciones de oxido-reducción.
La ventaja principal de la precipitación por métodos homogéneos es
probablemente la de que los cristales precipitados por estos métodos
crecen más lentamente y producen partículas más perfectas, regulares y de
mayor tamaño que las producidas por métodos ordinarios. Los precipitados
obtenidos por métodos homogéneos están frecuentemente más libres de
contaminación por coprecipitación y generalmente pueden ser calcinados
hasta peso constante a temperaturas inferiores a las requeridas para
precipitados obtenidos por otros métodos, debido a su carácter orgánico.
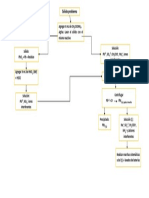
Ocurre que el precipitado es soluble en medio ácido al ser el ión oxalato
una base débil, la cual permite la lenta precipitación mediante la
disolución de Ca2+ y C2O42- en medio ácido y gradualmente elevando el pH
por descomposición térmica de úrea.
La figura muestra el termograma obtenido durante la calcinación de un precipitado de oxalato de
calcio, obtenido inicialmente como monohidrato, CaC2O4.H2O. Se observa que la curva de pirólisis
muestra mesetas durante un rango de temperatura que coincide con cada una de las etapas de
conversión: de CaC2O4.H2O a CaC2O4, de CaC2O4 a CaCO3 y finalmente de CaCO3 a CaO. De
acuerdo con el termograma el precipitado podría calcinarse a aproximadamente 300°C y pesar la
especie CaC2O4, pero esto no es conveniente debido a su tendencia a fijar agua de la atmósfera
introduciendo errores durante la pesada. Por las mismas razones no es conveniente calcinar a
temperaturas superiores a 850°C y pesar como CaO. La técnica universalmente aceptada es
calcinar a 500 ±25°C y pesar como CaCO3; el cálculo de la cantidad de calcio presente en la
muestra a partir de la masa de éste es un problema estequiométrico elemental.
Muchos ejemplos requieren que el precipitado sea calcinado a temperatura elevada para
convertirlo en alguna otra especie química que sea perfectamente conocida. Estos procedimientos
de calcinación se emplean por varias razones: 1) imposibilidad de asegurar una composición
química definida del precipitado por simple secado; 2) uso de un electrolito de lavado poco volátil
a la temperatura de secado; 3) asegurar la eliminación de agua fuertemente adsorbida u ocluida
durante la precipitación. Los precipitados gelatinosos de óxidos de Fe(III) y de Al(III) por ejemplo,
contienen agua ocluida y adsorbida que solo se elimina por calentamiento a más de 1000ºC.
Вам также может понравиться
- Calidad del agua para estudiantes de ciencias ambientalesОт EverandCalidad del agua para estudiantes de ciencias ambientalesОценок пока нет
- Examen PruebaДокумент49 страницExamen Pruebatecuemee70% (57)
- Reutilización de aguas residuales en la industria azucarera y AlcoholeraОт EverandReutilización de aguas residuales en la industria azucarera y AlcoholeraОценок пока нет
- Informe CatalisisProcesos de Obtención de Ácido SulfúricoДокумент6 страницInforme CatalisisProcesos de Obtención de Ácido SulfúricoIvan IvenianОценок пока нет
- El Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásОт EverandEl Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásОценок пока нет
- Sulfato de Cobre PentahidratadoДокумент5 страницSulfato de Cobre PentahidratadoKike MenesesОценок пока нет
- Curso SX-CR'Документ57 страницCurso SX-CR'Diego Furió100% (2)
- Determinación de Aluminio en Una MuestraДокумент3 страницыDeterminación de Aluminio en Una Muestracintyh_1100% (2)
- Producción de Metanol (Parte 2)Документ37 страницProducción de Metanol (Parte 2)richardОценок пока нет
- Purificacion SalmueraДокумент127 страницPurificacion SalmueraAugusto Ruben Colque AntonioОценок пока нет
- Laboratorio de Dosis OptimaДокумент15 страницLaboratorio de Dosis Optimasantix_Sagitario100% (1)
- Asignacion de Tarea Segura (Ats) - Anexo 1: Instalación de Malla Electro SoldadaДокумент2 страницыAsignacion de Tarea Segura (Ats) - Anexo 1: Instalación de Malla Electro SoldadaFernandez Villafuerte Christian100% (1)
- Resumen Formulación Magistral Tema 3Документ5 страницResumen Formulación Magistral Tema 3purple rainbowОценок пока нет
- Cálculo Cargas CombustiblesДокумент5 страницCálculo Cargas CombustiblesyukiОценок пока нет
- Acido AdipicoДокумент9 страницAcido AdipicoChucho GonzálezОценок пока нет
- Teoria - 1 - Purificacion SalmueraДокумент111 страницTeoria - 1 - Purificacion Salmueraruben colqueОценок пока нет
- 7 - Teoria - Purificacion SalmueraДокумент127 страниц7 - Teoria - Purificacion Salmueraruben colqueОценок пока нет
- Practica N 5Документ7 страницPractica N 5kate vilcapaza CharcaОценок пока нет
- Informe 1 QIIE Proceso SolvayДокумент7 страницInforme 1 QIIE Proceso SolvayIgnacio Peña MendezОценок пока нет
- Informe 1 QIIE Proceso SolvayДокумент7 страницInforme 1 QIIE Proceso SolvayIgnacio Peña MendezОценок пока нет
- Proceso de Elaboración de Acido NítricoДокумент6 страницProceso de Elaboración de Acido NítricoErik Arias CoronelОценок пока нет
- Proceso de OstwaldДокумент4 страницыProceso de OstwaldSinai ArguelloОценок пока нет
- Ablandamiento Con CalДокумент16 страницAblandamiento Con CalSergio ArevaloОценок пока нет
- Exposicion de TegДокумент28 страницExposicion de TegYhoselyn LinnaОценок пока нет
- Ablandamiento Con Cal Word 1Документ17 страницAblandamiento Con Cal Word 1Jessica L PeñaОценок пока нет
- Procedimientos Diferenciados para Obtener Cloruro de Sodio y Clorato de SodioДокумент4 страницыProcedimientos Diferenciados para Obtener Cloruro de Sodio y Clorato de SodioDome CastellanoОценок пока нет
- Análisis Gravporcomb1Документ27 страницAnálisis Gravporcomb1Mariho Jiménez RíosОценок пока нет
- Preparación de NaOH Medios No ElectroquimicosДокумент2 страницыPreparación de NaOH Medios No ElectroquimicosIvan IvenianОценок пока нет
- Analisis GravimetricoДокумент32 страницыAnalisis GravimetricoEudoro Trejos UrbinaОценок пока нет
- Acid SuccinicДокумент3 страницыAcid SuccinicHector Millan FrancoОценок пока нет
- 2.docx GravimetriaДокумент4 страницы2.docx GravimetriaAngie Massiel Salvador de la cruzОценок пока нет
- Gravimetria Del CalcioДокумент14 страницGravimetria Del CalcioShirley MendozaОценок пока нет
- Anal It 1Документ16 страницAnal It 1Vanessa AguasОценок пока нет
- Industria Quimica Acidos - Clase N 3Документ35 страницIndustria Quimica Acidos - Clase N 3Rosario ABОценок пока нет
- GravimetriaДокумент16 страницGravimetriaElionay Sallo TupayachiОценок пока нет
- Obtencion de Fenol Ac PreviasДокумент10 страницObtencion de Fenol Ac PreviasRoge PérezОценок пока нет
- Según El Diseño de Procesos Químicos de Robin SmithДокумент4 страницыSegún El Diseño de Procesos Químicos de Robin SmithOscar Lopez AguilarОценок пока нет
- Resumen GravimetriaДокумент6 страницResumen GravimetriaGiuliana MachucaОценок пока нет
- Acido SulfuricoДокумент13 страницAcido SulfuricoRoxana Ethel FriasОценок пока нет
- Determinacion Gravimetrica de So3 en Yeso PDFДокумент10 страницDeterminacion Gravimetrica de So3 en Yeso PDFJean Pierre Gerónimo FloresОценок пока нет
- Ablandamiento Con Cal - Soda AshДокумент5 страницAblandamiento Con Cal - Soda AshJuan Carlos Marcano AcostaОценок пока нет
- Ablandamiento Con CalДокумент5 страницAblandamiento Con CalAna Maria Landaeta RamosОценок пока нет
- Cap 7, Control de La CorrosionДокумент11 страницCap 7, Control de La CorrosionFrancisco SanchezОценок пока нет
- CarbonataciónДокумент2 страницыCarbonataciónXander TorresОценок пока нет
- Métodos de Síntesis PrecipitaciónДокумент35 страницMétodos de Síntesis PrecipitaciónMarcela MolinaОценок пока нет
- LAB 11CaO-paddreДокумент7 страницLAB 11CaO-paddreRonald SulcaОценок пока нет
- Demanda Quimica de Oxigeno (Dqo)Документ4 страницыDemanda Quimica de Oxigeno (Dqo)Carlo Amaro Mera MatienzoОценок пока нет
- Hidroxido de PotasioДокумент5 страницHidroxido de PotasioFrank Jhoel ICОценок пока нет
- 4to Informe de Minería y Medio AmbienteДокумент4 страницы4to Informe de Minería y Medio AmbienteJonathan Gomero CarlosОценок пока нет
- Obtención Del Benzoato de EtiloДокумент4 страницыObtención Del Benzoato de EtiloEduardoОценок пока нет
- Drenaje AlcalinoДокумент4 страницыDrenaje Alcalinojhony ismaelОценок пока нет
- Preparación de Soluciones Valoradas de Ácidos y BasesДокумент5 страницPreparación de Soluciones Valoradas de Ácidos y BasesBerenice PérezОценок пока нет
- Sintesis Del Mono Cloroacetico TextoДокумент4 страницыSintesis Del Mono Cloroacetico TextoWilly Alexander López AlvaОценок пока нет
- Identificación de Calcio Por Tres MétodosДокумент4 страницыIdentificación de Calcio Por Tres Métodosalejis07Оценок пока нет
- En Qué Tipos de Análisis Se Pueden Emplear La Técnica Volumétrica Que Se Realizó en El LaboratorioДокумент4 страницыEn Qué Tipos de Análisis Se Pueden Emplear La Técnica Volumétrica Que Se Realizó en El Laboratoriobrayan felipe de hoyos jimenezОценок пока нет
- Fundamentos de Volumetría de Formación de Complejos, Precipitados y Oxido ReducciónДокумент11 страницFundamentos de Volumetría de Formación de Complejos, Precipitados y Oxido ReducciónJOSE EDUARDO GONZALEZ LOPEZОценок пока нет
- Trabajo de InvestigacionДокумент13 страницTrabajo de InvestigacionTania OrellanaОценок пока нет
- Procesos Claus Dic 2 2021Документ56 страницProcesos Claus Dic 2 2021Mary Carmen MartinezОценок пока нет
- Gas de Sintesis. Sintesis Del Amoniaco y El MetanolДокумент13 страницGas de Sintesis. Sintesis Del Amoniaco y El MetanolGilbert Ramos100% (1)
- Procesos Quimicos Industriales-Produccion de AmoniacoДокумент23 страницыProcesos Quimicos Industriales-Produccion de AmoniacoRenzo Acevedo CanoОценок пока нет
- Determinación de Calcio en Agua Mediante Precipitación Homogenea Como Oxalato de CalcioДокумент2 страницыDeterminación de Calcio en Agua Mediante Precipitación Homogenea Como Oxalato de CalcioJuenetoОценок пока нет
- Procedimiento Practica 8Документ9 страницProcedimiento Practica 8JuenetoОценок пока нет
- Procedimiento Proyecto BateriasДокумент1 страницаProcedimiento Proyecto BateriasJuenetoОценок пока нет
- Sustancias TóxicasДокумент1 страницаSustancias TóxicasJuenetoОценок пока нет
- Blah GraviДокумент3 страницыBlah GraviJuenetoОценок пока нет
- Buen Material para Muchas CosasДокумент1 страницаBuen Material para Muchas CosasJuenetoОценок пока нет
- Tablas y Procedimiento 2Документ4 страницыTablas y Procedimiento 2JuenetoОценок пока нет
- Cinética QuímicaДокумент2 страницыCinética QuímicaJuenetoОценок пока нет
- CalculosДокумент3 страницыCalculosJuenetoОценок пока нет
- Ni IdeaДокумент1 страницаNi IdeaJuenetoОценок пока нет
- IntroducciónДокумент1 страницаIntroducciónJuenetoОценок пока нет
- IntroducciónДокумент1 страницаIntroducciónJuenetoОценок пока нет
- Informe IIДокумент10 страницInforme IIJuenetoОценок пока нет
- 14852Документ6 страниц14852JuenetoОценок пока нет
- HannahhhДокумент2 страницыHannahhhJuenetoОценок пока нет
- ResumenДокумент19 страницResumenJuenetoОценок пока нет
- Hannah MontanaДокумент5 страницHannah MontanaJuenetoОценок пока нет
- Tablas InformeДокумент2 страницыTablas InformeJuenetoОценок пока нет
- HannahhhДокумент2 страницыHannahhhJuenetoОценок пока нет
- P HДокумент2 страницыP HJuenetoОценок пока нет
- Hannah MontanaДокумент1 страницаHannah MontanaJuenetoОценок пока нет
- HannДокумент3 страницыHannJuenetoОценок пока нет
- Intro Ducci OnДокумент1 страницаIntro Ducci OnJuenetoОценок пока нет
- Datos Practica PEДокумент1 страницаDatos Practica PEJuenetoОценок пока нет
- Pendulo Simple Pre-LaboratorioДокумент1 страницаPendulo Simple Pre-LaboratorioJuenetoОценок пока нет
- Pre Informe QuímicaДокумент5 страницPre Informe QuímicaJuenetoОценок пока нет
- Pendu LoДокумент1 страницаPendu LoJuenetoОценок пока нет
- Emile Durkhei1Документ25 страницEmile Durkhei1JuenetoОценок пока нет
- Error EsДокумент2 страницыError EsJuenetoОценок пока нет
- ForjaДокумент82 страницыForjaEder Mendoza100% (1)
- Avance PrecipitacionesДокумент15 страницAvance PrecipitacionesKleiner ArevaloОценок пока нет
- EJERCICIOS TermodinamicaДокумент3 страницыEJERCICIOS TermodinamicaKarina M Apraez GОценок пока нет
- S 1 - Legis Gral. Sector Elect PDFДокумент60 страницS 1 - Legis Gral. Sector Elect PDFEdison Ponte AyalaОценок пока нет
- Sem 02 - Sesion 4 - 2023 - 1Документ21 страницаSem 02 - Sesion 4 - 2023 - 1Mateo LudeñaОценок пока нет
- V3.4 PHOENIX PRESENTACION SIRIUS SOPORTE CLÍNICO ACTUALIZADAFinalДокумент184 страницыV3.4 PHOENIX PRESENTACION SIRIUS SOPORTE CLÍNICO ACTUALIZADAFinalAlejandra Silvia Arando VelasquezОценок пока нет
- Preinfotme de Fisica FENOMENOLOGIAДокумент8 страницPreinfotme de Fisica FENOMENOLOGIADiego Hernan Plazas CurreaОценок пока нет
- Automatizacion de Una DepuradoraДокумент122 страницыAutomatizacion de Una DepuradoraIván CascudoОценок пока нет
- Taller Notacion Cientif. y Conversion de UnidДокумент3 страницыTaller Notacion Cientif. y Conversion de UnidJorge Ulloa LabrínОценок пока нет
- PDF Volumen de Terraplen DLДокумент3 страницыPDF Volumen de Terraplen DLMaria Isabel Mu�oz CubillosОценок пока нет
- A1U4Документ7 страницA1U4Profesor De FisicaОценок пока нет
- Pliego Hormigon Ciclopeo 40 % PDДокумент1 страницаPliego Hormigon Ciclopeo 40 % PDDavid Aguilar BerriosОценок пока нет
- Esfuerzo Cortante PromedioДокумент7 страницEsfuerzo Cortante PromediomarcosОценок пока нет
- ActividadCentral - U1Документ4 страницыActividadCentral - U1Matias Cazanave AkdОценок пока нет
- Informe Lectura de FacturasДокумент4 страницыInforme Lectura de FacturasCristhian CubidesОценок пока нет
- Diseño de Sifon InvertidoДокумент3 страницыDiseño de Sifon Invertidoyury caceres ninaОценок пока нет
- Programa Analitico Asignatura 52111 4 655962 3Документ2 страницыPrograma Analitico Asignatura 52111 4 655962 3Andres VerdugoОценок пока нет
- Droga DeporteddДокумент3 страницыDroga DeporteddLuisa LeenОценок пока нет
- Productos NotablesДокумент5 страницProductos NotablesAlfredo PardoОценок пока нет
- EXAMENESДокумент26 страницEXAMENESAngel BracamonteОценок пока нет
- Tiempos de RecorridoДокумент12 страницTiempos de RecorridoCondori Aruquipa Pamela AdelaidaОценок пока нет
- Dibujo Técnico InformeДокумент21 страницаDibujo Técnico Informekiki BTS- MochiiОценок пока нет
- Autómatas Cuánticos en La Miniaturización Sin Pérdida de Electrones.Документ49 страницAutómatas Cuánticos en La Miniaturización Sin Pérdida de Electrones.Daniel Flores CorderoОценок пока нет
- Los Diodos de Las Series 1N4000 y 1N5400 - InventableДокумент7 страницLos Diodos de Las Series 1N4000 y 1N5400 - Inventableedy985Оценок пока нет
- La Inteligencia Visual-EspacialДокумент10 страницLa Inteligencia Visual-EspacialDoris GarciaОценок пока нет