Академический Документы
Профессиональный Документы
Культура Документы
Diagramas de Fase
Загружено:
Pedro Garcia ArgomedoОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Diagramas de Fase
Загружено:
Pedro Garcia ArgomedoАвторское право:
Доступные форматы
DIAGRAMA DE FASES
PHASES DIAGRAM
GARCÍA ARGOMEDO PEDRO JOSÉ
UNIVERSIDAD NACIONAL DE TRUJILLO, 130007, TRUJILLO - PERÚ
Facultad de INGENIERÍA QUÍMICA, Universidad Nacional de Trujillo. Av. Juan Pablo
II s/n – Ciudad Universitaria, Trujillo, Perú.
pedrito1998_9@hotmail.com (P. García).
RESUMEN
Mediante el presente informe se trata de explicar a detalle acerca de las propiedades
coligativas las cuales representan las relaciones observadas entre la interacción del soluto con
el solvente donde se estudian además de las partículas y la concentración de los
componentes comportamientos dados en el cambio de variables como presión y
temperatura, y la incidencia de ello en la disolución.
El objetivo fue determinar de manera experimental la masa molar de un soluto desconocido,
aplicando las ecuaciones mostradas posteriormente y algunos datos bibliográficos.
Para ello utilizamos una balanza, equipo de destilación a reflujo particular (termómetros con
escala diferente a la Celsius y una pequeña bomba en el interior del balón que hacia que el
liquido este en contacto con el mercurio del termómetro y no solo el vapor).
Palabras clave: constante de ebullición, propiedades coligativas.
ABSTRACT
Through this report we try to explain in detail about the colligative properties which represent
the relationships observed between the interaction of the solute with the solvent where the
particles and the concentration of the components are studied. pressure and temperature,
and the incidence of this in the solution.
The objective was to experimentally determine the molar mass of an unknown solute, applying
the equations shown below and some bibliographic data.
For this we use a scale, special reflux distillation equipment (thermometers with different scale
to Celsius and a small pump inside the balloon that made the liquid in contact with the mercury
of the thermometer and not only the vapor).
Keywords: constant boiling, colligative properties.
INTRODUCCIÓN de materia. La representación de una
mezcla en un diagrama permite
Como las propiedades de un material determinar fácilmente si esta se encuentra
depende del tipo, número, cantidad y en equilibrio de fase o no y, en caso de ser
forma de las fases presentes, y pueden afirmativo, cuáles son sus fases en
cambiarse alterando estas cantidades, es equilibrio, las composiciones de esas fases
esencial conocer: y las cantidades relativas de cada una de
ellas. Sin embargo, los diagramas de fases,
- Las condiciones bajo las cuales o las representaciones gráficas, tienen
existen estas fases. varias limitaciones: así, por ejemplo, la
representación de sistemas de mas de tres
- Las condiciones bajo las cuales componentes son siempre parciales, y por
ocurrirá un cambio en la fase. lo tanto es posible tomar decisiones
incorrectas porque la información utilizada
Se ha acumulado gran información es incompleta.
respecto a los cambios de fase, en
*Cisternas
L. A. (2009), “Diagrama de fases
muchos sistemas de aleaciones, y la mejor
manera de registrar estos casos es por y su aplicación”, Ed. Reverté S. A.,
medio de diagramas de fase, o también Barcelona, pp. 18-19.
conocido como diagramas de equilibrio o
constitucionales.
MATERIAL Y MÉTODOS
Para especificar el estado de equilibrio es
necesario especificar 3 variables
independientes, que pueden controlarse MATERIAL:
externamente, que son: temperatura,
presión y composición. Si se supone que la Tubos de ensayo
presión es constante con valor Balanza Analítica
atmosférico, entonces nos quedará en el Termómetro
diagrama temperatura y composición. Cronómetro
Naftil-Amina
p-nitrotolueno
*¿QUÉ ES UN DIAGRAMA DE FASES?
Un diagrama de fases es una PROCEDIMIENTO:
representación gráfica de las condiciones
de equilibrio en función de magnitudes - Se mezclo Naftil-amina y p-nitrotolueno,
como la concentración de las en un tubo de ensayo, en diferentes
disoluciones, la temperatura y la presión. proporciones para así obtener
Desde un punto de vista matemático, un diferentes composiciones de soluto
gráfico 𝐺 = (𝑣, 𝑒) es un modelo discreto de (Naftil-amina) y solvente (p-
un conjunto de vértices 𝑣 y un conjunto de nitrotolueno).
aristas 𝑒 que unen los vértices; en el caso
de los diagramas de fases los vértices - Así mismo se introdujo los reactivos
representan los componentes puros,
puros por separado.
compuestos, puntos eutécticos, puntos de
transición y de saturación múltiple, etc.,
mientras que las aristas representan curvas - Se calentó en baño maría la mezcla
de saturación y líneas de reparto. hasta el cambio de fase (de solido a
liquido).
Los diagramas de fase se utilizan
ampliamente porque en ellos es más fácil - Se enfriaron las soluciones o mezclas,
entender el comportamiento de un tomando la temperatura cada 10 seg.
sistema en equilibrio. Pero, además, estos Para obtener la gráfica.
diagramas también se utilizan para
representar procesos y realizar balances
- Una vez obtenida las curvas de las REFERENCIAS BIBLIOGRÁFICAS
soluciones, se pudo realizar el diagrama
de fases de la mezcla en cuestión.
Atkins P., de Paula J. (2007), “Química
Física”, Editorial Medica Panamericana, 8ª
edición, Buenos Aires, pp. 151-152
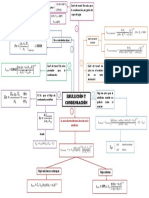
RESULTADOS Y DISCUSIÓN
Experimento 1
𝑚𝐵 = 1.8981 𝑔
𝐾𝑔𝐴 = 0.111 𝑘𝑔
𝐾𝑒(𝐻2𝑂 ) = 0.513 𝐾 ∗ 𝑘𝑔−1 ∗ 𝑚𝑜𝑙 −1
𝑇𝐻2𝑂 = 3.51
𝑇𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 = 3.65
0.513 ∗ 1.8981
𝑀𝐵 =
(3.52 − 3.51) ∗ 0.111
𝑀𝐵 = 877.23 𝑔/𝑚𝑜𝑙
Experimento 2
𝑚𝐵 = 4.3308 𝑔
𝐾𝑔𝐴 = 0.111 𝑘𝑔
𝐾𝑒(𝐻2𝑂 ) = 0.513 𝐾 ∗ 𝑘𝑔−1 ∗ 𝑚𝑜𝑙 −1
𝑇𝐻2𝑂 = 3.51
𝑇𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 = 3.65
0.513 ∗ 4.3308
𝑀𝐵 =
(3.65 − 3.51) ∗ 0.111
𝑀𝐵 = 142.97 𝑔/𝑚𝑜𝑙
Como podemos observar, el resultado del
experimento 1 está bastante alejado del
valor teórico (Mglucosa = 180.156 g/mol). Esto
puede haber ocurrido por no esperar el
tiempo suficiente para dar lectura al
nuevo punto de ebullición cuando se
mezcló agua y glucosa.
CONCLUSIONES
Вам также может понравиться
- 2 7 1 - Procedimiento-AlcoholemiaДокумент2 страницы2 7 1 - Procedimiento-AlcoholemiaRicardo Alcudia0% (1)
- Instrucciones para evaluación de prueba figuras incompletasДокумент3 страницыInstrucciones para evaluación de prueba figuras incompletasYadira Delgado Galarza92% (13)
- Examen 2 Programacion LinealДокумент4 страницыExamen 2 Programacion LinealSandovalGabrielaОценок пока нет
- PLANIFICACIÓN CORTA CyTДокумент6 страницPLANIFICACIÓN CORTA CyTPedro Garcia ArgomedoОценок пока нет
- T4 - Principios Activos y Método de ExtracciónДокумент5 страницT4 - Principios Activos y Método de ExtracciónPedro Garcia ArgomedoОценок пока нет
- Trab. 01 - HCL - PiiДокумент35 страницTrab. 01 - HCL - PiiPedro Garcia ArgomedoОценок пока нет
- Inv. Formativa - Curtido - 2Документ23 страницыInv. Formativa - Curtido - 2Pedro Garcia ArgomedoОценок пока нет
- Punto I, III, VIДокумент6 страницPunto I, III, VIPedro Garcia ArgomedoОценок пока нет
- Trab. 01 - HCL - PiiДокумент35 страницTrab. 01 - HCL - PiiPedro Garcia ArgomedoОценок пока нет
- G#2 - Elaboración de YesoДокумент15 страницG#2 - Elaboración de YesoPedro Garcia ArgomedoОценок пока нет
- Actividad 02 - G1 - MedicinaДокумент2 страницыActividad 02 - G1 - MedicinaPedro Garcia ArgomedoОценок пока нет
- Actividad 01 - Prod. NaturalesДокумент6 страницActividad 01 - Prod. NaturalesPedro Garcia ArgomedoОценок пока нет
- Elaboración de PinturasДокумент27 страницElaboración de PinturasPedro Garcia ArgomedoОценок пока нет
- Aspectos de ToxicologíaДокумент3 страницыAspectos de ToxicologíaPedro Garcia ArgomedoОценок пока нет
- Procesos industriales para HClДокумент9 страницProcesos industriales para HClPedro Garcia Argomedo0% (1)
- Práctica N. 02 LouДокумент7 страницPráctica N. 02 LouPedro Garcia ArgomedoОценок пока нет
- Trabajo Final - CurtidoДокумент14 страницTrabajo Final - CurtidoPedro Garcia ArgomedoОценок пока нет
- Volúmenes y Capacidades RespiratoriasДокумент5 страницVolúmenes y Capacidades RespiratoriasPedro Garcia ArgomedoОценок пока нет
- Volúmenes y Capacidades RespiratoriasДокумент5 страницVolúmenes y Capacidades RespiratoriasPedro Garcia ArgomedoОценок пока нет
- Presion ArterialДокумент5 страницPresion ArterialPedro Garcia ArgomedoОценок пока нет
- Práctica #01Документ9 страницPráctica #01Ruben Antonio Gomez RodríguezОценок пока нет
- MapaДокумент1 страницаMapaPedro Garcia ArgomedoОценок пока нет
- MapaДокумент1 страницаMapaPedro Garcia ArgomedoОценок пока нет
- Diseño de sistema de bombeo para transporte de aguaДокумент8 страницDiseño de sistema de bombeo para transporte de aguaPedro Garcia ArgomedoОценок пока нет
- Factores de visión y transferencia de calor por radiación entre superficiesДокумент1 страницаFactores de visión y transferencia de calor por radiación entre superficiesPedro Garcia ArgomedoОценок пока нет
- EUCALIPTOДокумент7 страницEUCALIPTOPedro Garcia ArgomedoОценок пока нет
- Tipeo EbulliciomДокумент1 страницаTipeo EbulliciomPedro Garcia ArgomedoОценок пока нет
- Siembra y Cosecha de AguaДокумент7 страницSiembra y Cosecha de AguaPedro Garcia ArgomedoОценок пока нет
- Facultad de Ing. Química: Universidad Nacional de TrujilloДокумент9 страницFacultad de Ing. Química: Universidad Nacional de TrujilloPedro Garcia ArgomedoОценок пока нет
- Transferencia de Calor en El Exterior de Diferentes....Документ1 страницаTransferencia de Calor en El Exterior de Diferentes....Pedro Garcia ArgomedoОценок пока нет
- Siembra y Cosecha de AguaДокумент7 страницSiembra y Cosecha de AguaPedro Garcia ArgomedoОценок пока нет
- Exploración Bibliográfica InicialДокумент8 страницExploración Bibliográfica InicialPedro Garcia ArgomedoОценок пока нет
- BibliografíaДокумент1 страницаBibliografíaPedro Garcia ArgomedoОценок пока нет
- Tipo de Liderazgo de Nelson MandelaДокумент8 страницTipo de Liderazgo de Nelson MandelaEuramosОценок пока нет
- Guia Textos Narrativos 5°Документ2 страницыGuia Textos Narrativos 5°Nadia Sanchez SeguraОценок пока нет
- Evaluacion Und 2 Gerencia de ProyectosДокумент8 страницEvaluacion Und 2 Gerencia de ProyectosYanahir Castro BustosОценок пока нет
- Unidad 2 - 1 Macroprocesos ComercialДокумент28 страницUnidad 2 - 1 Macroprocesos ComercialEdgar Magne JiménezОценок пока нет
- Montecristi TesisДокумент58 страницMontecristi TesisCristobal Argenis CruzОценок пока нет
- Resolucion de Direccion Ejecutiva-000377-2022-De - AnexosДокумент75 страницResolucion de Direccion Ejecutiva-000377-2022-De - AnexosAndres RS ZKОценок пока нет
- Encuesta a estudiantes FIA UNI sobre uso tiempo libreДокумент44 страницыEncuesta a estudiantes FIA UNI sobre uso tiempo libreKeith Salazar ArotomaОценок пока нет
- Manual BDAS01Документ132 страницыManual BDAS01Harold ParedesОценок пока нет
- 3791-2002 - Formulacion y Preparacion de Un Plan de Actuacion para Emergencias en Instalaciones EducativasДокумент11 страниц3791-2002 - Formulacion y Preparacion de Un Plan de Actuacion para Emergencias en Instalaciones EducativasVicente BerenguelОценок пока нет
- Relación entre ciencia, método científico e importancia de la investigaciónДокумент3 страницыRelación entre ciencia, método científico e importancia de la investigaciónVictor Manuel Asmat Rojas50% (2)
- Medicina NuclearДокумент5 страницMedicina NuclearsandyОценок пока нет
- Resumen Capitulo 1 y 2 CengelДокумент3 страницыResumen Capitulo 1 y 2 CengelHerald LopezОценок пока нет
- Tres Aportes Educacion Popular Latinoamericana Pedagogia ActualДокумент11 страницTres Aportes Educacion Popular Latinoamericana Pedagogia ActualJose Alex Moron100% (1)
- BiotipologiaДокумент76 страницBiotipologiaChristian Toluenda33% (3)
- Tarea Estadista 4to Periodo Incluyendo Ejercicio 1,2,3,4,5Документ7 страницTarea Estadista 4to Periodo Incluyendo Ejercicio 1,2,3,4,5Gerardo EscobarОценок пока нет
- Acuerdos de La Mesa de Dialogo Con QuellavecoДокумент10 страницAcuerdos de La Mesa de Dialogo Con QuellavecoRonny F SarDonОценок пока нет
- Internacional Situacionista - Sobre La Miseria en El Medio Estudiantil (Media Carta - Lectura)Документ28 страницInternacional Situacionista - Sobre La Miseria en El Medio Estudiantil (Media Carta - Lectura)Alguien AnonimoОценок пока нет
- Alerta Ovni: Superstición PlatillistaДокумент10 страницAlerta Ovni: Superstición PlatillistaRicardo Campo PérezОценок пока нет
- 19 PD - Fisica Selección 4Документ8 страниц19 PD - Fisica Selección 4WALTER OLIVARI RAMIREZОценок пока нет
- Carta de Compromiso 5to SecДокумент3 страницыCarta de Compromiso 5to SecJorge Alejandro Cano BellidoОценок пока нет
- Espacios Completamente RegularesДокумент5 страницEspacios Completamente RegularesLeonardo CaroОценок пока нет
- Cuaderno de Informes - Mecanica Aplicada - Poleas - Maquina Cepilladora - N 3Документ14 страницCuaderno de Informes - Mecanica Aplicada - Poleas - Maquina Cepilladora - N 3Jkjvj ArelyОценок пока нет
- Aritmética 2do AñoДокумент88 страницAritmética 2do AñoJ-AntonyQuispePaitanОценок пока нет
- Direccion de La EmpresaДокумент40 страницDireccion de La EmpresaGerardo RodríguezОценок пока нет
- Determinación de la viscosidad de un fluido newtoniano entre placas paralelasДокумент4 страницыDeterminación de la viscosidad de un fluido newtoniano entre placas paralelasyhorki mamani letonaОценок пока нет
- Actividad 15 Inferencias Inmediatas Del Cuadro de OposiciónДокумент2 страницыActividad 15 Inferencias Inmediatas Del Cuadro de OposiciónRafael Scamander100% (1)
- Rol Del Quimico Farmaceutico A Nivel Nacional e InternacionalДокумент7 страницRol Del Quimico Farmaceutico A Nivel Nacional e InternacionalJhon's AguilarОценок пока нет