Академический Документы
Профессиональный Документы
Культура Документы
Fisico Quimica
Загружено:
MartaАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Fisico Quimica
Загружено:
MartaАвторское право:
Доступные форматы
1.
Material de laboratório
Instrumentos e/ou equipamentos utilizados pelos químicos para realizar
experiências, efetuar medições, estudar substâncias ou recolher dados.
Copos de precipitação
ou Gobelés Balão volumétrico Proveta
Pinça para tubos de ensaio Bico de Bunsen Garrafa de esguicho
Erlenmeyer ou Matraz Excicador Frasco Conta-gotas
2. Símbolos de perigo
Significado do símbolo
pictogramas de perigo
Existem um conjunto de símbolos que advertem para algumas propriedades
perigosas das substâncias
Verificar os rótulos dos frascos, ajuda a saber quais as precauções necessárias
para trabalhar em segurança
Inflamável
Manter afastado das chamas, das faíscas, das fontes de calor e da eletricidade
estática.
Explosivo
Manter afastado das chamas, das faíscas, das fontes de calor e da eletricidade
estática.
Comburente
Riscos de explosão ou de incêndio na presença de produtos inflamáveis.
Corrosivo
Corrói a pele e os olhos.
Manipular com óculos e luvas de proteção - Evitar o contacto com a pele,
os olhos e o vestuário.
Perigo grave para a saúde
Perigo de cancro, de alergias e de modificações no ADN.
Perigo para o ambiente
Prejudicial para o meio aquático.
Gás sob pressão
Riscos de explosão sob o efeito do calor ou de queimaduras relacionadas com
o frio.
Toxicidade aguda
Envenena rapidamente mesmo em pequenas doses.
Manipular na hotte com luvas de proteção.
Perigo para a saúde
Irrita os olhos, o nariz e a pele. Riscos de alergias.
Envenena em grandes doses.
3. Cuidados a ter na utilização do produto e exemplos
Ler sempre os rótulos dos produtos químicos com os quais vais trabalhar,
saber quais os cuidados que deve ter com esse produto
Não provar, ingerir, cheirar ou tocar com as mãos em quaisquer
substâncias químicas.
Usar luvas sempre que se manusearem substâncias tóxicas ou corrosivas
4. Classificação de materiais
A variedade de materiais existentes à nossa volta é tão grande que, por uma
questão de organização, aprendemos a classificá-los, para melhor os distinguir,
e essa classificação pode ser feita de diferentes formas. Podemos por exemplo
classificá-los consoante a sua origem em:
Materiais Naturais
Materiais Sintéticos
Materiais naturais
Material Natural tem origem na Natureza e pode ser directamente utilizado pelo
Homem tal como a Natureza o oferece, Material Natural Não Manufacturado -
Pepita de Ouro Madeira
ou pode ser transformado de modo a poder ser utilizado - Material Natural
Manufacturado.
Anel de Ouro Mobília
Materiais Sintéticos
Um Material Sintético é totalmente produzido pelo Homem em laboratório e não
extraído directamente da Natureza.
Nylon Polietileno
5. substâncias e misturas
Os materiais podem também ser classificados em:
Substâncias Puras - É uma substância pura todo o material constituído
apenas por uma substância.
Exemplo: Oxigénio, Água destilada, Dióxido de Carbono, Azoto, Sílica
Misturas de Substâncias - Um material constituído por duas ou mais
substâncias é designado de mistura de substâncias.
Exemplo: Ar, Água do Mar, Água Mineral ou da torneira, Areia, Café
Muitos dos materiais que nos rodeiam resultam da mistura de substâncias
puras, dando origem a misturas.
Tipos de Misturas
Uma mistura de substâncias pode ser classificada em :
Mistura Homogénea - não é possível distinguir os seus diferentes
componentes.
Exemplo, a mistura de água com açúcar é uma mistura homogénea,
pois não é possível distinguir o açúcar da água
Mistura Heterogénea - é possível distinguir os seus diferentes
componentes.
Exemplo, a mistura de água com azeite é uma mistura heterogénea,
pois é possível distinguir a água do azeite.
Mistura Coloidal - os componentes da mistura não se distinguem a olho
nú, mas se usarmos um instrumento de ampliação, como um
microscópio, é possível distinguir os diferentes componentes da mistura
Exemplo, a gota de sangue a olho nú não se consegue identificar os
seus componentes, mas ao observares essa gota ao microscópio,
distinguem-se os glóbulos brancos, os glóbulos vermelhos, as plaqueta
6. Soluções
Uma Mistura Homogénea também pode ser chamada de Solução. Por exemplo,
se misturar água com açúcar, obtenho uma mistura homogénea:
Uma solução de água com açúcar
Solvente + Soluto = Solução
Solvente - encontra-se em maior quantidade, aquele que dissolve
Soluto - encontra-se em menor quantidade , aquele que fica dissolvido
7. Composição quantitativa e qualitativa das soluções.
Composição qualitativa
indica quais os constituintes dessa solução, enquanto que a composição
quantitativa indica a quantidade de cada componente na solução
Sólidas. Ex: aço
o solvente é sólido, e o soluto pode ser sólido, líquido ou gasoso
Líquidas. Ex: perfume
O solvente é líquido, e o soluto pode estar em qualquer um dos estados físicos:
sólido, líquido ou gasoso
Gasosas. Ex: ar
Tanto o solvente como o soluto são gasosos.
Composição quantitativa
De acordo com a quantidade de soluto e de solvente que constitui a solução,
podemos ter soluções mais concentradas ou menos concentrada
As unidades mais comuns são:
grama (g) para a massa;
litro (l) para o volume;
grama por litro (g/l) para a concentração mássica.
8. Concentração ,
Para caracterizar uma solução é necessário conhecer a sua concentração, ou
seja, quanto de cada componente é que existe na solução.
Solução insaturada
Dizer que uma solução é insaturada relativamente a um determinado soluto
quer dizer que, a essa temperatura, ainda é possível dissolver uma maior
quantidade desse soluto nessa solução.
Solução saturada
Uma solução está saturada quando não é possível dissolver nela, a essa
temperatura, uma maior quantidade de soluto. Se a uma solução saturada for
adicionado mais soluto, este ficará por dissolver.
Solução sobressaturada
Em determinadas condições é possível dissolver uma maior quantidade de
soluto numa solução, excedendo o valor da solubilidade a essa temperatura.
Estas soluções são instáveis.
Concentração mássica (cm)
É a relação entre a massa de um determinado soluto e o volume da solução:
m
Cm = ____
v
m - massa do soluto (kg)
V - volume da solução (m3)
A utilização de recursos naturais e a sustentabilidade na Terra
Вам также может понравиться
- Cadernode Encargos Lote 2 Casalda CruzДокумент10 страницCadernode Encargos Lote 2 Casalda CruzMartaОценок пока нет
- Edição de ImagemДокумент3 страницыEdição de ImagemMartaОценок пока нет
- PRECIOUS Identifying CodesДокумент2 страницыPRECIOUS Identifying CodesMartaОценок пока нет
- RCM 101Документ1 страницаRCM 101MartaОценок пока нет
- História 7 DT4Документ3 страницыHistória 7 DT4conceicaoОценок пока нет
- Crescimento Demográfico e Reanimação do Comércio na Baixa Idade MédiaДокумент13 страницCrescimento Demográfico e Reanimação do Comércio na Baixa Idade MédiaMartaОценок пока нет
- GeogДокумент8 страницGeogMartaОценок пока нет
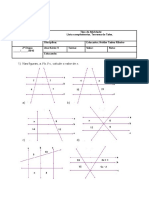
- Ficha de trabalho de Matemática do 7o ano com Teorema de TalesДокумент2 страницыFicha de trabalho de Matemática do 7o ano com Teorema de TalesMartaОценок пока нет
- Energia HidraulicaДокумент6 страницEnergia HidraulicaMartaОценок пока нет
- Teorema de Tales - Lista complementarДокумент8 страницTeorema de Tales - Lista complementarpalmerimОценок пока нет
- CienciasДокумент8 страницCienciasMarta0% (1)
- Soluções QuímicasДокумент37 страницSoluções QuímicasVictória Dutra100% (3)
- Avaliação trimestral de Ciências da Natureza do 2o ano do Ensino MédioДокумент12 страницAvaliação trimestral de Ciências da Natureza do 2o ano do Ensino MédioLeonardo Gomes0% (1)
- Produtos Perigosos ConceitosДокумент20 страницProdutos Perigosos ConceitosLeal SafetyОценок пока нет
- Modelo RelatórioДокумент5 страницModelo RelatórioAndreAmorimOliveiraОценок пока нет
- Apostila Do 2 Ano Noturno QuimicaДокумент34 страницыApostila Do 2 Ano Noturno QuimicacatilioОценок пока нет
- Bíblia Do Cultivo de CannabisДокумент20 страницBíblia Do Cultivo de CannabisJu do LoboОценок пока нет
- Capítulo 7 - PH, Acidez, Alcalinidade e DurezaДокумент28 страницCapítulo 7 - PH, Acidez, Alcalinidade e DurezaMariquinhas Ferreira AntonioОценок пока нет
- Manual Básico LaboratórioДокумент57 страницManual Básico LaboratórioPatrícia BattistellaОценок пока нет
- Relatorio 1 - Solubilidade de Compostos OrganicosДокумент4 страницыRelatorio 1 - Solubilidade de Compostos OrganicosBrunaFariaОценок пока нет
- Metalurgia dos Não-FerrososДокумент60 страницMetalurgia dos Não-FerrososCamilla SilvaОценок пока нет
- Determinação do coeficiente de partição do violeta de gencianaДокумент6 страницDeterminação do coeficiente de partição do violeta de gencianaLuisa BiaОценок пока нет
- AULA PRÁTICA - Fosf PDFДокумент2 страницыAULA PRÁTICA - Fosf PDFCarlos NevesОценок пока нет
- Uff 2013 QuimicoДокумент15 страницUff 2013 QuimicoAdryana SousaОценок пока нет
- Concentrações Das Soluções 2Документ16 страницConcentrações Das Soluções 2GleisonОценок пока нет
- Água de Coco - Métodos de ConservaçãoДокумент36 страницÁgua de Coco - Métodos de Conservaçãowilker_alves48883% (6)
- Química UFMG 2002Документ9 страницQuímica UFMG 2002tremembeОценок пока нет
- AL 2.2 - Soluções A Partir de Solutos SólidosДокумент2 страницыAL 2.2 - Soluções A Partir de Solutos SólidosZélia CoelhoОценок пока нет
- Ciência dos Materiais - Diagramas de FasesДокумент130 страницCiência dos Materiais - Diagramas de FasesWilliam PolОценок пока нет
- Fq7 Teste 3 FinalДокумент6 страницFq7 Teste 3 FinalSofia CavacoОценок пока нет
- Reações em Soluções Aquosas e Estequiometria de SoluçõesДокумент1 страницаReações em Soluções Aquosas e Estequiometria de SoluçõesThaís Campos0% (1)
- Gel TransdérmicoДокумент8 страницGel TransdérmicoWeyla SantosОценок пока нет
- 5-Imperfeições em SólidosДокумент90 страниц5-Imperfeições em SólidoswagsabОценок пока нет
- Condutimetria Coord PDFДокумент203 страницыCondutimetria Coord PDFMichel Assunção100% (1)
- Kps e Solucao TampaoДокумент27 страницKps e Solucao TampaoMaria Clara ValenteОценок пока нет
- Razão e Proporção: Atividade Remota de MatemáticaДокумент5 страницRazão e Proporção: Atividade Remota de MatemáticaTHAIS LAUDELINO COSTA SILVAОценок пока нет
- Cronograma de Laboratório de QuímicaДокумент49 страницCronograma de Laboratório de QuímicaAwdrey VasconcelosОценок пока нет
- ICH Guia 4 - Perfil e Produtos de Degradação em MedicamentosДокумент22 страницыICH Guia 4 - Perfil e Produtos de Degradação em MedicamentosRhye LiОценок пока нет
- Soluções aquosas e cálculos químicosДокумент3 страницыSoluções aquosas e cálculos químicosGraziane Portela100% (1)
- Efeito Residual de Herbicidas No Solo PDFДокумент14 страницEfeito Residual de Herbicidas No Solo PDFCássio TomaziniОценок пока нет
- Biodisponibilidade Bioequivalência Sílvia Storpirtis 2013Документ57 страницBiodisponibilidade Bioequivalência Sílvia Storpirtis 2013Mykel AlexanderОценок пока нет