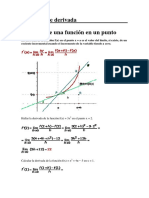
Академический Документы
Профессиональный Документы
Культура Документы
2bc Ex Acido Base 2013 14 Enunciados
Загружено:
Miguel DueRiveАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
2bc Ex Acido Base 2013 14 Enunciados
Загружено:
Miguel DueRiveАвторское право:
Доступные форматы
EXAMEN DE QUÍMICA. REACCIONES ÁCIDO-BASE.
2º BC
APELLIDOS: NOMBRE: GRUPO:
1,5p 1.- Formule o nombre los siguientes compuestos: a) Ácido perclórico; b) Cu2SO3;
c) CH3COOCH3; d) Ácido 2-bromobutanoico; e) Penta-1,3-dieno; f) KH2PO4.
1,5p 2.1. El ácido láctico, HC3H5O3, es un ácido monoprótico, débil con Ka = 1,4 · 10−4. En
contra de lo que se ha dicho toda la vida, parece ser que su acumulación en los músculos, tras
un ejercicio intenso, no es el responsable del dolor de las agujetas. Escriba la ecuación de
disociación del ácido láctico y calcula el valor de Kb de su base conjugada, el anión lactato,
C3H5O3−.
2.2. El pH de los jugos gástricos (formado fundamentalmente por ácido clorhídrico) es
alrededor de 1,7. ¿Cuál es la concentración aproximada de los iones H3O+ en el estómago? ¿Y
la concentración de HCl en el estómago)
1,5p 3.- Se quiere determinar y justificar la causa de la muerte de un individuo. Antes de
morir había ingerido una sustancia que se cree que es ácido barbitúrico, un precursor en la
síntesis de muchos somníferos, cuya masa molar es de 128 g/mol. El ácido barbitúrico es un
ácido monoprótico débil cuya fórmula molecular es HC4H3N2O3. Para ayudar a la identificación,
se valoró una muestra cristalina encontrada de 0,5 g con NaOH 0,1 M y se encontró que en el
punto de equivalencia hubo que añadir 39,1 mL de la base.
a) ¿Pudo ser el ácido barbitúrico la causa de la muerte?
b) Razone, haciendo uso de los equilibrios que tengan lugar, si en el punto de
equivalencia la disolución sería ácida, básica o neutra.
c) ¿Cuál de los siguientes indicadores, cuyos intervalos de viraje figuran a continuación,
usaría en la valoración?
Indicador Color forma ácida Color forma básica Intervalo de viraje
Fenolftaleína Incoloro Rosa 8,0 – 9,5
Tornasol Rojo Azul 6,0 – 8,0
Anaranjado de metilo Rojo Amarillo 3,0 – 4,5
1,5p 4.- Los arándanos necesitan un suelo bastante ácido para prosperar. Razone cuál de
los siguientes fertilizantes nitrogenados es el más adecuado para cultivarlos:
a) Nitrato de amonio, NH4NO3.
b) Disolución acuosa de amoníaco, NH3.
c) Nitrato de sodio, NaNO3.
2p 5.- Un comprimido de aspirina de 600 mg, se compone de ácido acetilsalicílico en un
83,34% y el resto excipiente (sustancia inerte que se mezcla con los medicamentos para darles
consistencia y sabor). Si disolvemos la cantidad de ácido acetilsalicílico que contiene el
comprimido de aspirina en agua hasta tener 80 mL de disolución. Calcule:
a) El grado de disociación del ácido acetilsalicílico.
b) El pH de la disolución.
Datos: El ácido acetilsalicílico es un ácido monoprótico cuya fórmula molecular es HC9H7O4.
Ka = 2,65 · 10−5. Masas atómicas: C = 12; O = 16; H = 1
2p 6.- Se disuelven 10 g de hidróxido de sodio en agua hasta obtener 0,5 L de disolución.
Calcule:
a) La molaridad de la disolución y su pH.
b) El volumen de la disolución acuosa de ácido sulfúrico 0,2 M que se necesita para
neutralizar 20 mL de la disolución anterior.
Datos. Masas atómicas: Na = 23; O = 16; H = 1
Вам также может понравиться
- PDF Conclusion Sistemas de InformacionДокумент1 страницаPDF Conclusion Sistemas de InformacionMiguel DueRiveОценок пока нет
- Ingeniería: Unidad Ii: Determinación de Los Requerimientos Y El Proceso de AnálisisДокумент36 страницIngeniería: Unidad Ii: Determinación de Los Requerimientos Y El Proceso de AnálisisMiguel DueRiveОценок пока нет
- Metodos para Recopilar Informacion: ObjetivosДокумент34 страницыMetodos para Recopilar Informacion: ObjetivosMiguel DueRiveОценок пока нет
- Requerimientos Del Sistema: ObjetivosДокумент38 страницRequerimientos Del Sistema: ObjetivosMiguel DueRiveОценок пока нет
- Análisis de Sistemas IДокумент27 страницAnálisis de Sistemas IMiguel DueRiveОценок пока нет
- Análisis de Sistemas IДокумент27 страницAnálisis de Sistemas IMiguel DueRiveОценок пока нет
- Libro 1Документ1 страницаLibro 1Miguel DueRiveОценок пока нет
- Introducción A Sistemas OperativosДокумент21 страницаIntroducción A Sistemas OperativosMiguel DueRiveОценок пока нет
- Papel Del Analista de SistemasДокумент14 страницPapel Del Analista de SistemasMiguel DueRiveОценок пока нет
- Tablas Base DatosДокумент1 страницаTablas Base DatosMiguel DueRiveОценок пока нет
- FES0 - 1.2-Resultante de Dos o Mas Fuerzas-2Документ16 страницFES0 - 1.2-Resultante de Dos o Mas Fuerzas-2Miguel DueRiveОценок пока нет
- MaravillasДокумент1 страницаMaravillasMiguel DueRiveОценок пока нет
- FES0 - 1.1-Conceptos FundamentalesДокумент23 страницыFES0 - 1.1-Conceptos FundamentalesMiguel DueRiveОценок пока нет
- Como Configurar Modem Zte para TPL o Turbonett Con Ip PublicaДокумент10 страницComo Configurar Modem Zte para TPL o Turbonett Con Ip PublicaMiguel DueRiveОценок пока нет
- Guia Ejercicios Unidad Iii-Reglas de InferenciaДокумент3 страницыGuia Ejercicios Unidad Iii-Reglas de InferenciaMiguel DueRiveОценок пока нет
- Conceptos de AlfinДокумент8 страницConceptos de AlfinMiguel DueRiveОценок пока нет
- DR100219 Miguel Edgardo Dueñas Rivera EticaДокумент3 страницыDR100219 Miguel Edgardo Dueñas Rivera EticaMiguel DueRiveОценок пока нет
- TeatromusДокумент1 страницаTeatromusMiguel DueRiveОценок пока нет
- Internet de Las CosasДокумент13 страницInternet de Las CosasMiguel DueRiveОценок пока нет
- Javier Ruiz 2 CementoДокумент8 страницJavier Ruiz 2 CementoAlejandroFukisMoscosoMeloОценок пока нет
- Planificacion Efectiva de PresentacionДокумент33 страницыPlanificacion Efectiva de PresentacionMiguel DueRiveОценок пока нет
- Sublimación de YodoДокумент1 страницаSublimación de YodoMiguel DueRive0% (1)
- Referencias Bficas ApaДокумент40 страницReferencias Bficas ApaJustino Isidoro AcevedoОценок пока нет
- Desarrollo de ProgramasДокумент18 страницDesarrollo de ProgramasMiguel DueRiveОценок пока нет
- MAravillas Del MundoДокумент2 страницыMAravillas Del MundoMiguel DueRiveОценок пока нет
- Metodología de Los Mapas Conceptuales PDFДокумент6 страницMetodología de Los Mapas Conceptuales PDFMiguel DueRiveОценок пока нет
- Referencias Bficas ApaДокумент40 страницReferencias Bficas ApaJustino Isidoro AcevedoОценок пока нет
- Guia1 Progra2Документ3 страницыGuia1 Progra2Miguel DueRiveОценок пока нет
- Metodología de Los Mapas Conceptuales PDFДокумент6 страницMetodología de Los Mapas Conceptuales PDFMiguel DueRiveОценок пока нет
- Ampliacion de Escalas de VoltimetrosДокумент6 страницAmpliacion de Escalas de VoltimetrosFredy Barrantes100% (1)
- Calculos de Diseño Camara-De-cargaДокумент5 страницCalculos de Diseño Camara-De-cargaAldo Villacorta Diaz0% (2)
- Ley de FaradayДокумент2 страницыLey de FaradayMariana Isabel Sarabia NavaОценок пока нет
- Geologia EstructuralДокумент52 страницыGeologia EstructuralB Panique AlcidesОценок пока нет
- Física Común 21 Cuaderno Ejercicios AcumulativoДокумент61 страницаFísica Común 21 Cuaderno Ejercicios AcumulativoSoledadRojasCeronОценок пока нет
- Puente PeatonalДокумент127 страницPuente Peatonalbeto03212150% (2)
- Lab 5 Ensayo MarshallДокумент31 страницаLab 5 Ensayo MarshallJuanjo SierraОценок пока нет
- Páginas Desdesin Contraseña - Pdf.en - EsДокумент51 страницаPáginas Desdesin Contraseña - Pdf.en - EsOscar Chalco AguilarОценок пока нет
- Circulo de Morh para Deformaciones PDFДокумент8 страницCirculo de Morh para Deformaciones PDFmaguiveshОценок пока нет
- Dale 2500Документ73 страницыDale 2500Dogo RhОценок пока нет
- Practica Titulacion de HCL y NaohДокумент17 страницPractica Titulacion de HCL y NaohOscar MedinaОценок пока нет
- Informe Sobre El HierroДокумент14 страницInforme Sobre El HierroJose Miguel VegaОценок пока нет
- Algebra Matricial Aplicado Al Analisis EstructuralДокумент26 страницAlgebra Matricial Aplicado Al Analisis EstructuralTotti Apaza100% (1)
- MAT 2.2. Cuádricas en El Proyectivo (Castellón, UMA)Документ45 страницMAT 2.2. Cuádricas en El Proyectivo (Castellón, UMA)elduqueeconomicoОценок пока нет
- Columnas de ContactoДокумент35 страницColumnas de ContactoMaria Paula HerreroОценок пока нет
- Indice Horario EjemploДокумент0 страницIndice Horario EjemploEdgar ColmenarezОценок пока нет
- Trailer Remolque Agricola Diseño PDFДокумент146 страницTrailer Remolque Agricola Diseño PDFDavid Enrique Arenas Queeman67% (3)
- Ejercicios de Biofísica - Unidad 3Документ3 страницыEjercicios de Biofísica - Unidad 3Mauricio Exequiel Cazado TorassoОценок пока нет
- ManteoДокумент50 страницManteoDany Arzate86% (7)
- Monografia Analisis DiferencialДокумент17 страницMonografia Analisis DiferencialJosé Alejandro Ocampo SuárezОценок пока нет
- Trabajo Colaborativo - Grupo 101 - Fase 4Документ12 страницTrabajo Colaborativo - Grupo 101 - Fase 4Anonymous pj9UhTv4QОценок пока нет
- Manual de Practica-Determinacion Optica de Sustancias AzucaradasДокумент8 страницManual de Practica-Determinacion Optica de Sustancias AzucaradasZeila Georgina Falcon RamirezОценок пока нет
- Transferencia de Masa MecanismosДокумент16 страницTransferencia de Masa MecanismosDiana Suarez ContadorОценок пока нет
- CAPITULO-30 LazoДокумент6 страницCAPITULO-30 Lazomichelle benavidesОценок пока нет
- Concepto de DerivadaДокумент98 страницConcepto de DerivadaJhonhy Terra VilaОценок пока нет
- Electronica Analogica - Parte IДокумент196 страницElectronica Analogica - Parte IDonaldJosueAquinoCajchaya100% (2)
- NTC1570 Cinturones de Seguridad - UnlockedДокумент64 страницыNTC1570 Cinturones de Seguridad - UnlockedLORENA ALVARADO100% (1)
- Calculoaguas PluvialesДокумент6 страницCalculoaguas PluvialesArturo Helsing Torrentera BedollaОценок пока нет
- Curvas Tipo RameyДокумент9 страницCurvas Tipo RameyViancaОценок пока нет
- Curso B31.3 (Grises)Документ164 страницыCurso B31.3 (Grises)Angel GuachaminОценок пока нет