Академический Документы
Профессиональный Документы
Культура Документы
Ácido Clorhídrico
Загружено:
Renato MezaОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Ácido Clorhídrico
Загружено:
Renato MezaАвторское право:
Доступные форматы
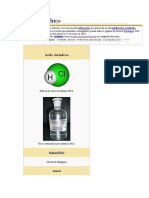
Ácido clorhídrico
Ácido clorhídrico. Líquido incoloro que humea al aire y posee un olor punzante.
Puede presentar una tonalidad amarillenta por contener trazas de cloro, hierro o
materia orgánica. Es un ácido de alta estabilidad térmica y posee una amplia variedad
de aplicaciones. Es obtenido por combinación y absorción en agua de cloro
e hidrógeno gaseosos. Es una sustancia de gran utilidad en nuestros días por los
químicos en los laboratorios y las industrias. Después del ácido sulfúrico, es el ácido
de mayor importancia a escala industrial. Su estudio proporciona el conocimiento
adquirido por el hombre desde la que la química se encontraba en manos de la
alquimia en la edad media hasta nuestros días.
Ácido clorhídrico
Información general
Nombre,símbolo,número: Ácido clorhídrico, HCl
Densidad: 1,189 (solución 38%) kg/l
Apariencia: líquido incoloro o levemente amarillo
Propiedades físicas
Estado ordinario: Acuoso
Punto de fusión: -26 °C (38%)
Punto de ebullición: 48 °C (38%)
Presión de vapor: 28.000 PA (38%)
SINÓNIMOS: Ácido Clorhídrico (solución acuosa), Acido Hidroclórico (solución acuosa),
Acido Muriático (solución acuosa), Cloruro de Hidrógeno (gas, Anhidro), Hidrocloruro,
Espíritu de la Sal, Hydrogen Chloride, Hydrochloric Acid (Ingles), Chloorwaterstof
(Holanda), Chlorwasserstoff (Alemania)
DESCRIPCIÓN: Este compuesto se puede encontrar como gas licuado, donde se conoce
como Cloruro de Hidrógeno, o como soluciones acuosas de diferentes concentraciones,
que corresponden al ácido propiamente dicho. A temperatura ambiente, el Cloruro de
Hidrógeno es un gas incoloro o ligeramente amarillo con olor fuerte. En contacto con el
aire, el gas forma vapores densos de color blanco debido a la condensación con la
humedad atmosférica. El vapor es corrosivo y, a concentraciones superiores a 5 ppm,
puede causar irritación. La forma acuosa, comúnmente conocida como Ácido Muriático
o Clorhídrico es un líquido sin olor a bajas concentraciones y humeante y de olor fuerte
para concentraciones altas.
APLICACIONES Y USOS: La mayoría del Cloruro de Hidrógeno producido se consume en
la industria química pero tiene aplicaciones difundidas en limpieza, desinfección y
tratamiento de aguas. La producción de Cloruro de Vinilo y otros hidrocarburos clorados
consume grandes cantidades de Cloruro de Hidrógeno Anhidro. También se consume
para la producción de cauchos y polímeros clorados. En la extracción de petróleo, en
forma acuosa, se usa para acidificar los pozos petroleros con el fin de aumentar el flujo
del crudo a través de estructuras de roca calcárea. Se encuentra como aditivo o
componente principal de muchos productos de limpieza, desinfección y para evitar la
formación de depósitos carbonatados en baños y piscinas. En la industria de los metales
se usa en la refinación de minerales metálicos, en limpieza, desincrustación ácida y en
electroplateado. Se usa en la refinación de grasas, jabones y aceites comestibles, en la
curtición del cuero, producción de fertilizantes, colorantes y pigmentos y en el ajuste del
pH del agua.
EFECTOS SOBRE LA SALUD: Ácido Clorhídrico, Concentración Mayor a 25% (6, 10) R34:
Provoca quemaduras R37: Irrita las vías respiratorias Ácido Clorhídrico, Concentración
Entre 10% y 25% (6, 10) R36/38: Irrita los ojos y la piel HCl Ácido clorhídrico 56 Los
efectos principales del Ácido Clorhídrico sobre la salud corresponden casi
exclusivamente a la irritación del área de contacto. La exposición no implica en general
efectos sobre órganos diferentes de aquellos en la superficie de contacto o portal de
entrada. Esta sustancia es altamente soluble en agua. A niveles bajos, sus efectos agudos
se resumen a la percepción por el olfato e irritación del tracto respiratorio superior. A
mayores concentraciones puede causar irritación conjuntiva, daño en la superficie de la
córnea e inflamación transitoria de la epidermis. En exposiciones cortas, induce
obstrucción transitoria del tracto respiratorio, que disminuye con la exposición repetida,
lo que sugiere adaptación a la circunstancia de exposición. Trabajadores adaptados a la
presencia de Ácido Clorhídrico en el ambiente en forma de gases o vapores pueden
trabajar sin perturbación alguna con niveles de hasta de 10 ppm, pero la exposición
crónica puede afectar los dientes, resultando en erosión de las superficies dentales en
los dientes frontales.
REACCIONES
REACCIÓN ÁCIDO CLORHÍDRICO EN LA PIEL
El ácido clorhídrico tiene un pH cercano a 1. Esto es el nivel más bajo en la escala de pH.
Es un ácido fuerte, es corrosivo y puede atacar la piel si no está diluído. Un ácido
clorhídrico sin diluir puede quemar la piel continuar quemando las células internas si no
se frena.
Es necesario utilizar protección adecuada cuando se trabaja con este producto. Unos
guantes de vinilo, es una protección suficiente para trabajar con el ácido. Además
conviene no aspirar los gases y utilizar una mascarilla protectora.
REACCION ACIDO CLORHIDRICO CON EL ALUMINIO
El ácido clorhídrico, HCl, va a reaccionar con el Aluminio, dando una reacción de
oxidación-reducción donde se va a producir gas hidrógeno H2.
6 HCl + 2Al -> 2AlCl3 + 3H2
Es una reacción altamente exotérmica, desprende mucho calor. El gas hidrógeno es
altamente inflamable, lo que quiere decir que con una pequeña chispa puede
encenderse. Por tanto, que se produzca hidrógeno de forma incontrolada puede dar
lugar a una explosión. Por eso es muy importante que cuando estés utilizando el ácido
clorhídrico o el Salfumán, estos no entren en contacto en ningún momento con Aluminio.
REACCIÓN ÁCIDO CLORHÍDRICO CON OTROS PRODUCTOS DE LIMPIEZA
El ácido clorhídrico también conviene mantenerlo alejado de otros productos de
limpieza, por las reacciones que puede generar. El ácido clorhídrico tiene un pH cercano
a 1, lo que quiere decir que es un ácido fuerte, que va a reaccionar violentamente con
otros productos que tengan pH básico (superior a 7). Dentro de los elementos de
limpieza encontramos elementos muy básicos como la sosa cáustica. La reacción entre
el ácido clorhídrico y la sosa cáustica es una reacción fuertemente exotérmica que
puede resultar muy peligrosa.
El hidróxido de sodio (NaOH), también conocido como soda cáustica o lejía, es una
sustancia altamente versátil que se utiliza en una variedad de procesos de fabricación.
El hidróxido de sodio es un coproducto de la producción de cloro.
COMPOSICIÓN / INFORMACIÓN DE LOS INGREDIENTES Hidróxido de Sodio Sólido
(9) Componente Contenido Peligroso Hidróxido de Sodio 99 – 100% Sí Hidróxido de Sodio en Solución
Acuosa (8) Componente Contenido Peligroso Hidróxido de Sodio 10 – 60% Sí Agua 40 – 90% No
PRODUCCIÓN: De forma general, el hidróxido de sodio se produce por electrólisis de
soluciones acuosas de cloruro de sodio o por la reacción de carbonato de sodio con
hidróxido de calcio. La forma más común de producción de hidróxido de sodio es como
solución al 50% por electrólisis de cloruro de sodio. En esta reacción se genera hidróxido
de sodio, cloro e hidrógeno de acuerdo con la siguiente ecuación: 2NaCl + 2H2O <=>
2NaOH + Cl2 + H2 PROPIEDAD VALOR Gravedad Específica (Agua = 1) 2,13; puro 1.219;
20% solución acuosa 1.430; 40% solución acuosa 1.525; 50% solución acuosa Densidad
del Vapor (Aire = 1) No Aplica PH 14; Solución 5% Límites de Inflamabilidad (%) No Aplica
Punto de Auto Inflamación No Aplica Solubilidad en Agua (g/ml) 1,11 Tabla 53.
Propiedades físicas para el Hidróxido de Sodio (continuación) 267 Hidróxido de sodio
NaOH Por lo común ingresa al proceso una solución de cloruro de sodio del 27%, esta
sufre el proceso de electrólisis; la solución resultante se hace pasar por celdas de
diafragma, de membrana o de mercurio, según la tecnología instalada. En la celda de
diafragma resulta una solución de entre 9% y 12% de NaOH y 18% de NaCl; la solución
pasa a concentración por evaporación, donde también se purifica por procedimientos
de cristalización fraccionada. La celda de mercurio genera directamente la solución de
50% de concentración; el mercurio se retira por centrifugación y posterior cristalización
o por paso a través de un sistema de filtración (cartuchos o platos). Finalmente en la
celda de membrana, en la que se evita la mezcla de electrolitos por la presencia de la
membrana, se obtiene una solución de 28% a 35% de NaOH que se concentra luego
hasta 50% por acción de evaporadores de película descendente. La solución final que se
genera por este procedimiento es muy pura (1) . En el proceso de caustización del
carbonato de sodio, se mezcla una solución caliente de carbonato de sodio al 12% con
una solución de óxido de calcio. En este proceso precipita carbonato de calcio quedando
en solución el hidróxido de sodio de acuerdo a la reacción siguiente: El carbonato de
sodio se retira y la solución de hidróxido de sodio al 12% remanente se introduce en una
serie de operaciones de evaporación y concentración (1) . Otro tipo de proceso de
producción de hidróxido de sodio consiste en la combinación del proceso de electrólisis
con celdas de diálisis. Se usa en el tratamiento de aguas residuales que contienen sales
de sodio para minimizar las concentraciones de estas sustancias en los vertimientos. La
materia prima consiste en sales inorgánicas de sodio que por acción del conjunto de
operaciones se transforman en hidróxido de sodio y en el ácido correspondiente al anión
de la sal sódica como se muestra en la reacción del siguiente ejemplo: El equipo de
operación en este procedimiento consiste de series de celdas electrolíticas separadas
entre sí por membranas de intercambio iónico catiónicas, aniónicas y bipolares. Se
obtiene una solución de entre 15% y 30% que contiene aún restos de las sales iniciales
(1) . Para producir hidróxido de sodio sólido se parte de la solución de la misma
concentración comercial (50%) realizando inicialmente una evaporación al vacío para
preconcentrar la solución hasta un 60%. La solución anterior se concentra hasta
alrededor de un 99% usando un evaporador de película descendente y como medio
calefactor una sal fundida de NaNO2 - NaNO3 - KNO3que maneja temperaturas mayores
de 400 ºC . en seguida el producto se introduce en un evaporador flash con ayuda de
una tubería con calefacción. El NaOH fundido se enfría y se pasa a formado luego de su
solidificación y de otros pasos preventivos.
EFECTOS SOBRE LA SALUD : Frases de Riesgo
Hidróxido de Sodio R35:
Provoca quemaduras graves
Solución de Hidróxido de Sodio Concentración mayor o igual al 5% R35: Provoca
quemaduras graves
Solución de Hidróxido de Sodio Concentración mayor o igual al 2% y menor al 5%
R34: Provoca quemaduras
Solución de Hidróxido de Sodio Concentración mayor o igual al 0.5% y menor al
2% R36/38: Irrita los ojos y la piel
El hidróxido de sodio es una sustancia muy corrosiva y causa quemaduras severas en
todos los tejidos con los que entra en contacto. Tanto las soluciones concentradas de
este material como su estado sólido producen dolor inmediato por contacto con
cualquier parte del cuerpo. Su acción irritante obedece a que reacciona con las proteínas
de los tejidos vivos con los que entran en contacto y produce su rompimiento por
efectos de hidrólisis. Las soluciones débiles de Hidróxido de Sodio no generan dolor por
contacto con los tejidos sino hasta después de varias horas de exposición sin haber
retirado la solución del tejido en cuestión, pero aún las soluciones débiles son capaces
de producir quemaduras si no se retiran de la parte afectada. Una exposición simple y
pequeña de la que una persona se recupera satisfactoriamente no posee efectos
retardados o a largo plazo sobre la persona. Luego de una exposición seria a grandes
cantidades de esta sustancia sobre la piel se pueden producir daños tales que sea
necesario efectuar procedimientos de transplante de piel. En algunos casos, si el daño
sobre la piel es muy severo, se puede producir la muerte de la persona afectada. La
exposición aguda a nieblas a nieblas de Hidróxido de Sodio puede generar daños
permanentes en los pulmones. A nivel ocular puede producir ceguera permanente. Por
ingestión de soluciones concentradas se generan daños a nivel de boca, garganta y
esófago, donde puede ocasionar daños permanentes y dificultades para tragar; si la
cantidad y concentración son lo suficientemente altas, puede provocar la muerte. 269
Hidróxido de sodio NaOH Al manejar esta sustancia se debe tener presente que al
realizar diluciones en agua desde cualquier estado de concentración del hidróxido se
produce generación de calor. Si la solución de partida es muy concentrada o se parte de
Hidróxido de Sodio Anhidro el calor generado puede dar pie para iniciar la reacción de
otras sustancias explosivas cercanas. No se debe nunca agregar agua a hidróxido de
sodio sólido pues reacciona violentamente provocando salpicaduras cáusticas y una alta
evolución de calor.
Вам также может понравиться
- Análisis Químico Del Agua e Interpretación de Resultados PDFДокумент21 страницаAnálisis Químico Del Agua e Interpretación de Resultados PDFVan SanchezОценок пока нет
- INFORME TECNICO (2) - PaulДокумент49 страницINFORME TECNICO (2) - PaulROGER86% (7)
- Ácido ClohídricoДокумент9 страницÁcido ClohídricoDiegoОценок пока нет
- OBTENCIÓNДокумент21 страницаOBTENCIÓNPame Pairazamán100% (1)
- Ácido ClorhídricoДокумент13 страницÁcido ClorhídricoDar TorresОценок пока нет
- Ácido ClorhídricoДокумент9 страницÁcido ClorhídricoEdgar A. GeroldОценок пока нет
- Acido Clorhidrico 2012Документ32 страницыAcido Clorhidrico 2012lizmendieta100% (1)
- Hipoclorito de SodioДокумент15 страницHipoclorito de SodioAntony ChávezОценок пока нет
- Proceso de Fabricación Del ÁcidoДокумент5 страницProceso de Fabricación Del ÁcidoPaul Sanchez GОценок пока нет
- Informe de Acido Clorhidrico-2-2017Документ9 страницInforme de Acido Clorhidrico-2-2017rogeralexhuacotoОценок пока нет
- Ácido ClorhídricoДокумент6 страницÁcido ClorhídricoLuis José MavarezОценок пока нет
- Acido ClorhidricoДокумент36 страницAcido ClorhidricoVioleta Peña ColqueОценок пока нет
- Preguntas de HCL y NaOHДокумент9 страницPreguntas de HCL y NaOHSantiago NuñezОценок пока нет
- Ácido ClorhídricoДокумент5 страницÁcido ClorhídricoCesar Yerba ApazaОценок пока нет
- Ácido Clorhídrico (Trabajo de Exposicion) Ppt-1Документ36 страницÁcido Clorhídrico (Trabajo de Exposicion) Ppt-1Luis Enrique Gómez Clavijo0% (1)
- Fabricacion de HCLДокумент13 страницFabricacion de HCLJorge SalyRosas100% (1)
- Ácido ClorhídricoДокумент11 страницÁcido ClorhídricoJorge Alberto Estrada TorresОценок пока нет
- Ácido ClorhídricoДокумент10 страницÁcido ClorhídricoGerald CrespinОценок пока нет
- Acido ClorhidricoДокумент21 страницаAcido ClorhidricoCarlos Ccq100% (1)
- Acido ClorhidricoДокумент15 страницAcido ClorhidricoAugusto Zelada RodriguezОценок пока нет
- Cloruro de HidrógenoДокумент25 страницCloruro de Hidrógenomariagil5550% (2)
- Hipoclorido de SodioДокумент2 страницыHipoclorido de SodioJavier TabaraОценок пока нет
- Absorcion de HCL 1Документ11 страницAbsorcion de HCL 1gisca100% (1)
- Acido ClorhídricoДокумент15 страницAcido Clorhídricoroel007Оценок пока нет
- CloroxДокумент8 страницCloroxayerimmsrОценок пока нет
- Sintesis Final ImprimirДокумент61 страницаSintesis Final ImprimirivanОценок пока нет
- Introducción Acido ChorhidricoДокумент14 страницIntroducción Acido ChorhidricoJesus BedoyaОценок пока нет
- Acido MuriaticoДокумент9 страницAcido MuriaticoJONATHAN BONIFAZОценок пока нет
- Acido MuriáticoДокумент14 страницAcido MuriáticoAlex AlvaradoОценок пока нет
- Hipoclorito de SodioДокумент8 страницHipoclorito de SodioJean Carlos NoriegaОценок пока нет
- Soluciones BufferДокумент23 страницыSoluciones BufferStefany XiomAra B SОценок пока нет
- Ácido ClorhídricoДокумент11 страницÁcido ClorhídricoVmc JuristasОценок пока нет
- Produccion de HCLДокумент24 страницыProduccion de HCLtitoОценок пока нет
- Informe 08Документ10 страницInforme 08Esteban Wong MuñozОценок пока нет
- Definición de Ácido ClorhídricoДокумент4 страницыDefinición de Ácido ClorhídricoJose Angel Hernandez GrajalesОценок пока нет
- Diamante de SeguridadДокумент5 страницDiamante de SeguridadPaulaAndreaОценок пока нет
- Cloro SodaДокумент75 страницCloro SodaZoraida C Araujo BОценок пока нет
- Acido ClorhidricoДокумент16 страницAcido ClorhidricoLaura Flores Basto0% (1)
- Acido Clorhidrico en FormatoДокумент6 страницAcido Clorhidrico en FormatoMario Ramiro Humerez DiazОценок пока нет
- Informe de Laboratorio AQДокумент27 страницInforme de Laboratorio AQStefany XiomAra B SОценок пока нет
- Acido Clorhídrico Técnico HCLДокумент5 страницAcido Clorhídrico Técnico HCLJuve Crespo PadillaОценок пока нет
- HCLДокумент11 страницHCLYanella Smith Arevalo GonzalesОценок пока нет
- Informe de La Practica 6Документ6 страницInforme de La Practica 6Jose MiguelОценок пока нет
- Hipoclorito de SodioДокумент13 страницHipoclorito de SodioLuis Diego Cardenas Padilla100% (2)
- CLORO E HIDROXIDO de Sodio Expo IndustriaДокумент38 страницCLORO E HIDROXIDO de Sodio Expo IndustriaLoayza Totty RodriguezОценок пока нет
- Informe 6. Reacciones Químicas IIIДокумент10 страницInforme 6. Reacciones Químicas III이안네Оценок пока нет
- Producción de Ácido SalicílicoДокумент25 страницProducción de Ácido SalicílicojenniferОценок пока нет
- CorregidoДокумент10 страницCorregidoNicole QuintoОценок пока нет
- Hipoclorito de SodioДокумент7 страницHipoclorito de SodioAnonymous nIKQnZ7Оценок пока нет
- Ficha Tecnica Soda CausticaДокумент4 страницыFicha Tecnica Soda CausticaIsabel López TresgalloОценок пока нет
- Hipoclorito de Calsio 3Документ5 страницHipoclorito de Calsio 3Miguel AngelОценок пока нет
- Acido ClorhidricoДокумент7 страницAcido ClorhidricoJaen SaurОценок пока нет
- Sosa CáusticaДокумент3 страницыSosa CáusticaVanessa ZavalaОценок пока нет
- Hipoclorito de SodioДокумент8 страницHipoclorito de SodioCatalina AguirreОценок пока нет
- Marco TeòricoДокумент6 страницMarco TeòricoFrytz Fernandez FelixОценок пока нет
- El Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásОт EverandEl Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásОценок пока нет
- Caso LubricaciónДокумент11 страницCaso LubricaciónRenato Meza100% (1)
- Cuestionario QuesoДокумент3 страницыCuestionario QuesoRenato Meza0% (1)
- Resultados Embutidos, EmpanizadosДокумент11 страницResultados Embutidos, EmpanizadosRenato Meza100% (1)
- PROYECTO CushuroДокумент13 страницPROYECTO CushuroRenato MezaОценок пока нет
- Informe JessДокумент112 страницInforme JessRenato MezaОценок пока нет
- TEMA 7 Hidroxidos - RevisadosДокумент2 страницыTEMA 7 Hidroxidos - RevisadosMarcelo Vedia0% (1)
- Conceptos Básicos 1Документ20 страницConceptos Básicos 1Juan Angel Mendieta ArenasОценок пока нет
- Monitoreo de GasesДокумент31 страницаMonitoreo de GasesJohn Candia100% (1)
- Analisis de Hierro (Concentrados)Документ6 страницAnalisis de Hierro (Concentrados)Marydela Valderrama0% (2)
- Aleaciones No FerrosasДокумент4 страницыAleaciones No FerrosasAdonis AlvaradoОценок пока нет
- Reporte 5 - Propiedades de Algunos Elementos y Sus Óxidos - LQGIДокумент7 страницReporte 5 - Propiedades de Algunos Elementos y Sus Óxidos - LQGIFRIDA ALEJANDRA BRITO DOMINGUEZОценок пока нет
- Taller de QuimicaДокумент3 страницыTaller de QuimicaJuneys OsorioОценок пока нет
- Acero Inoxidable DecorativoДокумент29 страницAcero Inoxidable DecorativoSebastianCastilloОценок пока нет
- Metales y AleacionesДокумент12 страницMetales y AleacionesFatima Nunez FrancoОценок пока нет
- Articulo PoleasДокумент7 страницArticulo PoleasJhon OtaloraОценок пока нет
- Practica N° 10 Volumetria de Oxidacion-Reduccion IIДокумент16 страницPractica N° 10 Volumetria de Oxidacion-Reduccion IIKatia Yesica Tineo Canales100% (2)
- PREGUNTAS Cap 9 y 10Документ2 страницыPREGUNTAS Cap 9 y 10Diego IgnacioОценок пока нет
- Hakaphos PDFДокумент2 страницыHakaphos PDFRafael BonavidesОценок пока нет
- Aleaciones-Antifriccion 3ra VersionДокумент21 страницаAleaciones-Antifriccion 3ra VersionCristopherОценок пока нет
- Diagrama de Fases de Las Aleaciones Del AluminioДокумент17 страницDiagrama de Fases de Las Aleaciones Del AluminioByron Castro78% (9)
- Ejercicios Resueltos Unidad 5A - Formulas Parte1 2020Документ9 страницEjercicios Resueltos Unidad 5A - Formulas Parte1 2020LuisОценок пока нет
- Resultado de Aprendizaje Tabla PeriodicaДокумент4 страницыResultado de Aprendizaje Tabla PeriodicaGiancarlo PradoОценок пока нет
- GUIA No 2 GASES V 18-10-2018Документ6 страницGUIA No 2 GASES V 18-10-2018cxgarcianОценок пока нет
- ACUARIOДокумент2 страницыACUARIOEduardo BorreОценок пока нет
- Resumen Clases Teoricas (Sulfatos) PДокумент3 страницыResumen Clases Teoricas (Sulfatos) PAmorОценок пока нет
- Taller QuimicaДокумент4 страницыTaller QuimicaJuan David CasanovaОценок пока нет
- Clase 13 04 07-17I Aleaciones No FerrosasДокумент14 страницClase 13 04 07-17I Aleaciones No FerrosasElenaОценок пока нет
- Tabela de Referênciade Cartuchos e FiltrosДокумент1 страницаTabela de Referênciade Cartuchos e FiltrosAnonymous LhMYiJEq8SОценок пока нет
- Tarea 3Документ12 страницTarea 3Luis David Lozano OrtizОценок пока нет
- Plomo - Wikipedia, La Enciclopedia LibreДокумент79 страницPlomo - Wikipedia, La Enciclopedia LibreEdgardo MoraezОценок пока нет
- Minerales Informe SirveДокумент51 страницаMinerales Informe SirveMaria Fernanda YaupiОценок пока нет
- Marcha AnalíticaДокумент15 страницMarcha AnalíticaDaniel100% (1)
- Guia Quimica 10 N4 El Átomo 2021Документ17 страницGuia Quimica 10 N4 El Átomo 2021Cristian Javier Castellanos BrievaОценок пока нет