Академический Документы
Профессиональный Документы
Культура Документы
Calorimetria y Cambios de Fase
Загружено:
Moises Moheno BarruetaОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Calorimetria y Cambios de Fase
Загружено:
Moises Moheno BarruetaАвторское право:
Доступные форматы
Calorimetría y cambios de fase
Calorimetría significa “medición de calor”. Hemos hablado de la transferencia de
energía (calor) durante los cambios de temperatura. El calor también interviene en
los cambios de fase, como la fusión del hielo o la ebullición del agua. Una vez que
entendamos estas relaciones de calor, podremos analizar diversos problemas de cantidad de calor
Cambios de fase
Usamos el término fase para describir un estado específico de la materia, como sólido,
líquido o gas. El compuesto H2O existe en la fase sólida como hielo, en la fase lí-
quida como agua y en la fase gaseosa como vapor de agua. (También llamamos a estas
fases estados de la materia: el estado sólido, el estado líquido y el estado gaseoso).
Una transición de una fase a otra es un cambio de fase. Para una presión dada, los
cambios de fase se dan a una temperatura definida, generalmente acompañados por
absorción o emisión de calor, y un cambio de volumen y densidad.
Un ejemplo conocido de cambio de fase es la fusión del hielo. Si agregamos calor
al hielo a 0°C y a presión atmosférica normal, la temperatura del hielo no aumenta.
En vez de ello, parte de él se funde para formar agua líquida. Si agregamos calor
lentamente, manteniendo el sistema muy cerca del equilibrio térmico, la temperatura
seguirá en 0°C hasta que todo el hielo se haya fundido (figura 17.19). El efecto de
agregar calor a este sistema no es elevar su temperatura sino cambiar su fase de sólida
a líquida.
Para convertir 1 kg de hielo a 0°C en 1 kg de agua líquida a 0°C y a presión atmosférica normal,
necesitamos 3.34 * 105 J de calor. El calor requerido por unidad de masa se llama calor de fusión
(o calor latente de fusión), denotado con Lf. Para el agua a presión atmosférica normal, el calor de
fusión es
Lf = 3.34 * 105 J /kg = 79.6 cal /g = 143 Btu /lb
En términos más generales, para fundir una masa m de material con calor de fusión Lf
se requiere una cantidad de calor Q dada por
Q = mLf
Este proceso es reversible. Para congelar agua líquida a 0°C tenemos que quitar calor; la magnitud
es la misma, pero ahora Q es negativa porque se extrae calor en vez
de agregarse. Para cubrir ambas posibilidades e incluir otros tipos de cambios de fase,
escribimos
Q = mL (transferencia de calor en un cambio de fase) (17.20)
Usamos el signo más (entra calor) cuando el material se funde, y el signo menos (sale
calor) cuando se congela. El calor de fusión es diferente para distintos materiales, y
también varía un poco con la presión.
Para un material dado, a una presión determinada, la temperatura de congelación
es la misma que la de fusión. En esta temperatura única, las fases líquida y sólida
(agua líquida y hielo, por ejemplo) pueden coexistir en una condición llamada equilibrio de fases.
Algo similar sucede con la ebullición o evaporación, una transición de fase entre
líquido y gas. El calor correspondiente (por unidad de masa) se llama calor de vaporización Lv. A
presión atmosférica normal, el calor de vaporización Lv del agua es
Lv = 2.256 * 106 J /kg = 539 cal /g = 970 Btu /lb
Es decir, necesitamos 2.256 * 106 J para convertir 1 kg de agua líquida a 100°C en
1 kg de vapor de agua a 100°C. En contraste, para elevar la temperatura de 1 kg de
agua de 0 a 100°C se requieren Q = mc ¢T = (1.00 kg)(4190 J kg? C°) * (100 C°) =
4.19 * 105 J, menos de la quinta parte del calor necesario para la vaporización a
100°C. Esto concuerda con nuestra experiencia en la cocina: el agua en una olla puede alcanzar la
temperatura de ebullición en unos minutos, pero tarda mucho más en
evaporarse por completo.
Al igual que la fusión, la ebullición es una transición reversible. Si quitamos calor
a un gas a la temperatura de ebullición, el gas vuelve a la fase líquida (se condensa),
cediendo a sus alrededores la misma cantidad de calor (calor de vaporización) que se
necesitó para vaporizarlo. A una presión determinada, las temperaturas de ebullición
y condensación siempre son las mismas; a esta temperatura, las fases líquida y gaseosa pueden
coexistir en equilibrio de fases.
Tanto Lv como la temperatura de ebullición de un material dependen de la presión.
El agua hierve a menor temperatura (cerca de 95°C) en Denver que en Pittsburgh,
porque Denver está a mayor altura y la presión atmosférica promedio es menor. El
calor de vaporización es un poco más alto a esta presión reducida: aproximadamente
2.27 * 106 J kg.
La tabla 17.4 presenta calores de fusión y vaporización para varios materiales, así
como sus temperaturas de fusión y ebullición, a presión atmosférica normal. Muy
pocos elementos tienen temperaturas de fusión cercanas a la temperatura ambiente;
uno de ellos es el metal galio (figura 17.20).
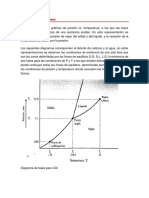
La figura 17.21 muestra cómo varía la temperatura cuando agregamos calor continuamente a una
muestra de hielo con una temperatura inicial menor que 0°C (punto a).
La temperatura aumenta hasta llegar al punto de fusión (punto b). Al agregar más
calor, la temperatura se mantiene constante hasta que se derrite todo el hielo (punto c).
Luego, la temperatura aumenta otra vez hasta llegar al punto de ebullición (punto d),
donde se mantiene constante otra vez hasta que toda el agua ha pasado a la fase de
vapor (punto e). Si la tasa de aporte de calor es constante, la pendiente de la línea para
la fase sólida (hielo) está más inclinada que para la fase líquida (agua). ¿Sabe por qué?
(Véase la tabla 17.3).
A veces, una sustancia puede cambiar directamente de la fase sólida a la gaseosa.
Este proceso se llama sublimación y se dice que el sólido se sublima. El calor correspondiente es el
calor de sublimación Ls. El dióxido de carbono líquido no puede existir
a una presión menor que 5 * 105 Pa (unas 5 atm), y el “hielo seco” (dióxido de carbono sólido) se
sublima a presión atmosférica. La sublimación de agua de alimentos
congelados causa las quemaduras de congelador. El proceso inverso, un cambio de
fase de gas a sólido, se presenta cuando se forma escarcha en cuerpos fríos como las
espiras de enfriamiento de un refrigerador.
El agua muy pura llega a enfriarse varios grados por debajo del punto de congelación sin congelarse;
el estado inestable que resulta se describe como sobreenfriado.
Si se introduce un pequeño cristal de hielo o se agita el agua, se cristalizará en un segundo o menos.
El vapor de agua sobreenfriado se condensa rápidamente para formar
neblina, si se introduce una alteración como partículas de polvo o radiación ionizante.
Se usa este principio para “bombardear” las nubes que a menudo contienen vapor de
agua sobreenfriado, y así causar condensación y lluvia.
A veces es posible sobrecalentar un líquido por encima de su temperatura de ebullición normal.
Cualquier alteración pequeña, como agitación, causa ebullición local
con formación de burbujas.
Los sistemas de calefacción por vapor de agua usan un proceso de ebullición-condensación para
transferir calor del horno a los radiadores. Cada kilogramo de agua convertido en vapor en la caldera
absorbe más de 2 * 106 J (el calor de vaporización
L
v del agua) de la caldera y lo cede al condensarse en los radiadores. También se usan
procesos de ebullición-condensación en los refrigeradores, acondicionadores de aire
y bombas de calor. Veremos estos sistemas en el capítulo 20.
Los mecanismos de control de temperatura de muchos animales de sangre caliente
aprovechan el calor de vaporización: eliminan calor del cuerpo usándolo para evaporar
agua de la lengua (lo que produce jadeo), o de la piel (lo cual se manifiesta como
sudor). El enfriamiento por evaporación permite al ser humano mantener su temperatura corporal
normal en climas calurosos y desérticos, donde la temperatura del aire
puede alcanzar los 55°C (aproximadamente 130°F). La temperatura de la piel puede
ser hasta 30°C menor que la del aire circundante. En tales condiciones, una persona
llega a sudar varios litros al día, y debe reponer esta agua. Los caminantes del desierto
experimentados (como uno de los autores) aseguran que, en el desierto, ¡una cantimplora
de menos de un galón es solo un juguete! El enfriamiento por evaporación también
explica por qué sentimos frío al salir de una alberca (figura 17.22).
También se usa el enfriamiento por evaporación para enfriar edificios en climas
calientes y secos, o para condensar y reciclar vapor de agua “usado” en plantas generadoras
nucleares o que queman carbón. Eso es lo que sucede en las grandes torres de
enfriamiento hechas de concreto que vemos en estas plantas.
Las reacciones químicas, como la combustión, son análogas a los cambios de fase en
cuanto a que implican cantidades definidas de calor. La combustión total de 1 gramo
de gasolina produce unos 46,000 J (casi 11,000 cal), así que el calor de combustión
Lc de la gasolina es
Lc = 46,000 J /g = 4.6 * 107 J /kg
Los valores energéticos de los alimentos se definen de forma similar. Al decir que un gramo de
mantequilla de maní “contiene 6 calorías”, queremos decir que se liberan 6 kcal
de calor (6000 cal o 25,000 J) cuando los átomos de carbono e hidrógeno de la mantequilla
reaccionan con oxígeno (con la ayuda de enzimas) y se convierten por completo
en CO2 y H2O. No toda esta energía se puede convertir directamente en trabajo
mecánico. Estudiaremos la eficiencia de la utilización de la energía en el capítulo 20.
Cálculos de calor
Veamos algunos ejemplos de cálculos calorimétricos (cálculos con calor). El principio
básico es sencillo: si fluye calor entre dos cuerpos aislados de sus alrededores, el calor
perdido por un cuerpo debe ser igual al ganado por el otro. El calor es transferencia
de energía, así que este principio es realmente la conservación de la energía. La calorimetría, que
solo se ocupa de una cantidad que se conserva, es en varios sentidos
¡la más sencilla de todas las teorías físicas!
Calor, cambios de fase y calorimetría: El calor es transferencia de energía de
un cuerpo a otro a causa de una diferencia de temperatura. Las ecuaciones
(17.13) y (17.18) dan la cantidad de calor Q necesaria para provocar un
cambio de temperatura ¢T en una cantidad de material con masa m y calor
específico c (de manera alternativa, en términos del número de moles n
y la capacidad calorífica molar C = Mc. Aquí, M es la masa molar y
m = nM). Cuando se agrega calor a un cuerpo, Q es positiva; cuando
se extrae, Q es negativa. (Véase los ejemplos 17.5 y 17.6).
Para que una masa m de material cambie de fase a la misma temperatura (como de líquido a vapor)
hay que agregarle o quitarle una cantidad
de calor dada por la ecuación (17.20). Aquí L es el calor de fusión,
vaporización o sublimación.
En un sistema aislado, cuyas partes interactúan intercambiando calor,
la suma algebraica de las Q para todas las partes del sistema debe ser
cero. (Véase los ejemplos 17.7 a 17.10).
Вам также может понравиться
- Guia para Escribir Un Protocolo de Investigación OpsДокумент9 страницGuia para Escribir Un Protocolo de Investigación OpsFede Moncada100% (1)
- Toma de Muestra de SangreДокумент12 страницToma de Muestra de SangreJOSE DUBERLEE TAVARA VEGAОценок пока нет
- GUÍA Cambios de Fase y Calor LatenteДокумент28 страницGUÍA Cambios de Fase y Calor LatenteCristian Marcelo Marca CadenaОценок пока нет
- Tema 1 Conceptos Fisicos y Termodinamicos RecoverДокумент28 страницTema 1 Conceptos Fisicos y Termodinamicos RecoverGonzalo MartínezОценок пока нет
- Física 5Документ20 страницFísica 5Emmanuel Ruiz0% (1)
- Calor Latente, Punto Triple, Transición VitreaДокумент19 страницCalor Latente, Punto Triple, Transición VitreaJocelynОценок пока нет
- Conceptos Fundamentales RefrigeracionДокумент5 страницConceptos Fundamentales RefrigeracionChavely RiTolОценок пока нет
- 11.4 - Cambios - de - Fase (1) 6 (1) ..Документ9 страниц11.4 - Cambios - de - Fase (1) 6 (1) ..LEONEL EDUARDO SALAZAR DAGAОценок пока нет
- Calor Latente de FusionДокумент12 страницCalor Latente de FusionYAnethОценок пока нет
- Calor LatenteДокумент5 страницCalor LatenteWilliam AdonОценок пока нет
- CalorДокумент5 страницCalorAlam Romero PalestinoОценок пока нет
- Informe 9 Calor LatenteДокумент10 страницInforme 9 Calor LatenteJosé Eduardo Pezo CastroОценок пока нет
- Práctica Calor LatenteДокумент5 страницPráctica Calor LatenteMarcio BautistaОценок пока нет
- Refrigeracion Unidad IДокумент16 страницRefrigeracion Unidad INatanael Garcia AldapiОценок пока нет
- Calor LatenteДокумент4 страницыCalor LatenteFran FrancoОценок пока нет
- Trabajo de Capitulo 17.6Документ8 страницTrabajo de Capitulo 17.6Frank Jhoel ICОценок пока нет
- Desarrollo Del Cotenido de Transferencia, 23-2 para ExponerДокумент25 страницDesarrollo Del Cotenido de Transferencia, 23-2 para Exponerninoska margarita paz palaciosОценок пока нет
- Calor Sensible y LatenteДокумент21 страницаCalor Sensible y LatenteMatt QMОценок пока нет
- Calor LatenteДокумент4 страницыCalor LatenteJossuet MaldonadoОценок пока нет
- 5 - Nociones Sobre Vapor, Producción, Composición y Clases de VaporДокумент12 страниц5 - Nociones Sobre Vapor, Producción, Composición y Clases de VaporpatricioОценок пока нет
- Unidad 6.1. CalorimetríaДокумент9 страницUnidad 6.1. CalorimetríaMatias MosquedaОценок пока нет
- VARIABLES DE PROCESOS. Tema # 5. Escalas de TemperaturaДокумент9 страницVARIABLES DE PROCESOS. Tema # 5. Escalas de Temperaturaoscar ivan bolaños navarreteОценок пока нет
- Calorimetria IiДокумент2 страницыCalorimetria IiJose Fernando Lozano PanibraОценок пока нет
- El Calor y Las Transformaciones Del Estado Físico de La MateriaДокумент10 страницEl Calor y Las Transformaciones Del Estado Físico de La MateriaAna Gonzalez67% (3)
- Tema 1 Conceptos Fisicos y TermodinamicosДокумент35 страницTema 1 Conceptos Fisicos y TermodinamicosBASURA CCALLEОценок пока нет
- Tema 2Документ10 страницTema 2Jose AntonioОценок пока нет
- Exposicion Balance - Sistemas No ReactivosДокумент53 страницыExposicion Balance - Sistemas No Reactivosluis carlosОценок пока нет
- Conceptos Termodinamicos de RefrigeracionДокумент6 страницConceptos Termodinamicos de RefrigeracionHector M. Morales Tirado100% (1)
- Cambios de Fase y Calor LatenteДокумент12 страницCambios de Fase y Calor LatenteCuenta2 RaulОценок пока нет
- Calor Específico y LatenteДокумент6 страницCalor Específico y LatenteAndrea DíazОценок пока нет
- Introducción A Los Conocimientos Básicos de RefrigeraciónДокумент16 страницIntroducción A Los Conocimientos Básicos de RefrigeraciónFredy FynnahОценок пока нет
- Lab 8Документ12 страницLab 8Jocfran12Оценок пока нет
- 02 Cambio de FaseДокумент14 страниц02 Cambio de FaseMichell Hernández RiveraОценок пока нет
- Termo Cap 3Документ14 страницTermo Cap 3Fraraccio IngenieriaОценок пока нет
- Calor LatenteДокумент6 страницCalor LatenteKARENОценок пока нет
- Introducción A La RefrigeraciónДокумент23 страницыIntroducción A La RefrigeraciónJavier LamedaОценок пока нет
- Calor LatenteДокумент9 страницCalor LatenteEvelyn Calderón MartínezОценок пока нет
- Chichi Doria Klor Latente y VaporizacionДокумент4 страницыChichi Doria Klor Latente y VaporizacionSaudith MoscoteОценок пока нет
- Danfoss Conocimientos Basicos RefrigeracionДокумент16 страницDanfoss Conocimientos Basicos RefrigeracionfrioycalorОценок пока нет
- Calor LatenteДокумент17 страницCalor LatenteDaniela TrujilloОценок пока нет
- Quimica2 160928181315Документ11 страницQuimica2 160928181315GodnarОценок пока нет
- Yacimiento IIIДокумент11 страницYacimiento IIIsolangeОценок пока нет
- Temperatura y CalorДокумент4 страницыTemperatura y CalorAntonela Tataje RamosОценок пока нет
- Calor LatenteДокумент4 страницыCalor LatenteCESAR CARLOS SANDOVAL SIBAJAОценок пока нет
- Equlibrio TermicoДокумент13 страницEqulibrio Termicollens saavedraОценок пока нет
- Fisica 11 Periodo 1 Trabajo de Los Temas 2020 SolucionadoДокумент19 страницFisica 11 Periodo 1 Trabajo de Los Temas 2020 SolucionadoKing WalkerОценок пока нет
- Análisis de Los Componentes de Una Refinería Así Como Su Funcionamiento y La Influencia de Estos en El Proceso Del PetróleoДокумент17 страницAnálisis de Los Componentes de Una Refinería Así Como Su Funcionamiento y La Influencia de Estos en El Proceso Del PetróleoJesús BautistaОценок пока нет
- Comportamiento PVT CalidadДокумент18 страницComportamiento PVT CalidadAnderson ArrietaОценок пока нет
- TP 3 - Cambios de Estado - Calor LatenteДокумент11 страницTP 3 - Cambios de Estado - Calor LatentegabrielbajachОценок пока нет
- Carpeta TermodinamicaДокумент31 страницаCarpeta TermodinamicaRoberto FiorilloОценок пока нет
- Conceptos Aire AcondicionadoДокумент4 страницыConceptos Aire AcondicionadoEdu Miguel100% (1)
- 08 Calor LatenteДокумент12 страниц08 Calor Latenteelvis100% (1)
- Conceptos de CalorimetríaДокумент13 страницConceptos de CalorimetríaRodríguez Cázarez Luisa FernandaОценок пока нет
- Cambios Estado Fusion Solificacion Vaporización CondensacionДокумент6 страницCambios Estado Fusion Solificacion Vaporización Condensacionaucadenas100% (1)
- 1 Introducción PDFДокумент11 страниц1 Introducción PDFALEXANDER DONATO HUAMANI TUEROSОценок пока нет
- ENTALPIAДокумент5 страницENTALPIAMaría Rosmeri Sánchez AymaОценок пока нет
- Conceptos Básicos RefrigeraciónДокумент5 страницConceptos Básicos RefrigeraciónXavier Jaimes100% (5)
- Aprender sobre la energía geotérmica (Finding Out about Geothermal Energy)От EverandAprender sobre la energía geotérmica (Finding Out about Geothermal Energy)Оценок пока нет
- Examen de GradoДокумент1 страницаExamen de GradoMoises Moheno BarruetaОценок пока нет
- Trad 1Документ3 страницыTrad 1Moises Moheno BarruetaОценок пока нет
- Sistema de Ecuaciones 4Документ2 страницыSistema de Ecuaciones 4Moises Moheno BarruetaОценок пока нет
- PrincipalДокумент14 страницPrincipalMoises Moheno BarruetaОценок пока нет
- Reglas Operacion Bien EstarДокумент29 страницReglas Operacion Bien EstarVICTOR ALFONSOОценок пока нет
- Tesis Ferrer ImpactoДокумент384 страницыTesis Ferrer ImpactoMoises Moheno BarruetaОценок пока нет
- Sistema de Ecuaciones 5Документ3 страницыSistema de Ecuaciones 5Moises Moheno BarruetaОценок пока нет
- Sistema de Ecuaciones 3Документ2 страницыSistema de Ecuaciones 3Moises Moheno BarruetaОценок пока нет
- Avances DoctoradoДокумент8 страницAvances DoctoradoMoises Moheno BarruetaОценок пока нет
- Requisitos ContratosДокумент1 страницаRequisitos ContratosMoises Moheno BarruetaОценок пока нет
- Sistema de Ecuaciones 2Документ2 страницыSistema de Ecuaciones 2Moises Moheno BarruetaОценок пока нет
- DoctoradoДокумент1 страницаDoctoradoMoises Moheno BarruetaОценок пока нет
- Sistema de Ecuaciones 1Документ4 страницыSistema de Ecuaciones 1Moises Moheno BarruetaОценок пока нет
- Cómo Luchar Contra La ImpurezaДокумент1 страницаCómo Luchar Contra La ImpurezaMoises Moheno BarruetaОценок пока нет
- Informe de Productos AcademicosДокумент4 страницыInforme de Productos AcademicosMoises Moheno BarruetaОценок пока нет
- Universidades y Sus MaestríasДокумент2 страницыUniversidades y Sus MaestríasMoises Moheno BarruetaОценок пока нет
- Taboa Periodica Espanol Completa IUPAC 2016Документ1 страницаTaboa Periodica Espanol Completa IUPAC 2016Moises Moheno BarruetaОценок пока нет
- Sistema de Compra. ULPGCДокумент27 страницSistema de Compra. ULPGCRafael Nieto0% (1)
- Ensayo SocialДокумент3 страницыEnsayo SocialMoises Moheno BarruetaОценок пока нет
- Pastel Del ÉxitoДокумент1 страницаPastel Del ÉxitoMoises Moheno BarruetaОценок пока нет
- Sistema de Compra. ULPGCДокумент27 страницSistema de Compra. ULPGCRafael Nieto0% (1)
- CAVITACIONДокумент3 страницыCAVITACIONMoises Moheno BarruetaОценок пока нет
- Flujo MultifásicoДокумент6 страницFlujo MultifásicoMoises Moheno BarruetaОценок пока нет
- Transferencia de Calor FinalДокумент55 страницTransferencia de Calor FinalMoises Moheno BarruetaОценок пока нет
- Aprendizaje AutónomoДокумент6 страницAprendizaje AutónomoMoises Moheno BarruetaОценок пока нет
- Cond Ter Termistor MMBДокумент2 страницыCond Ter Termistor MMBMoises Moheno BarruetaОценок пока нет
- Control DigitalДокумент1 страницаControl DigitalMoises Moheno BarruetaОценок пока нет
- Historial Tarifa HMДокумент17 страницHistorial Tarifa HMMoises Moheno BarruetaОценок пока нет
- Molienda y TamizadoДокумент44 страницыMolienda y TamizadoCarlos Arpasi Bejarano100% (1)
- Modelando Una Silla 3DДокумент5 страницModelando Una Silla 3DJose Jhonatan Gutierrez YangaliОценок пока нет
- Manual de Instrucciones GA30VSD PDFДокумент132 страницыManual de Instrucciones GA30VSD PDFAnonymous WZXqWy2100% (1)
- Altura PiezometricaДокумент12 страницAltura PiezometricaFernandez Poma Milwar Alexander100% (1)
- Guia IsomeriaДокумент1 страницаGuia IsomeriaGabriela AlvarezОценок пока нет
- Circuitos LogicosДокумент27 страницCircuitos LogicosOMAR YESID MARTINEZ PENAОценок пока нет
- Sampa AlfabetoДокумент14 страницSampa AlfabetoNicolas PassarelliОценок пока нет
- Arbol de Fallas RCN - PRUEBAДокумент17 страницArbol de Fallas RCN - PRUEBAMayckОценок пока нет
- Cromatografia en PapelДокумент8 страницCromatografia en PapelVanessa HernandezОценок пока нет
- Test de RedesДокумент6 страницTest de RedesJorge ParraОценок пока нет
- Anexo 1,2,3Документ4 страницыAnexo 1,2,3Miguel CapchaОценок пока нет
- Ecuaciones Diferenciales Orden SuperiorДокумент17 страницEcuaciones Diferenciales Orden SuperiorTatianaОценок пока нет
- 1°física - Clase 5 - (1T)Документ3 страницы1°física - Clase 5 - (1T)anacarolinaОценок пока нет
- Diseño, Desarrollo y Construcción de Pirámide Regular y TruncadaДокумент2 страницыDiseño, Desarrollo y Construcción de Pirámide Regular y TruncadaLuis David Preciado MartinezОценок пока нет
- Conclusiones 1Документ2 страницыConclusiones 1SheylaSotoFalconОценок пока нет
- Estudio Hidrologico de La CuencaДокумент26 страницEstudio Hidrologico de La CuencaDalian Canaviri CardenasОценок пока нет
- Unidad 2 Programacion y Base de DatosДокумент9 страницUnidad 2 Programacion y Base de DatosDiego CamachoОценок пока нет
- Examen Aplazados 4Документ2 страницыExamen Aplazados 4Milton Elfer Poma TacuriОценок пока нет
- Las Ecuaciones Diferenciales y Sus Aplicaciones en La IngenieriaДокумент61 страницаLas Ecuaciones Diferenciales y Sus Aplicaciones en La IngenieriaDaniel TapiaОценок пока нет
- Ensayo VicatДокумент9 страницEnsayo VicatJosiola MariledoОценок пока нет
- Sistema de Registro Académico y AdmisionesДокумент2 страницыSistema de Registro Académico y AdmisionesJulian QuimbayaОценок пока нет
- CALORДокумент39 страницCALORGrace MartinezОценок пока нет
- Tarea 1. Diagrama de FlujoДокумент5 страницTarea 1. Diagrama de FlujoMariana VazquezОценок пока нет
- EVAL. Leccion 5 Que Son Las Cargas ElectricasДокумент4 страницыEVAL. Leccion 5 Que Son Las Cargas ElectricasPilarОценок пока нет
- Separata Inv Operativa1Документ73 страницыSeparata Inv Operativa1Amanqui Aquise Lehi ParnyОценок пока нет
- Calculo de Carga TermicaДокумент19 страницCalculo de Carga TermicaAlejandro Ramos100% (1)
- Mapas Mentales - Funciones y DerivadasДокумент5 страницMapas Mentales - Funciones y DerivadasAldair100% (2)
- Ficha 4 - 1eroy2do - Exp 8Документ3 страницыFicha 4 - 1eroy2do - Exp 8robyn humpire molinaОценок пока нет
- Andrea Mora-Elementos Básicos Del Diseño - TallerДокумент11 страницAndrea Mora-Elementos Básicos Del Diseño - TallerAndrea MoraОценок пока нет