Академический Документы
Профессиональный Документы
Культура Документы
Cuestionario Previo
Загружено:
Laura MarquezИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Cuestionario Previo
Загружено:
Laura MarquezАвторское право:
Доступные форматы
Márquez Zetina Laura Verónica
Lab. Química
Grupo: 1125
CUESTIONARIO PREVIO
CONSTRUCCIÓN DE UNA PILA
1. ¿Cuál es la contribución de Luigi Galvani y Alessandro Volta en la electroquímica?
Luigi Galvani: sus investigaciones son referidas a los efectos de la electricidad en nervios y músculos de
animales descubre los efectos o acción fisiológica de la electricidad en los seres vivos. Aplicó una pequeña
corriente eléctrica a la médula espinal de una rana, causando la contracción muscular de sus patas y su
consecuente salto, similar a la acción que cuando estaba vivo este animal. Este descubrimiento accidental
se debió a que el bisturí utilizado en la disección de la rana toca un gancho de bronce, produciendo una
pequeña descarga que hizo contraer la pata del animal.
Alessandro Volta: inventa la pila eléctrica que lleva su nombre precursora de la batería eléctrica, que
consistía en un aparato construido por un empilado de láminas de cinc, papel y cobre. Poseía dos discos
metálicos separados por un conductor húmedo, pero unidos con un circuito exterior, produciendo corriente
eléctrica continua en donde las cargas eléctricas circulan en la misma dirección. Inventa también el
electróforo que es un dispositivo que transfiere electricidad a otros objetos, generando electricidad estática
por acumulación de cargas eléctricas en una zona con poca conductividad eléctrica. Luego de un par de
años, se dedica a la química al descubrir y aislar el gas metano.
2. ¿Qué es una pila y cuáles son los elementos básicos que la constituyen?
La Pila es un dispositivo capaz de generar corriente eléctrica, su funcionamiento consiste en transformar
la energía química de sus componentes en energía eléctrica.
Dispone de dos electrodos que suelen ser de diferentes metales, que proporcionan una superficie sobre
la que ocurren las reacciones de oxidación y reducción. Estos electrodos se colocan en dos
compartimentos separados, a su vez inmersos en un medio que contiene iones en concentraciones
conocidas, separados por una placa porosa o membrana, que puede estar compuesta por acristalamiento
arcilla, porcelana u otros materiales.
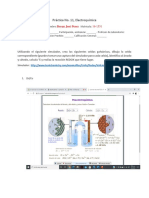
3. ¿Cómo funciona una pila?
Una pila común se compone de dos placas
metálicas y una sustancia ácida. Una de las
placas será la donante de electrones, (polo
-) usualmente es el Zinc. Otra será la
receptora (polo +) puede ser Cobre, en las
pilas se usa una barra de carbón.
La sustancia ácida desprende electrones
de la placa negativa y los deposita en la
positiva, mientras más ácida más voltaje
tendrá. Al conectar las dos placas por
medio de un cable conductor, los
electrones viajan de regreso en forma de
electricidad hacia la placa negativa y se
reinicia el proceso.
4. Defina los conceptos siguientes:
a) Oxidación: la oxidación ocurre cuando un átomo inestable pierde un electrón, lo que permite que el átomo
forme un compuesto nuevo con otro elemento
b) Reducción: Se denomina reacción de reducción-oxidación, de óxido-reducción o, simplemente, reacción
redox, a toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando
un cambio en sus estados de oxidación.
Márquez Zetina Laura Verónica
Lab. Química
Grupo: 1125
Para que exista una reacción de reducción-oxidación, en el sistema debe haber un elemento que ceda
electrones, y otro que los acepte:
El agente reductor es aquel elemento químico que suministra electrones de su estructura química al
medio, aumentando su estado de oxidación, es decir, siendo oxidado.
El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un
estado de oxidación inferior al que tenía, es decir, siendo reducido.
c) Agente oxidante: Un agente oxidante o comburente es un compuesto químico que oxida a otra sustancia
en reacciones electroquímicas o de reducción-oxidación. En estas reacciones, el compuesto oxidante se
reduce.
Básicamente:
El oxidante se reduce, gana electrones.
El reductor se oxida, pierde electrones.
Todos los componentes de la reacción tienen un número de oxidación.
En estas reacciones se da un intercambio de electrones.
d) Agente reductor: Agente reductor especie química encargada de reducir a otra sustancia, ya que dona
electrones y hace que otra sustancia se reduzca, al hacer esta donación de electrones esta sustancia se oxida
así que podemos decir que el agente reductor es la sustancia que se oxida.
e) Fuerza electromotriz o diferencia de potencial: Se denomina fuerza electromotriz (FEM) a la
energía proveniente de cualquier fuente, medio o dispositivo que suministre corriente eléctrica. Para
ello se necesita la existencia de una diferencia de potencial entre dos puntos o polos (uno negativo y
el otro positivo) de dicha fuente, que sea capaz de bombear o impulsar las cargas eléctricas a través
de un circuito cerrado.
f) Potencial estándar de reducción: Los potenciales estándares de reducción de las tablas, son valores
medidos a 25 0C, 1 atmósfera de presión y en disolución acuosa 1M. El electrodo de referencia es el del
hidrógeno, al que se le ha asignado un valor de cero.
Eºcelda = Eº oxidación + Eº reducción
Para calcular la FEM de la celda anterior el valor de tablas es:
Zn0 │ Zn2+ ║ Cu2+ │ Cu0
Zn2+ + 2e- → Zn0 E0 = -0.76 V semirreacción de oxidación
6. ¿Qué es una pila recargable?
Las baterías recargables usan reacciones electroquímicas que son eléctricamente reversibles, es decir:
Cuando la reacción transcurre en un sentido, se agotan los materiales de la pila mientras se genera
una corriente eléctrica.
Para que la reacción transcurra en sentido inverso, es necesaria una corriente eléctrica para
regenerar los materiales consumidos
Вам также может понравиться
- Derecho Familiar PDFДокумент509 страницDerecho Familiar PDFRafael Gonzalez78% (36)
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseОт EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseРейтинг: 4.5 из 5 звезд4.5/5 (7)
- Grafología y CienciaДокумент181 страницаGrafología y CienciaLuis Ventura88% (8)
- Practica 4 Quimica ESIMEДокумент13 страницPractica 4 Quimica ESIMEIsrael GutzОценок пока нет
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaОт EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaОценок пока нет
- Informe 11 - ElectroquimicaДокумент12 страницInforme 11 - ElectroquimicaCëlëstë Řňż ČmčhОценок пока нет
- Tabla Completa de DerivadasДокумент1 страницаTabla Completa de DerivadasPedro Tovar100% (1)
- Practica Nro9Документ9 страницPractica Nro9JhovanaChqОценок пока нет
- Informe de Laboratorio "Electroquimica, Electrodeposicion y Lixiviacion"Документ17 страницInforme de Laboratorio "Electroquimica, Electrodeposicion y Lixiviacion"Luis Duarte LopezОценок пока нет
- Producción de Nitrato PotásicoДокумент9 страницProducción de Nitrato PotásicoWilliamEdgarHuichiОценок пока нет
- Tarea 6.2 Glosario Unidad ViДокумент4 страницыTarea 6.2 Glosario Unidad ViFlor Orquidea Batista Suárez75% (8)
- Celdas ElectroliticasДокумент20 страницCeldas ElectroliticasJeyson GrandaОценок пока нет
- Informe Reaciones QuímicasДокумент5 страницInforme Reaciones QuímicasCindy Leslie Pereyra NogueraОценок пока нет
- Conservacion de La MateriaДокумент8 страницConservacion de La MateriaLaura MarquezОценок пока нет
- Derecho de La Propiedad Industrial e Intelectual PDFДокумент170 страницDerecho de La Propiedad Industrial e Intelectual PDFGabby Norono100% (1)
- Los Mecanismos Alternativos de Solución de Controversias Como Derecho HumanoДокумент16 страницLos Mecanismos Alternativos de Solución de Controversias Como Derecho HumanoAzazelОценок пока нет
- Devaru by A.N. Murthy RaoДокумент191 страницаDevaru by A.N. Murthy Raosunil hulagannavar50% (6)
- Cuestionario Previo Quimica Facultad Ingenieria UnamДокумент2 страницыCuestionario Previo Quimica Facultad Ingenieria UnamLaura Marquez71% (7)
- Ultimo Previo QuimicaДокумент4 страницыUltimo Previo Quimicaandre8gutierrez100% (1)
- REPORTE Práctica No 11 Electroquimica (Bryan Perez)Документ5 страницREPORTE Práctica No 11 Electroquimica (Bryan Perez)VICTOR LEANDRO SEGURA SEGURAОценок пока нет
- Electroquimica - 20211Документ72 страницыElectroquimica - 20211July ManobandaОценок пока нет
- Practica # 9 ElectroquimicaДокумент9 страницPractica # 9 ElectroquimicaHelen Andrea Ramos ZuazoОценок пока нет
- Electroquimica DomingoДокумент14 страницElectroquimica DomingoSisley Rosario Baez MauricioОценок пока нет
- ElectroquimicaДокумент13 страницElectroquimicaTatuu RamírezОценок пока нет
- Imf ElectroquimicaДокумент13 страницImf ElectroquimicaRosaise PomahilariОценок пока нет
- ELECTROQUÍMICAДокумент45 страницELECTROQUÍMICAMalibran Vega Daphne DalidaiОценок пока нет
- Escuela Superior Politécnica de ChimborazoДокумент3 страницыEscuela Superior Politécnica de ChimborazoMariagabriela Espinoza MonteroОценок пока нет
- REDOXДокумент47 страницREDOXBladi MamaniОценок пока нет
- Practica Nro9Документ9 страницPractica Nro9Lupe NeridaОценок пока нет
- 6.2 Glosario Unidad Vi. Desarrollo de La QuimicaДокумент5 страниц6.2 Glosario Unidad Vi. Desarrollo de La Quimicaerika buenoОценок пока нет
- 1.1-Laboratorio 3-ElectroquímicaДокумент10 страниц1.1-Laboratorio 3-ElectroquímicaDiego FierroОценок пока нет
- Celda de CobreДокумент23 страницыCelda de CobreJosé OportoОценок пока нет
- Electrolisis (Pila de Daniell) y Recubrimiento Con MetalesДокумент14 страницElectrolisis (Pila de Daniell) y Recubrimiento Con MetalesjessicaОценок пока нет
- Electroquimica, Electrolisis y Leyes de FaradayДокумент14 страницElectroquimica, Electrolisis y Leyes de FaradayJuan Marcelo Tenorio Barboza100% (1)
- ElectroquimicaДокумент25 страницElectroquimicaAvril VillalbaОценок пока нет
- Celdas GalvánicasДокумент11 страницCeldas GalvánicasFIORELLA STEPHANIE MEDINA PEÑAОценок пока нет
- PV12 ElectroquímicaДокумент15 страницPV12 ElectroquímicaDenisse Roman AriasОценок пока нет
- Celdas Electroquímicas PIAДокумент16 страницCeldas Electroquímicas PIAJose GzzОценок пока нет
- Saber U4Документ6 страницSaber U4CRISTHIAN OBED MARTINEZ QUIROZОценок пока нет
- Laboratorio 1 Primera Ley de Faraday-1Документ13 страницLaboratorio 1 Primera Ley de Faraday-1alexander beltranОценок пока нет
- Practica Nro9Документ9 страницPractica Nro9Ronaldgonzales100% (2)
- ELECTROLISISДокумент10 страницELECTROLISISDaniela Jesús Yapu PrietoОценок пока нет
- ConclusionДокумент9 страницConclusionKenyaa CarolinaaОценок пока нет
- Libro 4 U5 ElectroquímicaДокумент18 страницLibro 4 U5 ElectroquímicaSergio Luis RodriguezОценок пока нет
- Informe Electrodeposicion de Cobre 2018-3Документ2 страницыInforme Electrodeposicion de Cobre 2018-3Camilo Andres ZabaletaОценок пока нет
- Practica Nº2Документ4 страницыPractica Nº2Anibar Yamil Solamayo VediaОценок пока нет
- Nuevo Documento de Microsoft WordДокумент10 страницNuevo Documento de Microsoft WordConnie PetersОценок пока нет
- ElectroquimicaДокумент11 страницElectroquimicaEnmerson FVОценок пока нет
- Proyecto FinalДокумент8 страницProyecto FinalTania IbargüengoitiaОценок пока нет
- Informe 9Документ11 страницInforme 9Cristian Machaca TiconaОценок пока нет
- Coagulacion TeoriaДокумент21 страницаCoagulacion TeoriaKote SaavedraОценок пока нет
- ELECTROQUÍMICAДокумент45 страницELECTROQUÍMICAMalibran Vega Daphne DalidaiОценок пока нет
- Piadequimica 1971032Документ17 страницPiadequimica 1971032Erik DanielОценок пока нет
- CeldasElectroquimicas 1971032Документ17 страницCeldasElectroquimicas 1971032Erik DanielОценок пока нет
- Practica 5 QuimicaДокумент13 страницPractica 5 QuimicaVale ChavezОценок пока нет
- Práctica-4 EsimeДокумент17 страницPráctica-4 Esime1galletasОценок пока нет
- ELECTROLISISДокумент6 страницELECTROLISISAlex Joao YadaicelaОценок пока нет
- ELECTROLISISДокумент6 страницELECTROLISISAlex Joao Yadaicela0% (1)
- Introduccion A La IngДокумент4 страницыIntroduccion A La IngCarla FialloОценок пока нет
- ELECTROQUIMICA - Electrolisis y Leyes de FaradayДокумент12 страницELECTROQUIMICA - Electrolisis y Leyes de FaradayGio Tonny Yanahuaya50% (2)
- Principios de ElectroquimicaДокумент7 страницPrincipios de ElectroquimicaMaikol FlorezОценок пока нет
- REPORTE Práctica No 11 Electroquimica (Bryan Perez)Документ5 страницREPORTE Práctica No 11 Electroquimica (Bryan Perez)VICTOR LEANDRO SEGURA SEGURAОценок пока нет
- Reparto de ExposicionДокумент21 страницаReparto de ExposicionanibalОценок пока нет
- ELECTROQUIMICA FISICO Equipo 3Документ49 страницELECTROQUIMICA FISICO Equipo 3EdiMiguelHernandezHernandezОценок пока нет
- DEFICIONДокумент3 страницыDEFICIONDany GuzmanОценок пока нет
- Unidad v. ElectroquímicaДокумент23 страницыUnidad v. ElectroquímicaAnel Gonzalez ZavalaОценок пока нет
- Segundo Infore ElectroquimicaДокумент33 страницыSegundo Infore Electroquimicajhoan cesar cosme ramosОценок пока нет
- QUIMICA - Elaboración de Una PilaДокумент9 страницQUIMICA - Elaboración de Una PilaGiovanni Aramiz Fajardo GamboaОценок пока нет
- Examen ElectroquímicaДокумент3 страницыExamen ElectroquímicaMichelle Betancourt100% (1)
- Estatica - Centro de GravedadДокумент17 страницEstatica - Centro de GravedadLaura MarquezОценок пока нет
- Active DirectoryFINALДокумент96 страницActive DirectoryFINALLaura MarquezОценок пока нет
- Movimiento Armónico Simple - Pract 4Документ4 страницыMovimiento Armónico Simple - Pract 4Laura MarquezОценок пока нет
- Configuración de Un Firewall en OpenBSDДокумент9 страницConfiguración de Un Firewall en OpenBSDLaura MarquezОценок пока нет
- Cinematica Practica 1Документ8 страницCinematica Practica 1Laura MarquezОценок пока нет
- Archivo de Configuración de ReglasДокумент5 страницArchivo de Configuración de ReglasLaura MarquezОценок пока нет
- La Publicidad - Con IndiceДокумент31 страницаLa Publicidad - Con IndiceLaura MarquezОценок пока нет
- Seguridad en PHP BásicaДокумент4 страницыSeguridad en PHP BásicaLaura MarquezОценок пока нет
- Electric - Practica 1 - Electricidad y MagnetismoДокумент12 страницElectric - Practica 1 - Electricidad y MagnetismoLaura MarquezОценок пока нет
- Configurar Las Tarjetas de RedДокумент1 страницаConfigurar Las Tarjetas de RedLaura MarquezОценок пока нет
- CENAPRECEДокумент8 страницCENAPRECELaura MarquezОценок пока нет
- Cinematica - Practica 2Документ7 страницCinematica - Practica 2Laura MarquezОценок пока нет
- El Sistema Federal en Mexico y Sus AlcancesДокумент19 страницEl Sistema Federal en Mexico y Sus AlcancesLaura MarquezОценок пока нет
- Lo Que Debe SaberДокумент51 страницаLo Que Debe SaberLiz RíosОценок пока нет
- Funciones Del Asesor en LineaДокумент1 страницаFunciones Del Asesor en LineaLaura MarquezОценок пока нет
- Planeacion y OrganizacionДокумент11 страницPlaneacion y OrganizacionLaura MarquezОценок пока нет
- Masc PDFДокумент17 страницMasc PDFJulio ElíasОценок пока нет
- Características de La Asesoría A DistanciaДокумент1 страницаCaracterísticas de La Asesoría A DistanciaLaura MarquezОценок пока нет
- Conferencia Menores Infractores AcapulcoДокумент46 страницConferencia Menores Infractores AcapulcoJulio Cortes CruzОценок пока нет
- Derecho Internacional - GuiaДокумент11 страницDerecho Internacional - GuiaLaura MarquezОценок пока нет
- Proteccion de Datos en Materia de SaludДокумент26 страницProteccion de Datos en Materia de SaludLaura MarquezОценок пока нет
- Ejercicios de Probabilidad y EstadisticaДокумент59 страницEjercicios de Probabilidad y EstadisticaLaura MarquezОценок пока нет
- 153 - Ejercicios de Circuitos Resueltos 3 EsoДокумент15 страниц153 - Ejercicios de Circuitos Resueltos 3 EsoYarissa AlonzoОценок пока нет
- Alcanos, Alquinos y AlquenosДокумент14 страницAlcanos, Alquinos y AlquenosDiego Rivera FakesОценок пока нет
- Informe de Laboratorio Practica 4Документ5 страницInforme de Laboratorio Practica 4SAID SALVATIERRA LANGUIDEYОценок пока нет
- Ejercicios 1Документ5 страницEjercicios 1Edgardo Leal VillarroelОценок пока нет
- INFOGRAFIAДокумент1 страницаINFOGRAFIASusyin MarquezОценок пока нет
- Historia de La Tabla PeriodicaДокумент14 страницHistoria de La Tabla PeriodicaJorge Mora ColínОценок пока нет
- Informe de NitraciónДокумент6 страницInforme de Nitraciónandres guerreroОценок пока нет
- Memoria Descriptiva Proyecto Planta DesaladoraДокумент43 страницыMemoria Descriptiva Proyecto Planta DesaladoraBrenda CansinoОценок пока нет
- TITULACIONДокумент16 страницTITULACIONmiriamОценок пока нет
- Determinacion de Nitritos Por ColimetriaДокумент4 страницыDeterminacion de Nitritos Por ColimetriaMaria SilesОценок пока нет
- NOMENCLATURAДокумент61 страницаNOMENCLATURApepeОценок пока нет
- Ciclo de UreaДокумент64 страницыCiclo de UreaTelma Cortez NolascoОценок пока нет
- Reacciones de Hidrocarburos (ALQUENO)Документ8 страницReacciones de Hidrocarburos (ALQUENO)1sanchez.romero.diegoОценок пока нет
- Nomenclatura de Quimica Inorganic AДокумент22 страницыNomenclatura de Quimica Inorganic APerla ValdezОценок пока нет
- Guia de Quimica Inorganica 2019-IIДокумент46 страницGuia de Quimica Inorganica 2019-IIDavid DavianОценок пока нет
- 03 Historia Hierro PDFДокумент6 страниц03 Historia Hierro PDFLILIANA CALIXTO VITEОценок пока нет
- Poli MerosДокумент16 страницPoli MerosROBERTPОценок пока нет
- Presentacion Quimica IIДокумент12 страницPresentacion Quimica IIHERNANОценок пока нет
- IOBSBNXUДокумент4 страницыIOBSBNXUMiguel Angel Condori RoqueОценок пока нет
- Examen de Química General - 2023 I U. CientíficaДокумент2 страницыExamen de Química General - 2023 I U. CientíficaIngenieríaОценок пока нет
- Determinacion Simultanea de Atropina y EscopolaminaДокумент56 страницDeterminacion Simultanea de Atropina y EscopolaminaMarinaОценок пока нет
- Obtencion de Halogenuros de AlquiloДокумент12 страницObtencion de Halogenuros de AlquiloJOHAN LARA PAQUIОценок пока нет
- Guia Practica Embriologia 10Документ3 страницыGuia Practica Embriologia 10AYLEEN NAYELLY OCHOA CORDEROОценок пока нет
- Mi Tarea de Las Reacciones QuimicasДокумент5 страницMi Tarea de Las Reacciones QuimicasRommyna Yáñez CeballosОценок пока нет
- cS3 Quimica JavierasierraДокумент3 страницыcS3 Quimica JavierasierraJaviera Francisca Sierra EspinozaОценок пока нет
- Practica 6 y 7Документ10 страницPractica 6 y 7yopoboyОценок пока нет
- Guía de Prácticas de Laboratorio Quíorg Ii. Sep2019Документ38 страницGuía de Prácticas de Laboratorio Quíorg Ii. Sep2019Tatiana GuashpaОценок пока нет
- Informe 2. Recristalización y SublimaciónДокумент5 страницInforme 2. Recristalización y SublimaciónMateo MartinezОценок пока нет