Академический Документы
Профессиональный Документы
Культура Документы
Determinacion de Acido Fosforico en Coca Cola Mediante Titulaciones Potenciometricas PDF
Загружено:
Gaby Quispe AyalaИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Determinacion de Acido Fosforico en Coca Cola Mediante Titulaciones Potenciometricas PDF
Загружено:
Gaby Quispe AyalaАвторское право:
Доступные форматы
Determinación de Acido Fosfórico en Coca-Cola mediante
titulaciones Potenciométricas
Analio Dugarte, Sharol Goffin
Laboratorio de Análisis Instrumental. Sección 01.
Departamento de Quimica. Facultad de Ciencias. Universidad de los Andes
Mérida, Julio 2012.
Resumen
En el presente trabajo se empleó una técnica potenciometrica para determinar la concentración de ácido fosfórico
presente en una bebida gaseosa comercial llamada Coca Cola, para la realización de este estudio se empleó la titulación
potenciométrica ácido-base y se evaluó el punto de equivalencia utilizando los métodos analíticos de la curva simple, la
primera derivada, la segunda derivada y el método de Gran. Se estandarizó con KH2PO4 0.02N una solución de NaOH
0.02N, la cual fue utilizada como titulante en la bebida gaseosa. La concentración del ácido fosfórico resulto ser (0,01053 ±
0,00002) N; además se encontró una cantidad de fósforo de (0,0029) g contenido en 15 mL de muestra.
Introducción que no se conoce su contribución a la diferencia
de potencial medida. Los potenciales de
Los métodos potenciométricos están basados en semicelda de la mayoría de los electrodos
la medida de la diferencia de potencial entre dos indicadores responden como ya se ha
electrodos introducidos en una solución. Los comentado a los cambios en la actividad de las
electrodos y la solución constituyen lo que se especies a ser determinadas de acuerdo a la
conoce con el nombre de celda electroquímica. Ecuación de Nerst.
El potencial entre ambos electrodos es Coca-Cola es un refresco efervescente vendido
normalmente medido con la ayuda de un equipo en tiendas, restaurantes y máquinas
conocido como potenciómetro. Uno de los expendedoras en más de 200 países. Es
electrodos involucrado en el proceso se producido por The Coca-Cola Company. Entre
denomina indicador, el cual tiene una respuesta
los ingredientes ‘conocidos’ de la
respecto de una especie particular presente en el
seno de la solución y cuya actividad se mide misteriosa fórmula secreta Coca Cola se
durante el experimento y el otro recibe el encuentra el ácido fosfórico, utilizado como
nombre de referencia, cuya característica más aditivo. El Objetivo principal de la práctica es
importante es que el potencial de semicelda de determinar la concentración de ácido fosfórico
este electrodo permanece siempre constante. El presente en la Coca-Cola.
potencial de una celda electroquímica, viene
dado por: E celda = Eind – Eref + Eμl
Experimental
El potencial de unión líquida se establece entre
la interface de dos electrolitos, considerándose
en general la unión o interface entre el electrodo Reactivos:
de referencia y la solución que le rodea. Esta Reactivos, Materiales y Equipos:
Diferencia de potencial suele ser pequeña, pero Fosfato monobásico de potasio (100ml, 0.02N)
casi siempre de magnitud desconocida. El NaOH (250 ml, 0.02N)
potencial de unión líquida impone una Botellas de 100 mL de Coca-Cola
limitación fundamental a la exactitud de las
mediciones Potenciométricas directas, puesto
Materiales: 11,5 9,84
Material volumétrico, espátula 12 11,06
Propipetas, Agitador magnético, Termómetro 13 11,54
balanza analítica, plancha de calentamiento con 14 11,62
sistema de agitación, pH-metro y electrodo 14,5 11,97
combinado de vidrio 15,5 12,19
16 12,25
Procedimiento: 17 12,3
Se Prepararon las siguientes soluciones: 18 12,59
Solución 1: 100 ml de solución de fosfato
19 12,67
monobásico de potasio 0.02N
Solución 2: 250 ml de solución de NaOH 0.02N 20 12,78
Desgasificar 100ml de Coca-Cola, colocando la 20,5 12,99
muestra de aproximadamente en baño de María 21 13,04
por 20 minutos a 50°C. 21,5 13,09
I. Parte: Se estandarizo la solución de NaOH
22 13,12
0.02N con la solución estándar de KH2PO4
0.02N. (Realizando las medidas por triplicado). 22,5 13,15
II. Parte: determine la concentración de H3PO4 23 13,18
presente en las muestras de Coca-Cola. Titulando 24 13,21
25ml de la muestra con la solución estandarizada
de NaOH (realice las medidas por triplicado).
Datos Experimentales Tabla N° 02. Método de la primera derivada
Volumen de ΔE/ΔV
NaOH (mL)
0,5 0,21
Tabla N° 01. Estandarización de NaOH (0,02N)
1,5 0,63
con fosfato monobásico de potasio (0,02N).
Volumen de pH 2,25 0,5
NaOH (mL)
2,75 0,42
1 6,22 3,25 0,42
2 6,85 3,75 0,76
2,5 7,1 4,25 0,36
3 7,35 4,75 0,28
3,5 7,53 5,25 0,54
4 7,91 5,75 0,18
4,5 8,1 6,25 0,18
5 8,71 6,75 0,04
7 8,87 7,25 0,32
7,5 8,93 7,75 0,12
8 9,05 8,25 0,24
8,5 9,13 8,75 0,16
9 9,24 9,25 0,22
9,5 9,37 9,75 0,26
10 9,45 10,25 0,16
10,5 9,52 10,75 0,14
11 9,71 11,25 0,38
11,75 0,26 11,875 -0,24
12 1,22 12,75 3,84
13,5 0,48 14,125 -0,49
14,75 0,72 15,25 0,192
15,75 0,7 16,125 -0,02
16,5 0,22 17 -0,64
17,5 0,06 17,875 -0,16
18,25 0,1 18,5 0,05
18,75 0,58 18,125 0,96
19,5 0,08 20,5 0,19
20,25 0,22 21 0,4
20,75 0,42 21,5 -0,64
21,25 0,1 22 0
21,75 0,1 22,5 -0,08
22,25 0,06 23,125 0
22,75 0,06 24 -0,01
23,5 0,03
24,5 0,04 Tabla N° 04. Determinación de ácido fosfórico en
la coca cola
Tabla N° 03. Método de la Segunda Derivada Volumen de pH
NaOH (mL)
Volumen Segunda
de NaOH derivada
(mL) ΔE2/ΔV2
0,5 2,2
1 0,42
1,2 2,61
1,875 -0,17
1,5 2,67
2,5 -0,16
2 2,7
3 0
3,5 2,83
4 0,68
4 3,01
4,5 -0,8
4,5 3,25
5 -0,16
5 3,69
5,5 0,52
5,5 4,48
6 -0,86
6 5,49
6,5 0
6,5 5,92
7 -0,28
7 6,18
7,5 0,56
7,5 6,4
8 -0,4
8 6,58
nda8,5 0,24
8,5 6,74
9 -0,16
9 6,86
9,5 0,12
9,5 7,01
10 0,08
10,1 7,17
10,5 -0,2
10,5 7,3
11 -0,04
11 7,47
11,5 0,48
11,5 7,7 12,25 0,94
12 8,01 12,75 0,86
12,5 8,48 13,25 0,52
13 8,91 13,8 0,35
13,5 9,17 14,3 0,35
14,1 9,38 14,8 0,216
14,5 9,52 15,3 0,225
15,1 9,65 15,75 0,18
15,5 9,74 16,25 0,12
16 9,83 16,75 0,14
16,5 9,89 18 0,02
17 9,96 18,75 0,1
17,5 10,1 19,25 0,1
18,5 10,12 19,75 0,1
19 10,17 20,25 0,08
19,5 10,22 20,75 0,04
20 10,26 21,5 0,07
21 10,32 22,5 0,05
22 10,39 24 0,05
23 10,44
Tabla N° 06. Método de la Segunda Derivada
Tabla N° 05. Método de la Primera Derivada. V(mL) ΔE2/ΔV2
V(mL) ΔE/ΔV 1,5 -0,12
1,25 0,24 2 -0,053
1,75 0,14 4 0,3
2,75 0,086 4,5 0,8
3,75 0,36 5 1,4
4,25 0,48 5,5 0,88
4,75 0,88 6 -2,32
5,25 1,58 6,5 -0,68
5,75 2,02 7 -0,16
6,25 0,86 7,5 -0,16
6,75 0,52 8 -0,08
7,25 0,44 8,5 -0,16
7,75 0,36 9,52 -0,073
8,25 0,32 10,525 0,033
8,75 0,24 11 0,125
9,25 0,3 11,5 0,32
9,8 0,26 12 0,64
10,3 0,325 12,5 -0,16
10,75 0,34 13 -0,68
11,25 0,46 13,525 -0,31
11,75 0,62 14,3 -0,134
15,525 -0,1 Resultados Experimentales
16 -0,12 Tabla N° 08. Concentración de NaOH
16,5 0,04
estandarizado con KH2PO4
17,37 -0,096
Punto de V (mL) NaOH Normalidad
19 0 Equivalencia NaOH
19,5 0 Primer Punto 21,2 0,0187
20 -0,04 Segundo Punto 21,6 0,01858
20,5 -0,08
21,125 0,04
Tabla N° 09. Concentración de ácido fosfórico en
la coca- cola
Punto de V(mL) N H3PO4
Tabla N° 07. Método de Gran equivalenci NaOH (eq/L)
V(mL) AV/AE a
Curva 5,74 0,0103
2,75 11,627 sencilla
3,75 2,77 Primera 5,74 0,0106
derivada
4,25 2,08 Segunda 5,62 0,0108
derivada
4,75 1,136
Método de 5,9 0,0108
5,25 0,63 gran
5,75 0,49
6,25 1,16
6,75 1,92
Absorbancia en función de la
7,25 2,27
relación Molar
7,75 2,77
0,6
Absorbancia (Abs)
8,25 3,125
8,75 4,16 0,4
9,8 3,85
0,2
0
10,3 3,07
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1
10,75 2,94
Relacion Molar del Ligando
11,25 2,17
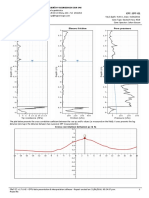
11,75 1,61 Ilustración 1. Curva Sencilla de la Estandarización
12,25 1,06 del NaOH
12,75 1,16
13,25 1,92
13,8 2,86
14,8 4,63
15,75 5,55
16,75 7,14
18,75 10
20,25 12,5
lustración 2. Método de la Primera derivada de la
Estandarización del NaOH
lustración 3. Método de la Segunda derivada de la lustración 5. Método de la Segunda derivada de la
Estandarización del NaOH Determinación de Acido Fosfórico
Método de Gran para la Determinación Acido
Fosfórico
Ilustración 4. Curva Sencilla de la Determinación de Análisis y Discusión de Resultados
Acido Fosfórico
De acuerdo con los resultados obtenidos se puede
observar que en los gráficos de la estandarización
del NaOH como en la valoración de H 3PO4 (ácido
triprotico), se puede notar la ausencia en ambas
experiencias de la ultima disociación, en el caso
de la estandarización es la aparición de un solo
punto de equivalencia y en la determinación del
ácido fosfórico es la de solo dos equivalencias.
Esto es debido a que en los poliácidos y sales de
poliácidos cuando existe una diferencia muy
grande entre sus constantes de disociación (10 4),
es decir se encuentran muy distanciadas (k1= 7.11
x 10-3; K2= 6.32 x 10-8; K3= 4.5 x 10-13, este tiene
lustración 5. Método de la Primera derivada de la la tendencia a comportarse como un ácido
Determinación de Acido Fosfórico monovalente o divalente según sea el caso , y es
de esperarse que los puntos de inflexión en la
grafica de potencial de hidrogeno en función del
volumen de hidróxido de sodio, fuese muy grande
y por la magnitud de dicha constantes no es
común que exista la tercera disociación por esta
razón no se observa el tercer punto de inflexión en
la gráfica para el acido fosfórico.
Para la determinación de la concentración del
ácido fosfórico se tomo en cuenta el primer punto
de inflexión (punto de equivalencia)
correspondiente a la disociación del primer protón
del acido según la siguiente reacción:
H3PO4 + NaOH NaH2PO4 + H2O
Donde el punto final se presento a pH= 4,48
obteniéndose una concentración de (0,01053 ±
0,00002) N en acido fosfórico y 0,0029 gramos de
fosforo.
Conclusiones
Se estandarizó una solución de NaOH con
KH2PO4 (0,02) N, en la que se determinó que su
concentración de (0.01869 ± 0,00002) N
concentración de ácido fosfórico presente en
la coca -cola es de (0,01053 •± 0,00002) N y el
fosforo presente fue de (0,0029) g.
Bibliografía
Martínez, Yris. Ortiz Reynaldo. “Guía del
laboratorio de Análisis Instrumental”. Editada por
el Grupo de Electroquímica, Departamento de
Quimica de ULA, Mérida – Venezuela.
Wiki pedía Enciclopedia Virtual, 2007·
Programa: Microcal Origi
Вам также может понравиться
- Determinacion de Carbohidratos Por Cromatografia Liquida de Alta ResolucionДокумент10 страницDeterminacion de Carbohidratos Por Cromatografia Liquida de Alta ResolucionmarvinОценок пока нет
- Harina Centeno PDFДокумент9 страницHarina Centeno PDFJesús Miguel Jacinto NavaОценок пока нет
- Practica Intrumentacion - Decoloracion de La FenolftaleinaДокумент11 страницPractica Intrumentacion - Decoloracion de La FenolftaleinaALLAGE275% (4)
- Práctica 4 QuimicaДокумент10 страницPráctica 4 QuimicaDIEGO NAHUACATL HERNÁNDEZОценок пока нет
- Práctica 2Документ7 страницPráctica 2ppchuy344Оценок пока нет
- Laboratorio TensoactivosДокумент22 страницыLaboratorio TensoactivosFlores Aranda Aracely Mariana100% (1)
- Determinacion Del Peso Molecular de Un Vapor Condensable Por Los Metodos de Dumas y de Victor MeyerДокумент11 страницDeterminacion Del Peso Molecular de Un Vapor Condensable Por Los Metodos de Dumas y de Victor MeyerSEBASTIAN ALZATE ALZATEОценок пока нет
- Valoración Conductimétrica de Una Mezcla de Ácido Fuerte y Ácido DébilДокумент6 страницValoración Conductimétrica de Una Mezcla de Ácido Fuerte y Ácido DébilchorvoОценок пока нет
- ArticuloДокумент2 страницыArticuloDavid Mera Loboa100% (1)
- Argentometria Parte I - Preparación y Valoración de Una Solución de Nitrato de Plata.Документ7 страницArgentometria Parte I - Preparación y Valoración de Una Solución de Nitrato de Plata.Miller EspinozaОценок пока нет
- Determinación Del Porcentaje de Cenizas en AlimentosДокумент4 страницыDeterminación Del Porcentaje de Cenizas en AlimentosGeorgina MoyaОценок пока нет
- Practica 2 Siguenza Tapia Velandia NRC 2469Документ6 страницPractica 2 Siguenza Tapia Velandia NRC 2469Sasha Valeria Siguenza RoblesОценок пока нет
- Ejercicios de PotenciometriaДокумент4 страницыEjercicios de PotenciometriaWilfredo Campos mamaniОценок пока нет
- Metodos Cualitativos para La Identificación de ProteínasДокумент12 страницMetodos Cualitativos para La Identificación de ProteínasPañolekos Cascabelas50% (2)
- Informe 5 OriginalДокумент18 страницInforme 5 OriginalBryam Smith MolinaОценок пока нет
- Reporte Determinación Gravimétrica de Oxinato de Aluminio (III)Документ4 страницыReporte Determinación Gravimétrica de Oxinato de Aluminio (III)JOSE FRANCISCO MONROY PEREZ100% (1)
- 26436.ejercicio Del Cuestionario 8Документ3 страницы26436.ejercicio Del Cuestionario 8Camila Córdova LópezОценок пока нет
- Propiedades ColigativasДокумент8 страницPropiedades ColigativasJesusSainte CHОценок пока нет
- Determinación de CenizasДокумент5 страницDeterminación de CenizasMarlin CaicedoОценок пока нет
- ARДокумент3 страницыARmarcosh777Оценок пока нет
- EJERCICIOS 11 - Aplicación de La Precipitación y ComplejosДокумент5 страницEJERCICIOS 11 - Aplicación de La Precipitación y ComplejosNelsy Soto Giraldo100% (1)
- POLARIMETRIAДокумент14 страницPOLARIMETRIAelder apazaОценок пока нет
- Analítica Práctica 12. Determinación Turbidimétrica de SulfatosДокумент11 страницAnalítica Práctica 12. Determinación Turbidimétrica de SulfatosJose Alfonso Barreto E.Оценок пока нет
- 3-TEMA 3 Valoraciones Complejos AGV 19-20Документ76 страниц3-TEMA 3 Valoraciones Complejos AGV 19-20César100% (1)
- Ácido EsteáricoДокумент3 страницыÁcido EsteáricosdfdvdfОценок пока нет
- Práctica 5 Análisis Carbonatos BicarbonatosДокумент4 страницыPráctica 5 Análisis Carbonatos BicarbonatosFranklin Pastrana ArteagaОценок пока нет
- Determinacion Cloruro de Sodio Método de Mohr.Документ10 страницDeterminacion Cloruro de Sodio Método de Mohr.andr9s9ardilaОценок пока нет
- Analisis 2Документ56 страницAnalisis 2Cristian Marin RestrepoОценок пока нет
- 9 Determinacion de Cloruros Mediante Los Metodos de Precipitacion Mohr y VolhardДокумент3 страницы9 Determinacion de Cloruros Mediante Los Metodos de Precipitacion Mohr y VolhardmarinagbelmontОценок пока нет
- POLARIMETRIAДокумент6 страницPOLARIMETRIAgerson polentinoОценок пока нет
- Informe de AminoacidosДокумент8 страницInforme de AminoacidosTanya Muñoz0% (1)
- Cultivo Por Lote Aliment Ado de Saccharomyces Cerevisiae en Tanque AgitadoДокумент5 страницCultivo Por Lote Aliment Ado de Saccharomyces Cerevisiae en Tanque AgitadoFrancisco Contreras Del RioОценок пока нет
- Determinacion de Cloruros Por Los Metodos de Mohr Fajans y Volhard PDFДокумент10 страницDeterminacion de Cloruros Por Los Metodos de Mohr Fajans y Volhard PDFvaleriaОценок пока нет
- EstandarizacionДокумент4 страницыEstandarizacionAguirre García April AlondraОценок пока нет
- Lab 2. Extración y Reparto-Influencia Del PHДокумент5 страницLab 2. Extración y Reparto-Influencia Del PHSharon Dayan CubasОценок пока нет
- Determinación de La Acidez Total Del Vino BlancoДокумент2 страницыDeterminación de La Acidez Total Del Vino BlancoChiquinquira AnguloОценок пока нет
- Practica de Miscibilidad 2 FisicoquimicaДокумент7 страницPractica de Miscibilidad 2 FisicoquimicaYesi IguaneroОценок пока нет
- Aplicaciones de Las Titulaciones PotenciométricasДокумент8 страницAplicaciones de Las Titulaciones Potenciométricas708170Оценок пока нет
- Informe - Determinación de Calcio en El Vino.Документ8 страницInforme - Determinación de Calcio en El Vino.Yael MCОценок пока нет
- Separacion de Dicromato Permanganato Usando Una Columna de AlúminaДокумент6 страницSeparacion de Dicromato Permanganato Usando Una Columna de AlúminaSamuel Fernando DelgadoОценок пока нет
- Informe Fisico Quimica Conductividad Electrica en DisolucionesДокумент11 страницInforme Fisico Quimica Conductividad Electrica en DisolucionesDiegoGonzálezRiveraОценок пока нет
- Informe de AdsorcionДокумент11 страницInforme de AdsorcionDiego PradaОценок пока нет
- Bioenergetica Ejercicios 1Документ45 страницBioenergetica Ejercicios 1Minchola Ipanaque BryamОценок пока нет
- Punto Crioscopico de Diferentes Concentraciones de Salmuera y SacarosaДокумент12 страницPunto Crioscopico de Diferentes Concentraciones de Salmuera y Sacarosa20131300Оценок пока нет
- Determinación de Cloruros en Bebidas IsotónicasДокумент5 страницDeterminación de Cloruros en Bebidas IsotónicasJorge LuisОценок пока нет
- Informe Punto Isoelectrico de La ProteinasДокумент8 страницInforme Punto Isoelectrico de La ProteinasDarli DuarteОценок пока нет
- Informe DNSДокумент10 страницInforme DNSrugeroОценок пока нет
- Analisis GravimétricoДокумент29 страницAnalisis GravimétricoRosmeri Delinda QUISPE FLORESОценок пока нет
- Práctica 11 y 12 Determinación de Calcio y MagnesioДокумент8 страницPráctica 11 y 12 Determinación de Calcio y MagnesiomariaОценок пока нет
- RE-10-LAB-290 QUIMICA APLICADA v2Документ27 страницRE-10-LAB-290 QUIMICA APLICADA v2Ivan PortugalОценок пока нет
- Determinación de Acido Fosfórico en Coca-Cola Mediante Titulaciones Potenciométricas PDFДокумент7 страницDeterminación de Acido Fosfórico en Coca-Cola Mediante Titulaciones Potenciométricas PDFAnalio Dugarte100% (1)
- Informe Valoracion Potenciometrica Acido-BaseДокумент16 страницInforme Valoracion Potenciometrica Acido-BasePaola Valverde100% (1)
- 4 LABORATORIO TitulacionesДокумент11 страниц4 LABORATORIO TitulacionesAna Maria Soto RamirezОценок пока нет
- Informe Lab 5Документ16 страницInforme Lab 5Daniel Hernandez PeñaОценок пока нет
- Reporte p5 - Lab Qa1 - JCHC - JDRRДокумент8 страницReporte p5 - Lab Qa1 - JCHC - JDRRDaniel RodriguezОценок пока нет
- Informe 04 Quimica LaboratorioДокумент9 страницInforme 04 Quimica LaboratorioIvett Dayana Pérez CastilloОценок пока нет
- Practica #2. Valoración Del NaOH y HCIДокумент8 страницPractica #2. Valoración Del NaOH y HCIDeisy Cielo RamirezОценок пока нет
- Informe 7 - AnaliticaДокумент18 страницInforme 7 - AnaliticaTeffy LokitaОценок пока нет
- Importancia de La Temperatura de Las MuestrasДокумент4 страницыImportancia de La Temperatura de Las MuestrasGaby Quispe Ayala100% (1)
- Munich LalllemandДокумент2 страницыMunich LalllemandGaby Quispe AyalaОценок пока нет
- 2° Clase de EpidemiologiaДокумент51 страница2° Clase de EpidemiologiaGaby Quispe AyalaОценок пока нет
- Tesis Def Eva Ramirez Castro PDFДокумент110 страницTesis Def Eva Ramirez Castro PDFGaby Quispe AyalaОценок пока нет
- Vdocuments - MX - Determinacion de Carbohidratos Practica 1Документ11 страницVdocuments - MX - Determinacion de Carbohidratos Practica 1Gaby Quispe AyalaОценок пока нет
- Determinación Del Contenido de Proteínas Por El Método de KjeldahlДокумент11 страницDeterminación Del Contenido de Proteínas Por El Método de KjeldahlGaby Quispe AyalaОценок пока нет
- Trabajo de TiristoresДокумент42 страницыTrabajo de TiristoresFabiana Velasquez Gonzalez100% (1)
- MagnetismoДокумент7 страницMagnetismoJorge Gutierrez GamioОценок пока нет
- Cuestiones Tema 7Документ3 страницыCuestiones Tema 7Jose Martin Cortes HernandezОценок пока нет
- TabladealcancesДокумент1 страницаTabladealcancesGonzalo Andrés Sepúlveda SalazarОценок пока нет
- Cinética, Guía No 1.Документ4 страницыCinética, Guía No 1.Pablo GallardoОценок пока нет
- La Teoria Del Big Bang y El Origen Del UniversoДокумент20 страницLa Teoria Del Big Bang y El Origen Del UniversoPiero Alberto MolinaОценок пока нет
- Teoria de TransporteДокумент31 страницаTeoria de TransportesantaestefiОценок пока нет
- Sistemas de CargaДокумент35 страницSistemas de CargaJosé cubillos100% (3)
- Números CuánticosДокумент24 страницыNúmeros CuánticosRichard CedeñoОценок пока нет
- El Ajuste de Las Cañas en El Clarinete y El SaxofonДокумент13 страницEl Ajuste de Las Cañas en El Clarinete y El SaxofonRoberto Suarez Touzon86% (7)
- Solucion Guia 5 Ondas SenoidalesДокумент7 страницSolucion Guia 5 Ondas Senoidalesnancy60% (5)
- Partículas Magnéticas LLOGSAДокумент82 страницыPartículas Magnéticas LLOGSAhcmcrlho100% (2)
- Dinamica de EstructurasДокумент17 страницDinamica de EstructurasDarwin Tenorio67% (3)
- Herramientas Q Se Usan en Operaciones de Work OverДокумент25 страницHerramientas Q Se Usan en Operaciones de Work OverAndy Aldair Silupu Aleman50% (4)
- CPT-1 Universidad JaverianaДокумент11 страницCPT-1 Universidad JaverianaStella Gutierrez MariqueОценок пока нет
- Informe AceroДокумент8 страницInforme AceroVíctor Delgado RafaelОценок пока нет
- Cuadro Tecnico MetodologicoДокумент4 страницыCuadro Tecnico MetodologicoJOSE RODRIGUEZОценок пока нет
- DIAPOSITIVAS Diagramas de FaseДокумент9 страницDIAPOSITIVAS Diagramas de FaseMichel LopezОценок пока нет
- Primer Laboratorio de Quimica 2Документ5 страницPrimer Laboratorio de Quimica 2Carlos Atalaya CabanillasОценок пока нет
- Subestaciones BlindadasДокумент5 страницSubestaciones BlindadasAna MariaОценок пока нет
- Calibración de ConductoresДокумент6 страницCalibración de ConductoresEdgar Verano GonzalesОценок пока нет
- Fraccionamiento de EspumaДокумент4 страницыFraccionamiento de EspumaErick Ramos OlivaОценок пока нет
- Tulas Libro Vi Anexo 5Документ13 страницTulas Libro Vi Anexo 5javich00100% (1)
- Quimica Ejercicios ResueltosДокумент2 страницыQuimica Ejercicios ResueltosLuismi GázquezОценок пока нет
- Tipos de TermómetrosДокумент4 страницыTipos de TermómetrosJosmar OlanОценок пока нет
- Quimica OrganicaДокумент11 страницQuimica OrganicaAnonymous ExcNQWv7PОценок пока нет
- Acumulador EstaticoДокумент3 страницыAcumulador EstaticoRoberto Camus CuadraОценок пока нет
- Energía Negativa (Física) PDFДокумент3 страницыEnergía Negativa (Física) PDFDesignerr InEngineeringg Spacee AerospaceeОценок пока нет
- Hormigones RefractariosДокумент3 страницыHormigones RefractariosFernando Marquez100% (1)
- Problemario Unidad2Документ4 страницыProblemario Unidad2Daniel Avisaí0% (1)