Академический Документы
Профессиональный Документы
Культура Документы
Oxoaniones
Загружено:
Josue Hernandez Mrkz0 оценок0% нашли этот документ полезным (0 голосов)
88 просмотров3 страницыEl documento describe los oxoaniones, que son compuestos formados por un átomo central unido a átomos de oxígeno. Explica que la carga del ion depende del número de oxígenos y del estado de oxidación del átomo central. También discute cómo la fuerza de los ácidos formados por estos iones depende de factores como el tamaño atómico, la carga iónica y el estado de oxidación. Finalmente, resume las posibles reacciones de hidrólisis e hidratación que pueden ocurrir cuando los oxoan
Исходное описание:
oxoaninones
Оригинальное название
oxoaniones
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документEl documento describe los oxoaniones, que son compuestos formados por un átomo central unido a átomos de oxígeno. Explica que la carga del ion depende del número de oxígenos y del estado de oxidación del átomo central. También discute cómo la fuerza de los ácidos formados por estos iones depende de factores como el tamaño atómico, la carga iónica y el estado de oxidación. Finalmente, resume las posibles reacciones de hidrólisis e hidratación que pueden ocurrir cuando los oxoan
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
88 просмотров3 страницыOxoaniones
Загружено:
Josue Hernandez MrkzEl documento describe los oxoaniones, que son compuestos formados por un átomo central unido a átomos de oxígeno. Explica que la carga del ion depende del número de oxígenos y del estado de oxidación del átomo central. También discute cómo la fuerza de los ácidos formados por estos iones depende de factores como el tamaño atómico, la carga iónica y el estado de oxidación. Finalmente, resume las posibles reacciones de hidrólisis e hidratación que pueden ocurrir cuando los oxoan
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 3
Basicidad de los oxoaniones
Los oxianiones que aquí consideramos comprende a los grupos de partículas
representadas por la formula general:
XOmn-
En donde X, que puede ser un metal o no metal, está enlazado en forma covalente a
cierto número de átomos de oxígeno. La carga neta sobre las partículas depende del
número de oxígenos y del estado de oxidación del átomo central.
En forma más general, los oxianiones también incluyen a las series poliméricas:
XaOmn-
En las cuales algunos de los oxígenos se encuentran unidos a dos átomos de X lo que
crea una estructura tipo cadena.
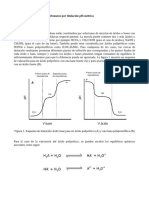
En la figura siguiente se ilustra la distribución de los elementos que forman oxianiones
cuando menos en uno de sus estados de oxidación.
FUERZA DE LOS OXIÁCIDOS
El grado de disociación de los oxiácidos se determina por el equilibrio siguiente.
H2O + HnXOm = H3O+ + Hn-1XOm-
El grado de transferencia de protones al agua en el equilibrio se puede correlacionar
con la estructura y el potencial iónico del ion central, Xn+, en donde n es el estado de
oxidación
Considerando la estructura general
La ruptura de la unión X-O es característica del comportamiento básico y la ruptura de
la unión O-H es peculiar del comportamiento ácido. Cuando ambas uniones se pueden
romper por tratamiento con un reactivo adecuado esta sustancia es anfótera.
La unión O-H se rompe más fácil cuando X tienen un potencial iónico alto
Para los oxiácidos de un elemento dado, mientras mayor sea el estado de oxidación,
más fuerte es el ácido, ya que el potencial iónico aumenta con el estado de oxidación.
HClO4>HClO3>HClO2>HClO
HNO3>HNO2
H2SO4>H2SO3
Si dentro de un grupo periódico se considera a los ácidos cuyos átomos centrales
tienen el mismo estado de oxidación, el primer miembro de dicho grupo forma el
oxiácido más fuerte:
HClO3>HBrO3>HIO3
H2SO4>H2SeO4>H6TeO6
También se pueden comparar las fuerzas de los ácidos formados por los elementos de
un periodo dado, en donde cada uno está en su estado de oxidación máximo:
HClO4>H2SO4>H3PO4>H4SiO4
HNO3>H2CO3>H3BO3
H3SeO4>H3AsO4>H2GeO3
COMPORTAMIENTO DE OXIANIONES EN SOLUCIÓN ACUOSA
Los oxianiones interaccionan de manera diferente con moléculas de agua, iones H + y
OH -, dependiendo del tamaño y la carga del átomo central, número de átomos de
oxígeno unidos y carga iónica.
Si las uniones entre el átomo central y los oxígenos tienen suficiente polaridad para
que dicho átomo sea neutro, se puede aplicar directamente el principio de
electroneutralidad para determinar la carga residual sobre cada oxígeno.
En solución básica en donde la concentración del ion hidronio es muy baja, los
protones disponibles son aquellos de las moléculas de agua. Las interacciones posibles
son:
Una reacción de hidrólisis en la cual los oxígenos se convierten en grupos OH
PO43- + H2O HOPO32- + OH-
SiO44- + H2O HOSiO33- + OH-
Una reacción de hidratación que también convierte los átomos de oxígeno en OH, pero
con un aumento en el número de coordinación del átomo central.
SnO22- + 2H2O Sn(OH)42-
ZnO22- + 2H2O Zn(OH)42-
Los dos tipos de reacciones pueden presentarse simultáneamente como en:
SbO43- + 4H2O Sb(OH)6- + 2OH-
Вам также может понравиться
- Oxianiones 97Документ52 страницыOxianiones 97garebanyОценок пока нет
- Oxianiones2 PDFДокумент43 страницыOxianiones2 PDFJulio CallupeОценок пока нет
- OXIANIONESДокумент25 страницOXIANIONESKaty JadanОценок пока нет
- Oxianiones 97Документ52 страницыOxianiones 97Mariana RojasОценок пока нет
- Cuestionario Hidruros, Oxidos e HidroxidosДокумент11 страницCuestionario Hidruros, Oxidos e Hidroxidoselisa barrazaОценок пока нет
- Reacciones en Disolución AcuosaДокумент31 страницаReacciones en Disolución AcuosaManuel Llano Martinez100% (9)
- Captura de Pantalla 2023-06-05 A La(s) 9.15.08 P.M.Документ9 страницCaptura de Pantalla 2023-06-05 A La(s) 9.15.08 P.M.Ashley CabreraОценок пока нет
- Estados de Oxidación y Nomenclatura de Los Compuestos InorgánicosДокумент4 страницыEstados de Oxidación y Nomenclatura de Los Compuestos InorgánicosJuan Pablo SanabriaОценок пока нет
- Curso VeranoДокумент32 страницыCurso Veranosamaracardenaz1903Оценок пока нет
- 2.3 Nomenclatura de Compuestos InorgánicosДокумент11 страниц2.3 Nomenclatura de Compuestos InorgánicosAdilene Trejo CervantesОценок пока нет
- Acidos y BasesДокумент18 страницAcidos y BasesArturo VasquezОценок пока нет
- Acidos y BasesДокумент9 страницAcidos y BasesKATHERYN SUESCUN GUEVARA100% (1)
- Acidos y Bases BronstedДокумент4 страницыAcidos y Bases BronstedmorenomОценок пока нет
- Práctica #9 Ácidos y BasesДокумент9 страницPráctica #9 Ácidos y BasesingrossОценок пока нет
- Resumen Cap 15Документ7 страницResumen Cap 15Kristel Alfaro MadrigalОценок пока нет
- Resumen Cap 15 y 16Документ13 страницResumen Cap 15 y 16Kristel Alfaro MadrigalОценок пока нет
- Teoría ÁcidoДокумент4 страницыTeoría ÁcidoErica Pertuz RuaОценок пока нет
- Dec - Fq.edu - Uy Catedra Inorganica Inorganica Practica11Документ10 страницDec - Fq.edu - Uy Catedra Inorganica Inorganica Practica11Daniel CabreraОценок пока нет
- Equilibrio Ácido Base y AmortiguadoresДокумент14 страницEquilibrio Ácido Base y AmortiguadoresRo MazzeoОценок пока нет
- Reacciones Acido BaseДокумент11 страницReacciones Acido BaseLupe EspinozaОценок пока нет
- UNIDAD III - Semana 12 NEUTRALIZACION ACIDO BASEДокумент17 страницUNIDAD III - Semana 12 NEUTRALIZACION ACIDO BASEOmar Isaac Villaverde LopezОценок пока нет
- FiifiiДокумент11 страницFiifiiJonathan Gadiel Ramirez MartinezОценок пока нет
- Basicidad de Los Oxoaniones PracticaДокумент4 страницыBasicidad de Los Oxoaniones PracticaErnesto ZavalaОценок пока нет
- Acidez y Basicidad de Compuestos OrgánicosДокумент13 страницAcidez y Basicidad de Compuestos OrgánicosJuan Jay Casal83% (12)
- Acidos OxacidosДокумент4 страницыAcidos OxacidosJuan Carlos Gomez100% (2)
- Bitácora BasicidadoxoДокумент4 страницыBitácora BasicidadoxoGabriela GarciaОценок пока нет
- Resumen Cap 15Документ6 страницResumen Cap 15Kristel Alfaro MadrigalОценок пока нет
- Practica Nº4, PH, Sol ReguladorasДокумент23 страницыPractica Nº4, PH, Sol ReguladorasDam_TОценок пока нет
- HidroxidosДокумент9 страницHidroxidosirvin vea100% (1)
- BaseДокумент11 страницBaseAngel Valencia CastrejonОценок пока нет
- EXPO Oxácidos y OxisalesVДокумент3 страницыEXPO Oxácidos y OxisalesVferloko2566Оценок пока нет
- NOMENCLATURA12Документ6 страницNOMENCLATURA12DAYAN PILAR LEDESMA CHAVEZОценок пока нет
- Equipo 3 ÉteresДокумент20 страницEquipo 3 ÉteresBini AdameОценок пока нет
- Reacciones Acido BaseДокумент11 страницReacciones Acido BaseLupe EspinozaОценок пока нет
- P6. Inorganica 1Документ3 страницыP6. Inorganica 1joelОценок пока нет
- Guía Equilibrio Químico-Ph 10Документ14 страницGuía Equilibrio Químico-Ph 10lissetteОценок пока нет
- Teoría de ArrheniusДокумент6 страницTeoría de ArrheniusskynetОценок пока нет
- 6 35RssySchzДокумент7 страниц6 35RssySchzRebeca Rosas HernándezОценок пока нет
- UntitledДокумент10 страницUntitledVicky Olivero MengoОценок пока нет
- Acidos y Bases de Bronsted y LowryДокумент4 страницыAcidos y Bases de Bronsted y LowryCeleste LeyvaОценок пока нет
- Conceptos 1° SesiónДокумент6 страницConceptos 1° SesiónSamuel Ramírez RamírezОценок пока нет
- Marco TeóricoДокумент6 страницMarco TeóricoAnderson Guerrero AldanaОценок пока нет
- Informe Quimica UnalmДокумент15 страницInforme Quimica UnalmItalo Garay TejadaОценок пока нет
- Base (Química)Документ13 страницBase (Química)Juano Valls FerrerОценок пока нет
- Base (Química)Документ13 страницBase (Química)Melina LamОценок пока нет
- Plantilla Protocolo Colaborativo 2Документ22 страницыPlantilla Protocolo Colaborativo 2Janebis RodeloОценок пока нет
- Apuntes Sobre Reacciones Ácido-BaseДокумент19 страницApuntes Sobre Reacciones Ácido-BaseLaboratoriodeciencias Altazor100% (1)
- MÓDULO 3 (Inorgánica) - BIOLOGIA (Curso de Ingreso UnLaM)Документ4 страницыMÓDULO 3 (Inorgánica) - BIOLOGIA (Curso de Ingreso UnLaM)Luisa GuerreroОценок пока нет
- Compuestos Orgánicos e InorgánicosДокумент12 страницCompuestos Orgánicos e InorgánicosDavid FelixОценок пока нет
- Compuesto InorgánicoДокумент16 страницCompuesto InorgánicoErick Alvarez LopezОценок пока нет
- PrólogoДокумент4 страницыPrólogoYasmin BartolonОценок пока нет
- Módulo Completo 5°nat 2021Документ53 страницыMódulo Completo 5°nat 2021Candela MasareОценок пока нет
- Unidad 2-Qi1Документ78 страницUnidad 2-Qi1marlon tulcanazoОценок пока нет
- Par Conjugado Bioquimica 2Документ3 страницыPar Conjugado Bioquimica 2ana yuivi yucraОценок пока нет
- Determinacion de Grupos FuncionalesДокумент18 страницDeterminacion de Grupos FuncionalesHellen BruzualОценок пока нет
- ¿Qué Aprendí? Ácidos y BasesДокумент2 страницы¿Qué Aprendí? Ácidos y BasesJeffrey EnriqueОценок пока нет
- Clase de CienciasДокумент27 страницClase de CienciasEnero RoceroОценок пока нет
- Disociación de ElectrolitosДокумент3 страницыDisociación de ElectrolitosMauro GonzaloОценок пока нет
- Revista Cubana de Química 0258-5995: Issn: Revcubanaquimica@cnt - Uo.edu - CuДокумент11 страницRevista Cubana de Química 0258-5995: Issn: Revcubanaquimica@cnt - Uo.edu - CuJosue Hernandez MrkzОценок пока нет
- Resumen HipertermiaДокумент1 страницаResumen HipertermiaJosue Hernandez MrkzОценок пока нет
- Resumen Del Video Sobre El Microscopio de Tunelaje ElectrónicoДокумент1 страницаResumen Del Video Sobre El Microscopio de Tunelaje ElectrónicoJosue Hernandez MrkzОценок пока нет
- Libro de Ejercicios de CromatográfiaДокумент106 страницLibro de Ejercicios de CromatográfiaJosue Hernandez MrkzОценок пока нет
- Método Acción CapilarДокумент5 страницMétodo Acción CapilarJosue Hernandez MrkzОценок пока нет
- Tensiómetro de Método de Anillo DunouyДокумент6 страницTensiómetro de Método de Anillo DunouyJosue Hernandez MrkzОценок пока нет
- Un Metodo Pra La Determinacion de Tencion SuperficialДокумент3 страницыUn Metodo Pra La Determinacion de Tencion SuperficialJosue Hernandez MrkzОценок пока нет
- 5) Rapidez de Reacción y TemperaturaДокумент13 страниц5) Rapidez de Reacción y TemperaturaJosue Hernandez MrkzОценок пока нет
- 3) Reacciones en CadenaДокумент25 страниц3) Reacciones en CadenaJosue Hernandez MrkzОценок пока нет
- 1) Orden de Reaccion y Reacciones ComplejasДокумент53 страницы1) Orden de Reaccion y Reacciones ComplejasJosue Hernandez MrkzОценок пока нет
- Química Cuántica I Parcial 3Документ4 страницыQuímica Cuántica I Parcial 3Josue Hernandez MrkzОценок пока нет
- 6) Teoria de Colisiones y Del Estado de TransicionДокумент34 страницы6) Teoria de Colisiones y Del Estado de TransicionJosue Hernandez MrkzОценок пока нет
- 1) Orden de Reaccion y Reacciones ComplejasДокумент53 страницы1) Orden de Reaccion y Reacciones ComplejasJosue Hernandez MrkzОценок пока нет
- Serie 4 Cinetica Quimica2021-2Документ4 страницыSerie 4 Cinetica Quimica2021-2Josue Hernandez MrkzОценок пока нет
- Serie 3 Cinetica Quimica2021-2Документ6 страницSerie 3 Cinetica Quimica2021-2Josue Hernandez MrkzОценок пока нет
- Los Elementos Del Grupo 15Документ10 страницLos Elementos Del Grupo 15Josue Hernandez MrkzОценок пока нет
- Sol-Gel EsquemaДокумент1 страницаSol-Gel EsquemaJosue Hernandez MrkzОценок пока нет
- Serie 2 Cinetica Quimica2021-2Документ7 страницSerie 2 Cinetica Quimica2021-2Josue Hernandez MrkzОценок пока нет
- Serie 1 Cinetica Quimica2021-2Документ6 страницSerie 1 Cinetica Quimica2021-2Josue Hernandez MrkzОценок пока нет
- Reporte Heterociclos Inorgánicos TiotetrazolesДокумент4 страницыReporte Heterociclos Inorgánicos TiotetrazolesJosue Hernandez MrkzОценок пока нет
- SobrepotencialДокумент2 страницыSobrepotencialJosue Hernandez MrkzОценок пока нет
- Cuestiones Tema 3Документ51 страницаCuestiones Tema 3ÁlvaroОценок пока нет
- Practico PHДокумент8 страницPractico PHValeria PachecoОценок пока нет
- Práctica 2Документ12 страницPráctica 2Pamela TeránОценок пока нет
- Práctica 5 Análisis Carbonatos BicarbonatosДокумент4 страницыPráctica 5 Análisis Carbonatos BicarbonatosFranklin Pastrana ArteagaОценок пока нет
- Guia Práctica 6 Curva Van Deemter Con FID 2019Документ4 страницыGuia Práctica 6 Curva Van Deemter Con FID 2019JAIRO ALBERTO CALDERON PADILLAОценок пока нет
- 12 Acidos y Bases PDFДокумент20 страниц12 Acidos y Bases PDFbenavidesОценок пока нет
- Caso 2 IBCMДокумент6 страницCaso 2 IBCMSofia MierОценок пока нет
- Analsis de Cloruro de SodioДокумент7 страницAnalsis de Cloruro de SodioEzequiel Wal Quispe MurilloОценок пока нет
- Destilación (Simquim) Columna PlatosДокумент12 страницDestilación (Simquim) Columna PlatosNohemi ElizabethОценок пока нет
- Soluciones-Normalizacion 2019Документ13 страницSoluciones-Normalizacion 2019José Moreto CamposОценок пока нет
- Potenciometría Ácido BaseДокумент9 страницPotenciometría Ácido BaseLuisa GonzalezОценок пока нет
- Lixiviacion de PBДокумент10 страницLixiviacion de PBwera RoncaglioloОценок пока нет
- Análisis de Una Muestra de Cloruro FerrosoДокумент7 страницAnálisis de Una Muestra de Cloruro Ferrososharon moreiraОценок пока нет
- Valoración de Un Ácido Débil Con Una Base FuerteДокумент12 страницValoración de Un Ácido Débil Con Una Base FuerteMargion De ValoisОценок пока нет
- AcidimetriaДокумент6 страницAcidimetriaWiliams CHОценок пока нет
- Phet Acid Base Lab-Test ResueltoДокумент5 страницPhet Acid Base Lab-Test ResueltoLourdes QuinteroОценок пока нет
- Proyecto Quimica IdoyagaДокумент9 страницProyecto Quimica IdoyagaMelu MoriciОценок пока нет
- Taller Grupal - QuímicaДокумент8 страницTaller Grupal - QuímicaYESSENIA MICHELLE VISCARRA VELIZОценок пока нет
- Protocolo Preparación SolucionesДокумент4 страницыProtocolo Preparación SolucionesYohan Sebastian FlórezОценок пока нет
- Formulario - Lab-For-001 Solicitud ServicioДокумент1 страницаFormulario - Lab-For-001 Solicitud ServicioLuisa CcaОценок пока нет
- Trabajo Práctico N1 Volumetria Q. AnaliticaДокумент6 страницTrabajo Práctico N1 Volumetria Q. AnaliticaSol MoniecОценок пока нет
- TM11Документ8 страницTM11Pablo Lopez PiñeiroОценок пока нет
- Calcule La Concentración Del Persulfato de PotasioДокумент2 страницыCalcule La Concentración Del Persulfato de PotasioubaldoОценок пока нет
- Equilibrio Químico PDFДокумент6 страницEquilibrio Químico PDFmichelleОценок пока нет
- UnisimДокумент34 страницыUnisimMaria PaulaОценок пока нет
- Informe Practica 3Документ7 страницInforme Practica 3Edwin CanteroОценок пока нет
- Guía Nº4 - Lab. Titulación Ácido-BaseДокумент5 страницGuía Nº4 - Lab. Titulación Ácido-Basejuan francisco urzua ramirezОценок пока нет
- Examen 2do ParcialДокумент20 страницExamen 2do ParcialMontseОценок пока нет
- Curvas de Valoración Ácido BaseДокумент7 страницCurvas de Valoración Ácido Basemayerlin hoyos doradoОценок пока нет
- Titulaciones Quimica AnaliticaДокумент3 страницыTitulaciones Quimica AnaliticaCamila Caicedo NaviaОценок пока нет