Академический Документы
Профессиональный Документы
Культура Документы
Trabajo de Materiales 2
Загружено:
Javier Andres Chalapud Ramirez0 оценок0% нашли этот документ полезным (0 голосов)
48 просмотров4 страницыОригинальное название
Trabajo de materiales 2.docx
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
48 просмотров4 страницыTrabajo de Materiales 2
Загружено:
Javier Andres Chalapud RamirezАвторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 4
Materiales de ingeniería I
Trabajo #2
Elaborado por:
Javier Andrés Chalapud Ramírez
Código: 1004580849
Presentado a:
José Luddey Marulanda Arévalo
UNIVERSIDAD TECNOLOGICA DE PEREIRA
*1. Una de las siguientes afirmaciones respecto a las aleaciones eutécticas es falsa: (Justifique).
a) El punto de fusión de estas aleaciones se encuentra entre los puntos de fusión de los
dos metales que forman la aleación.
2. ¿Cuál de las siguientes condiciones resultan imprescindibles para que dos metales presenten
solubilidad total en el estado sólido?: (Justifique)
e) Todas las anteriores.
*3. La transformación eutéctica, permite endurecer una aleación, a cambio de: (Justifique)
d) Todas son correctas.
*4. La aparición de segregación dendrítica va acompañada de: (Justifique)
c) Una mayor resistencia mecánica.
*5. En una estructura metálica dendrítica, el eje longitudinal de las dendritas coincide con:
(Justifique).
b) Dirección cristalográfica preferente.
*6. El empleo de afinadores hace aumentar: (Justifique)
a) La velocidad de nucleación.
*7. En los diagramas de equilibrio los cambios de fase vienen representados por: (Justifique)
d. Todas son correctas.
*8. Un proceso de solidificación industrial se califica de reversible cuando: (Justifique)
b. La velocidad de enfriamiento permite los procesos de difusión.
9. La transformación eutéctica, permite endurecer una aleación, a cambio de: (Justifique)
d. Todas son correctas.
10.Las características de una aleación con estructura segregada son: (Justifique)
b. Mayor susceptibilidad a la corrosión intergranular.
11.Las aleaciones de composición eutéctica se emplean habitualmente para: (Justifique)
a. Obtener piezas por colada.
12.El análisis térmico diferencial sirve para determinar: (Justifique)
b. La temperatura de inicio y terminación en el cambio de fase.
13.Un diagrama de fases para dos metales es único si durante el enfriamiento se cumplen
las siguientes condiciones: (Justifique)
c. Es un proceso termodinámicamente reversible.
14.El control de la velocidad de enfriamiento para obtener un diagrama de equilibrio debe
realizarse: (Justifique)
a. Durante todo el proceso.
15.Al alear un metal con otro con solubilidad total en el estado sólido, se consigue (Justifique)
d. A y B son correctas.
16.Un proceso realizado industrialmente se supone que corresponde a un enfriamiento reversible
sí: (Justifique)
b. Se comprueba que se ha permitido la realización de los procesos de difusión requeridos
en el enfriamiento.
17.Las condiciones necesarias, no suficientes, para que dos metales tengan solubilidad total en el
estado sólido son: (Justifique)
c. A y B son correctas.
18.La segregación dendrítica tiene lugar con mayor intensidad en la solidificación con velocidad
importante de enfriamiento: (Justifique)
c. En aleaciones con amplio intervalo de solidificación.
19.El efecto coring en los granos obtenidos por solidificación con enfriamiento industrial puede ser
comprobado por: (Justifique)
d. Todas son correctas.
20.Indica las propiedades verdaderas de una estructura segregada: (Justifique)
d. Puede sufrir fragilidad en caliente durante el proceso de forja.
21.Al alear un metal con otro con solubilidad total en el estado sólido, se consigue: (Justifique)
d. A y B son correctas.
22.Porque no pueden existir metales que se aleen intersticialmente, con solubilidad total en estado
sólido.
Los metales tienen una estructura cristalina muy compacta y para crear una aleación
intersticial en todo el compuesto sería imposible haciendo esto solo posible en la superficie
de estos compuestos es de esta manera que se emplea este método.
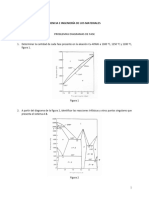
23.El diagrama de equilibrio de la figura corresponde al sistema Cd-Zn. A partir del mismo, Obtener:
a) Porcentaje de la mezcla eutéctica a 200°C.
α=1.95% Zn (99.1-17.4) / (99.1-1.95) = 84.1%
β=99.1% Zn (17.4-1.95) / (99.1-1.95) = 15.9%
b) Para una aleación con un 50% de Zn, calcular el porcentaje de fases a 200°C.
α=1.95% Zn (99.1-50.0) / (99.1-1.95) = 50.54%
β=99.1% Zn (50.0-1.95) / (99.1-1.95) = 49.46%
c) Para una aleación del 60% de Zn, calcular el porcentaje de constituyentes a 300°C.
Liquido=32.1% Zn (97.6-60.0) / (97.6-32.1) = 57.40%
β= 97.6% Zn (60.0-32.1) / (97.6-32.1) = 42.60%
d) Para una aleación de cadmio con el 8% de Zn, transformaciones que experimenta al
enfriarse desde los 400°C.
- De los 400°C a los 288°C, la aleación se encuentra en estado líquido.
- A los 288°C inicia la solidificación que acaba a los 266°C, temperatura de
transformación eutéctica.
- A los 266°C tiene lugar la transformación eutéctica del líquido restante.
- A partir de los 266°C no presenta más transformaciones, por lo que la estructura del sólido
será de fase a proeutéctica junto a granos eutécticos procedentes de la transformación del
último líquido.
24.Para la aleación Cd-Zn, del 70% en peso de zinc, cuyo diagrama de equilibrio se representa en la
figura anterior, calcular a 200°C:
a. La cantidad de cada fase presente.
α= (99-70) / (99-2) =29.9%
β= (70-2) / (99-2) =70.1%
b. La cantidad de cada tipo de grano presente en la microestructura. Hacer una
representación gráfica de ella a temperatura ambiente.
β= (70-17.4) / (99-17.4) =64.46%
Eutéctico= (99-70) / (99-17.4) =35.54%
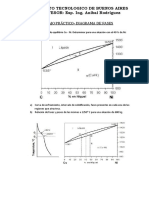
25.Un acero hipo eutectoide (0,4%C) se enfría lentamente desde 970 C hasta la temperatura
ambiente. Calcula a partir del diagrama Hierro-Carbono simplificado:
a) La cantidad de Austenita (γ) para 970oC y su composición.
FALTA
26.Que es el subenfriamiento?
Se refiere a un liquido presente por debajo de su temperatura normal de ebullición.
27. El diagrama de equilibrio de la figura correspondiente al sistema Ag-Cu. Indicar:
28.Sobre el diagrama de fases Ag-Cu, representado en la figura siguiente, determinar:
a) El rango de aleaciones que sufrirán total o parcialmente, la transformación eutéctica.
Вам также может понравиться
- Mecánica de la fractura y análisis de falla en metalesОт EverandMecánica de la fractura y análisis de falla en metalesРейтинг: 4.5 из 5 звезд4.5/5 (3)
- Elementos de concreto reforzado IIОт EverandElementos de concreto reforzado IIРейтинг: 5 из 5 звезд5/5 (1)
- Problemas de Tratamientos TermicosДокумент12 страницProblemas de Tratamientos TermicosHQ MadelyОценок пока нет
- Diagrama de FasesДокумент17 страницDiagrama de FasesCristian Jesús Apaza MamaniОценок пока нет
- Ejercicios de La Pau Resueltos de Tecnología Industrial 2Документ92 страницыEjercicios de La Pau Resueltos de Tecnología Industrial 2lucia100% (1)
- Gestion de Riesgo EmpresarialДокумент7 страницGestion de Riesgo EmpresarialJ Liliana Narvaez Gomez0% (1)
- Caracterización química, morfológica y estructural de materialesОт EverandCaracterización química, morfológica y estructural de materialesОценок пока нет
- El Rol Del Auditor Interno en La Detección de Fraudes y CorrupciónДокумент22 страницыEl Rol Del Auditor Interno en La Detección de Fraudes y CorrupciónIrving López50% (2)
- Ejercicios Resueltos de Metalurgia Fisica LLДокумент9 страницEjercicios Resueltos de Metalurgia Fisica LLJoel Rodrigo Castillo Espinoza100% (2)
- Examen Con AlternativasДокумент4 страницыExamen Con AlternativasOscar Jean Paul Sullca RomeroОценок пока нет
- Pilotaje ArmaduraДокумент13 страницPilotaje ArmaduraKlein ParraОценок пока нет
- Presas o Centrales Hidroeléctricas de El SalvadorДокумент4 страницыPresas o Centrales Hidroeléctricas de El SalvadorJvr Vasquez0% (1)
- Materiales de Ingeniería Taller 2Документ7 страницMateriales de Ingeniería Taller 2MaikyVillegasОценок пока нет
- Endurecimiento de AleacionesДокумент30 страницEndurecimiento de AleacionesDario MetalurgicaОценок пока нет
- Diagramas de FaseДокумент30 страницDiagramas de FaseLuis E.SОценок пока нет
- Actividad 2 Fisicoquimica IIДокумент5 страницActividad 2 Fisicoquimica IIfranchescaОценок пока нет
- Cuestionario de Preguntas Iv Ciclo BДокумент6 страницCuestionario de Preguntas Iv Ciclo BPedro Arturo Ramirez RojasОценок пока нет
- Act 2 PREGUNTAS ALEACIONESДокумент6 страницAct 2 PREGUNTAS ALEACIONESLUAR PADRONОценок пока нет
- Examen III Teoria 2020-20Документ2 страницыExamen III Teoria 2020-20jackelin inderique vera100% (2)
- Preguntas para El Examen Final de MC 112 Ciclo 2020Документ6 страницPreguntas para El Examen Final de MC 112 Ciclo 2020RafaelОценок пока нет
- Meta Fisica 1 Segundo ParcialДокумент14 страницMeta Fisica 1 Segundo ParcialJesus David Lazaro ColoniaОценок пока нет
- Diagramas de FasesДокумент6 страницDiagramas de FasesbersicilovasconexОценок пока нет
- 4 Diagramas de Fases PAUДокумент3 страницы4 Diagramas de Fases PAUlos_pajarillosОценок пока нет
- PAU - 2002 - 2010 - Aleaciones y Diagramas de FasesДокумент11 страницPAU - 2002 - 2010 - Aleaciones y Diagramas de FasesjmbravomОценок пока нет
- Con El Diagrama de Equilibrio CuДокумент13 страницCon El Diagrama de Equilibrio Cumoisesurbano17Оценок пока нет
- Problemas 1Документ7 страницProblemas 1Rsvz AikiОценок пока нет
- Ejercicio 06Документ23 страницыEjercicio 06Dante P. Caso100% (1)
- Documento 39Документ10 страницDocumento 39Yvan BravoОценок пока нет
- Apunte 6 Estructuras Polifasicas de Los Metales y Diagramas de Fases (2012)Документ20 страницApunte 6 Estructuras Polifasicas de Los Metales y Diagramas de Fases (2012)Carlos SuazoОценок пока нет
- Certamen 3Документ6 страницCertamen 3Jonathan Aranguiz HenriquezОценок пока нет
- Diagramas de Equilibrio (PAU)Документ10 страницDiagramas de Equilibrio (PAU)fagonzalez1958Оценок пока нет
- (UESAN) (Diagrama Fases - Ejercicios) (2018 2) (PC04) (Acosta) (PREG)Документ11 страниц(UESAN) (Diagrama Fases - Ejercicios) (2018 2) (PC04) (Acosta) (PREG)jhomerОценок пока нет
- (UESAN) (Diagrama Fases - Ejercicios) (2018 2) (PC04) (Acosta) (PREG)Документ11 страниц(UESAN) (Diagrama Fases - Ejercicios) (2018 2) (PC04) (Acosta) (PREG)Cristian Daniel CORAL SANCHEZОценок пока нет
- Taller Diagrama HierroДокумент3 страницыTaller Diagrama HierroCarlos Posso UrzolaОценок пока нет
- Ejerciciosndendiagramandenfasesnparanpromediarnlosndosndepartamentalesn 646004a31344a97Документ8 страницEjerciciosndendiagramandenfasesnparanpromediarnlosndosndepartamentalesn 646004a31344a97Vanesa Pérez SánchezОценок пока нет
- Ejercicios Primera ParteДокумент4 страницыEjercicios Primera ParteJaime Alfonso Gonzalez Vivas100% (1)
- Ejercicio de Diagrama de FaseДокумент8 страницEjercicio de Diagrama de Faseخافيير ألونسو شيروك كونتريراسОценок пока нет
- Unidad 7: Endurecimiento Por Aleación. Aleacio-Nes Con Transformación MartensíticaДокумент26 страницUnidad 7: Endurecimiento Por Aleación. Aleacio-Nes Con Transformación MartensíticaKarol Moris LoОценок пока нет
- Discusion 7 1qesДокумент9 страницDiscusion 7 1qeserick414141Оценок пока нет
- Preguntas Examen 2011Документ21 страницаPreguntas Examen 2011MNayeli Rosas ReyesОценок пока нет
- 2 Do Examen Parcial Nov-2021Документ3 страницы2 Do Examen Parcial Nov-2021Dacio Gabriel Forja MirandaОценок пока нет
- Ejercicios Diagrama de FasesДокумент7 страницEjercicios Diagrama de FasesJosé Manuel Luis Gutiérrez0% (1)
- 1 Ejercicios de Tratamientos TermicosДокумент14 страниц1 Ejercicios de Tratamientos TermicosOscar Jean Paul Sullca RomeroОценок пока нет
- Ejercicio 07Документ35 страницEjercicio 07Rocio Garay ChiccheОценок пока нет
- Practica de Ciencia de Los MaterialesДокумент6 страницPractica de Ciencia de Los MaterialesMarco LoayzaОценок пока нет
- Ejercicios de Diagramas de EquilibrioДокумент17 страницEjercicios de Diagramas de EquilibrioutrajОценок пока нет
- GUÃ A EJERCICIOS Diagrama de FasesДокумент3 страницыGUÃ A EJERCICIOS Diagrama de FasesJorge Andres Tapia AlburquenqueОценок пока нет
- Upc Epe PC2Документ10 страницUpc Epe PC2Vanesa JesusОценок пока нет
- PAYANOДокумент9 страницPAYANOKevin AguirreОценок пока нет
- Problemas Resueltos Metalurgia Física IIДокумент15 страницProblemas Resueltos Metalurgia Física IIJorge Alvaro Quispe LiñanОценок пока нет
- Metalurgia de La SoldaduraДокумент16 страницMetalurgia de La SoldaduraEdison GonzОценок пока нет
- Examen Met. Sold. 2015-1Документ2 страницыExamen Met. Sold. 2015-1patrick0% (1)
- 2015 - Diagramas de FasesДокумент11 страниц2015 - Diagramas de FasesAyelenОценок пока нет
- Problemas Diagramas de FaseДокумент9 страницProblemas Diagramas de FasereformasmramirezОценок пока нет
- TRABAJO PRÁCTICO Diagrama de FasesДокумент9 страницTRABAJO PRÁCTICO Diagrama de FasesRodriguezAnibalAdrianОценок пока нет
- Tarea MaterialesДокумент4 страницыTarea MaterialesCristhian CarrilloОценок пока нет
- Trabajo Individual 3Документ4 страницыTrabajo Individual 3Pedro José PadillaОценок пока нет
- Problem AsДокумент9 страницProblem Asamele_810% (1)
- Tratamiento TérmicoДокумент22 страницыTratamiento TérmicoFrank ManciaОценок пока нет
- Fundamentos de Mecánica de Fluídos - Munson, Young, Okiishi - 1ed PDFДокумент869 страницFundamentos de Mecánica de Fluídos - Munson, Young, Okiishi - 1ed PDFJavier Andres Chalapud RamirezОценок пока нет
- 2.6 Teoria de Las BandasДокумент6 страниц2.6 Teoria de Las BandasIsrael RaОценок пока нет
- Taller Campo Electrico PDFДокумент3 страницыTaller Campo Electrico PDFJavier Andres Chalapud RamirezОценок пока нет
- Valores y Vectores CaracteristicosДокумент4 страницыValores y Vectores CaracteristicosJavier Andres Chalapud RamirezОценок пока нет
- Transformacion Lineal PDFДокумент1 страницаTransformacion Lineal PDFJavier Andres Chalapud RamirezОценок пока нет
- Valores y Vectores CaracteristicosДокумент4 страницыValores y Vectores CaracteristicosJavier Andres Chalapud RamirezОценок пока нет
- Características Principales Obras de RetenciónДокумент2 страницыCaracterísticas Principales Obras de RetenciónJavier Andres Chalapud RamirezОценок пока нет
- Gal2 Fing Udelar (Hasta Primer Parcial)Документ13 страницGal2 Fing Udelar (Hasta Primer Parcial)luka.f.miguezОценок пока нет
- Pauta de CotejoДокумент10 страницPauta de Cotejovaleria.arqueroОценок пока нет
- Proyecto SatuДокумент126 страницProyecto SatuAdita Machaca PalliОценок пока нет
- La Cultura Tributaria y Su Efecto en La Evasión Fiscal enДокумент25 страницLa Cultura Tributaria y Su Efecto en La Evasión Fiscal enRIAH1980Оценок пока нет
- Fugas de Gas - HS680 - Alfaa InstrumentosДокумент8 страницFugas de Gas - HS680 - Alfaa InstrumentosGonzalo RebolledoОценок пока нет
- OMT282665 (Manual Operador 250D y 300D)Документ260 страницOMT282665 (Manual Operador 250D y 300D)Luis Paladines Bravo0% (1)
- Formulacion y Evaluacion de ProyectosДокумент9 страницFormulacion y Evaluacion de ProyectosJose Luis BoalñosОценок пока нет
- Concepto SatakeholdersДокумент2 страницыConcepto SatakeholdersstrangerОценок пока нет
- Cuestionario ContabilidadДокумент4 страницыCuestionario ContabilidadBaco LinxcoreОценок пока нет
- Mando: Excel FVДокумент102 страницыMando: Excel FVGonzalo CejaОценок пока нет
- Observa El Video Economía SocialДокумент5 страницObserva El Video Economía SocialJohanna Vargas HernandezОценок пока нет
- Primer ParcialДокумент7 страницPrimer ParcialEsteban GuadarramaОценок пока нет
- Areas Funcionales (Javier Tito-Jaime Sarco)Документ8 страницAreas Funcionales (Javier Tito-Jaime Sarco)Victor SaireОценок пока нет
- TGS-05 Arquetipos SistúmicosДокумент25 страницTGS-05 Arquetipos SistúmicosHypnosОценок пока нет
- Parque A&z (Urbanismo II - Grupo 05)Документ63 страницыParque A&z (Urbanismo II - Grupo 05)ASDRIC DAPHNE CORDOVA YARAHUAMANОценок пока нет
- Dictamen 2019Документ65 страницDictamen 2019milagros8pilar8mercaОценок пока нет
- IntegraciónДокумент7 страницIntegraciónBelen AlvarezОценок пока нет
- Seleccion de Personal en Instituciones EducativasДокумент6 страницSeleccion de Personal en Instituciones Educativasrocio milagros farfan silvaОценок пока нет
- Evidencia AA2-Ev3 Informe Estudio de CasoДокумент4 страницыEvidencia AA2-Ev3 Informe Estudio de CasoDavid Jhonatan Castro InfanteОценок пока нет
- Guía para La Utilización de Herramientas de Evaluación Supervisada (Proctoring)Документ5 страницGuía para La Utilización de Herramientas de Evaluación Supervisada (Proctoring)Hypatia Viale RojasОценок пока нет
- Papeleria Nuevo Vive Abril 2020Документ14 страницPapeleria Nuevo Vive Abril 2020Cl Jv GuzmánОценок пока нет
- Atencion ProgresivaДокумент11 страницAtencion ProgresivaRicardo Sanchez gomezОценок пока нет
- Ficha Finiquito VL1Документ12 страницFicha Finiquito VL1Maycol MarcialОценок пока нет
- Entrega 2. Costos y PresupuestosДокумент20 страницEntrega 2. Costos y Presupuestosガルソン クリスティアンОценок пока нет
- FORMACION Carmen y LeidyДокумент6 страницFORMACION Carmen y LeidyAna montesОценок пока нет
- Diapos Examen Parcial - Clinica Ricardo PalmaДокумент33 страницыDiapos Examen Parcial - Clinica Ricardo PalmaAlexandra LoayzaОценок пока нет