Академический Документы
Профессиональный Документы
Культура Документы
Ejercicios Enzimas
Загружено:
Marcos VeraОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Ejercicios Enzimas
Загружено:
Marcos VeraАвторское право:
Доступные форматы
EJERCICIOS CINÉTICA ENZIMÁTICA
1. Esquematiza la siguiente información:
La ureasa cataliza la hidrólisis de la urea a amoniaco y CO2. A 295 K, la reacción sin catalizar tiene
una energía de activación de aproximadamente 125 kJ/mol, mientras que en presencia de ureasa
la energía de activación se reduce a 46 kJ/mol.
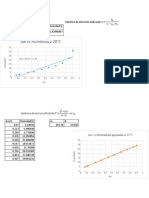
2. Esquematice la relación que existe entre Km, [S] y Vmáx
3. Las velocidades iniciales a varias concentraciones de sustrato para una reacción catalizada por
una enzima hipotética con:
[S] V
(moles/L) (moles Producto/min*mg proteína)
5x10-2 0.25
5x10-3 0.25
5x10-4 0.25
5x10-5 0.20
5x10-6 0.071
5x10-7 0.0096
a) Obtener los valores de los parámetros cinéticos KM y Vmáx, por el método gráfico de Michaelis-
Menten y el de dobles inversos.
b) Calcular el número de recambio o constante catalítica (kcat). Es la relación: mol de Producto
formado/mol de enzima por unidad de tiempo. Las unidades son seg-1.
Cambio y eliminación de unidades:
𝑚𝑚𝑜𝑙 𝑃𝑟𝑜𝑑𝑢𝑐𝑡𝑜 1000𝑚𝑔 𝑔 1𝑚𝑜𝑙 1 𝑚𝑖𝑛
𝑉𝑚á𝑥 [ ]∗ ∗ 𝑃𝑀𝑝𝑟𝑜𝑡𝑒í𝑛𝑎 𝑒𝑛 [ ]∗ ∗
𝑚𝑖𝑛 ∗ 𝑚𝑔𝑝𝑟𝑜𝑡𝑒í𝑛𝑎 1𝑔 𝑚𝑜𝑙 1000𝑚𝑚𝑜𝑙 60 𝑠𝑒𝑔
c) Calcular la eficiencia catalítica kcat/KM [seg-1M-1]
d) Por qué la Vo permanece constante a una [S] > 5x10-4 M
e) Calcula Vo para las [S] de 5x10-6 M y 5x10-1 M
4. La penicilasa es una enzima presente en algunas bacterias resistentes a la penicilina, la cual
hidrolizada a dicho compuesto inactivándola. El peso molecular de este enzima en Staphylococcus
aureus es de 29.6 kDa (29.6 g/mol). Se midió la cantidad de penicilina hidrolizada por minuto en
una solución que contiene 10-9 g de penicilasa purificada y los datos obtenidos se muestran a
continuación:
[Penicilina] moles Penicilina hidrolizada/min*mg proteína
M
0.1 x 10-5 0.1x10-9
0.3 x 10-5 0.25 x10-9
0.5 x 10-5 0.34 x10-9
1 x 10-5 0.45 x10-9
3 x 10-5 0.58 x10-9
5 x 10-5 0.61 x10-9
a) Obtener los valores de los parámetros cinéticos KM y Vmáx, emplenado los modelos
matemáticos de Michaelis-Menten y de dobles inversos.
b) Calcular el número de recambio (kcat)
c) Calcular la eficiencia catalítica (kcat/KM)
5. El silicato inhibe la acción catalítica de la glutamato deshidrogenasa. Determinar el tipo de
inhibición mediante el análisis gráfico de los siguientes datos, utilizando el grafico de Michaelis-
Menten y el de dobles inversos.
[S] mM mg Producto/min mg Producto/min
(sin silicato) (con silicato)
1.5 0.21 0.08
2.0 0.25 0.10
3.0 0.28 0.12
4.0 0.33 0.13
8.0 0.44 0.16
16.0 0.40 0.18
6. A partir de los siguientes datos de una reacción enzimática, determinar el tipo de inhibición, la
Km y la Ki, así como la Vmáx correspondiente.
[S] mM mg Producto/h mg Producto/min
(sin inhibidor) (con 6 mM de
inhibidor)
2.0 139 88
3.0 179 121
4.0 213 149
10.0 313 257
15.0 370 313
7. A partir de los siguientes datos de una reacción enzimática, determinar el tipo de inhibición.
Determinar la Km y Ki, así como la Vmáx correspondiente.
[S] M Vo (mol/min) Vo (mol/min)
1x10-5 sin inhibidor con inhibidor
0.3 10.4 2.1
0.5 14.5 2.9
1.0 22.5 4.5
3.0 33.8 6.8
9.0 40.5 8.1
Вам также может понравиться
- S3. Ejercicios KM y VmaxДокумент4 страницыS3. Ejercicios KM y VmaxKaren Tafur100% (1)
- Cultivos Semicontinuos - P2.3Документ19 страницCultivos Semicontinuos - P2.3Juan Carlos Sasintuña0% (1)
- Problemas3ab Ib2Документ4 страницыProblemas3ab Ib2chinis93Оценок пока нет
- Práctica 2 - Evaluacion - de - Tablas - de - PurificacionДокумент2 страницыPráctica 2 - Evaluacion - de - Tablas - de - PurificacionEdson DiazОценок пока нет
- Titulación Potenciométrica de PrecipitaciónДокумент8 страницTitulación Potenciométrica de PrecipitaciónIngrid MilagrosОценок пока нет
- Procedimiento de Viscosímetro de Oswald - DinalДокумент23 страницыProcedimiento de Viscosímetro de Oswald - DinalJhefry Othmad Manrique VasquezОценок пока нет
- Reacciones Orgánicas Tándem Expo 2Документ19 страницReacciones Orgánicas Tándem Expo 2Ktita CastroОценок пока нет
- Esterilizacion y BioseguridadДокумент3 страницыEsterilizacion y BioseguridadMaría Carolina RieraОценок пока нет
- Mohos y Levaduras Esta de Aki Es La Ordenada Mejorada 100porcierto RealДокумент9 страницMohos y Levaduras Esta de Aki Es La Ordenada Mejorada 100porcierto ReallolahОценок пока нет
- Tarea 3Документ2 страницыTarea 3Kagney UralesОценок пока нет
- Cinetica Quimica Yogur Andre Practica TerminadaДокумент18 страницCinetica Quimica Yogur Andre Practica TerminadaMARIA ISABEL ROMERO ESCOBAR100% (1)
- Prac 6Документ7 страницPrac 6Lina KimОценок пока нет
- Pro - Practica 5Документ6 страницPro - Practica 5Ronald BsaОценок пока нет
- Factores Quimiotacticos EndogenosДокумент9 страницFactores Quimiotacticos EndogenosDIEGO ALEJANDRO GARCIA RINCONОценок пока нет
- Biomineralización de HierroДокумент26 страницBiomineralización de Hierroadrin0% (1)
- Practica 01Документ5 страницPractica 01Anonymous BVBRzcE1t8Оценок пока нет
- CromatogramasДокумент47 страницCromatogramasJulian BarreraОценок пока нет
- CINÉTICA ENZIMÁTICA Ejercicios Estudiantes 2020-IIДокумент4 страницыCINÉTICA ENZIMÁTICA Ejercicios Estudiantes 2020-IIMichell E. TamayoОценок пока нет
- 12 Cinetica MicrobianaДокумент24 страницы12 Cinetica MicrobianaLalix LeeОценок пока нет
- Curva de Crecimiento de LevaduraДокумент6 страницCurva de Crecimiento de LevaduraRichar Efrain RFОценок пока нет
- Extracción Acido Base Por Formación de SalesДокумент3 страницыExtracción Acido Base Por Formación de SalesyeseniaОценок пока нет
- Prctica 5Документ6 страницPrctica 5angelОценок пока нет
- Problemas Cinetica Propuestos para El ExamenДокумент3 страницыProblemas Cinetica Propuestos para El ExamenBlas Alfaro StefanyОценок пока нет
- Parte 1:: Cinética de Crecimiento MicrobianoДокумент72 страницыParte 1:: Cinética de Crecimiento MicrobianoYandira Gutierrez MendozaОценок пока нет
- Muestreo en AlimentosДокумент20 страницMuestreo en AlimentosMiguel Angel O. FОценок пока нет
- Practica N 3Документ5 страницPractica N 3Sandra RestrepoОценок пока нет
- Práctica #5Документ2 страницыPráctica #5ingeneria biotecnologicaОценок пока нет
- Sacarificacion y Fermentacion de La Cascara de TunaДокумент107 страницSacarificacion y Fermentacion de La Cascara de TunaJhonyF80Оценок пока нет
- Práctica 2Документ7 страницPráctica 2ppchuy344Оценок пока нет
- Agar TsaДокумент4 страницыAgar TsaRaylan Bhfiach AirgidОценок пока нет
- GUÍA DE PRÁCTICA Curva de CrecimientoДокумент6 страницGUÍA DE PRÁCTICA Curva de CrecimientoHelena RomeroОценок пока нет
- E1P5L1013Документ14 страницE1P5L1013Monserrat Hernandez100% (1)
- Cultivo ContinuoДокумент4 страницыCultivo ContinuoDamnpapОценок пока нет
- Taller - Tercer Corte 2021-1Документ2 страницыTaller - Tercer Corte 2021-1KEYLA VANESSA MORALES RODRIGUEZ ESTUDIANTEОценок пока нет
- 4alm Equipo 7 3cmicro Investigación DocumentalДокумент7 страниц4alm Equipo 7 3cmicro Investigación DocumentalDulce Rubi García AlfonsoОценок пока нет
- Modelo de Monod La Curva de Crecimiento de Un OrganismoДокумент4 страницыModelo de Monod La Curva de Crecimiento de Un OrganismoLeoОценок пока нет
- Practica 7. - Efectos de Los Factores Físicos Sobre El Crecimientos de Los MicroorganismosДокумент6 страницPractica 7. - Efectos de Los Factores Físicos Sobre El Crecimientos de Los MicroorganismosAaron De JesusОценок пока нет
- Medios de FermentacionДокумент40 страницMedios de Fermentaciongerardozuk7Оценок пока нет
- Practica 8 Curva de CrecimientoДокумент4 страницыPractica 8 Curva de CrecimientolauraОценок пока нет
- Problema 27, 28 Y 29Документ23 страницыProblema 27, 28 Y 29Adrian VergaraОценок пока нет
- Crioscopia FiquiДокумент14 страницCrioscopia FiquiElion Vicente Fuentes RuizОценок пока нет
- Tabla de Absorbancias de Soluciones de Dicromato de PotasioДокумент1 страницаTabla de Absorbancias de Soluciones de Dicromato de PotasioRobert José Lobatón AlvarezОценок пока нет
- Previo 3 - CoprocultivoДокумент5 страницPrevio 3 - CoprocultivoMelissa GalanОценок пока нет
- Ejercicios Cinética 2Документ3 страницыEjercicios Cinética 2Mayra MoralesОценок пока нет
- Determinacion de Azucares Reductores Metodo DNSДокумент4 страницыDeterminacion de Azucares Reductores Metodo DNSJhonatanADОценок пока нет
- Técnicas Empleadas para La Conservación de MicrorganismosДокумент7 страницTécnicas Empleadas para La Conservación de MicrorganismosCarolina Campos PeraltaОценок пока нет
- Parametros BiológicosДокумент26 страницParametros BiológicosCamila Sanabria0% (1)
- Reporte de La Práctica 1. Control de CalidadДокумент7 страницReporte de La Práctica 1. Control de CalidadAndy Nieto100% (1)
- Extracción de Acído Acético Del VinagreДокумент4 страницыExtracción de Acído Acético Del VinagreSteven MancipeОценок пока нет
- Practica No - 7 Sintesis de BencildenacetofenonaДокумент2 страницыPractica No - 7 Sintesis de BencildenacetofenonaAmy GuillenОценок пока нет
- HEXOQUINASAДокумент13 страницHEXOQUINASAlauranoОценок пока нет
- Clase Practica 26Документ5 страницClase Practica 26Kenya SantacruzОценок пока нет
- Refractometria Expo!Документ12 страницRefractometria Expo!Gabriela VillegasОценок пока нет
- 3.2. Cinetica Del Consumo de SustratoДокумент11 страниц3.2. Cinetica Del Consumo de SustratoRomael Cespedes Durand100% (3)
- Obtencion de Acido CitricoДокумент62 страницыObtencion de Acido CitricoJose Antonio Cardenas Gamero100% (1)
- Cuestionario U3Документ3 страницыCuestionario U3Karla A. RodríguezОценок пока нет
- Volumetrias de Precipitacion (UNE)Документ22 страницыVolumetrias de Precipitacion (UNE)GERMÁN COLQUE YAIBONAОценок пока нет
- Micro Ind. Reporte 2Документ6 страницMicro Ind. Reporte 2FernandoVTОценок пока нет
- Trabajo de Cinética EnzimáticaДокумент4 страницыTrabajo de Cinética EnzimáticaRicardo SalazarОценок пока нет
- Jitorres - Problemas Enzimas 1Документ7 страницJitorres - Problemas Enzimas 1Juan MoralesОценок пока нет
- Separación TrabajadoДокумент1 страницаSeparación TrabajadoMarcos VeraОценок пока нет
- Etiologia Diagnostico Profilaxis y TrataДокумент6 страницEtiologia Diagnostico Profilaxis y TrataMarcos VeraОценок пока нет
- SGC - Proyecto Lab. Ciencias.Документ4 страницыSGC - Proyecto Lab. Ciencias.Marcos VeraОценок пока нет
- GranolaДокумент1 страницаGranolaMarcos VeraОценок пока нет
- El Licor de Crema Consiste en Una Bebida Con Un Alto Contenido de AzúcarДокумент1 страницаEl Licor de Crema Consiste en Una Bebida Con Un Alto Contenido de AzúcarMarcos VeraОценок пока нет
- Maria Suarez Diaz Propiedades Fisicas y QuimicasДокумент99 страницMaria Suarez Diaz Propiedades Fisicas y QuimicasedgarОценок пока нет
- Hoja de RespuestasДокумент1 страницаHoja de RespuestasMarcos VeraОценок пока нет
- Isotermas de Sorcion para ExamenДокумент7 страницIsotermas de Sorcion para ExamenMarcos VeraОценок пока нет
- Ev SensorialДокумент6 страницEv SensorialMarcos VeraОценок пока нет
- Ruminal Degradation of The Dry Matter of The CuajiДокумент9 страницRuminal Degradation of The Dry Matter of The CuajiMarcos VeraОценок пока нет
- Rinovirus - ¿Algo Más Que Un Resfrío Común - MedwaveДокумент10 страницRinovirus - ¿Algo Más Que Un Resfrío Común - MedwaveMarcos VeraОценок пока нет
- 2017 Prevencinde CatarrosrevistaelfarmacuticoДокумент6 страниц2017 Prevencinde CatarrosrevistaelfarmacuticoMarcos VeraОценок пока нет
- Curado de CarnesДокумент14 страницCurado de CarnesMarcos VeraОценок пока нет
- GranolaДокумент1 страницаGranolaMarcos VeraОценок пока нет
- Proyecto Final Hacpp Cafeteria Utm MarcosДокумент20 страницProyecto Final Hacpp Cafeteria Utm MarcosMarcos VeraОценок пока нет
- Trabajo de Investigacion Balance Score Card Marcos Efren Vera MendozaДокумент10 страницTrabajo de Investigacion Balance Score Card Marcos Efren Vera MendozaMarcos VeraОценок пока нет
- AlveogramaДокумент2 страницыAlveogramaMarcos VeraОценок пока нет
- Bioquimica Del MusculoДокумент34 страницыBioquimica Del MusculoMarcos VeraОценок пока нет
- Ahumado de CarnesДокумент4 страницыAhumado de CarnesMarcos VeraОценок пока нет
- Tarea 4Документ4 страницыTarea 4Marcos VeraОценок пока нет
- Berezi Parabenos PDFДокумент4 страницыBerezi Parabenos PDFMarcos VeraОценок пока нет
- Presentacion PROTOCOLO DE INVESTIGACION MARCOS EFRENДокумент19 страницPresentacion PROTOCOLO DE INVESTIGACION MARCOS EFRENMarcos VeraОценок пока нет
- Tesis-Implementacion HACCPДокумент266 страницTesis-Implementacion HACCPMomo Vs0% (1)
- Qué Son Los Métodos EmergentesДокумент3 страницыQué Son Los Métodos EmergentesMarcos VeraОценок пока нет
- Calendario Escolar UTM 2019-2020Документ1 страницаCalendario Escolar UTM 2019-2020Wilfrido Campechano AntonioОценок пока нет
- Envases 10 PDFДокумент31 страницаEnvases 10 PDFJahir RojasОценок пока нет
- AlveogramaДокумент2 страницыAlveogramaMarcos VeraОценок пока нет
- EJERCICIOS FQ Alimentos - Orden de ReaccionДокумент4 страницыEJERCICIOS FQ Alimentos - Orden de ReaccionMarcos VeraОценок пока нет
- 1Документ3 страницы1Marcos VeraОценок пока нет
- AlveogramaДокумент2 страницыAlveogramaMarcos VeraОценок пока нет
- Tabla de ToxicidadДокумент4 страницыTabla de Toxicidadraquel Ibarra lopezОценок пока нет
- Banco Preguntas MicrobiologiaДокумент26 страницBanco Preguntas MicrobiologiaJorge HipólitoОценок пока нет
- Taller 3 UNRN Hidrocarburos Estructura PropiedadesДокумент6 страницTaller 3 UNRN Hidrocarburos Estructura PropiedadesMore.e LopezОценок пока нет
- La Bruja NegraДокумент384 страницыLa Bruja NegraMantilla Fernando esteban88% (8)
- Anatomia Del Cuarto Ventriculo PDFДокумент5 страницAnatomia Del Cuarto Ventriculo PDFChristianОценок пока нет
- Vacuna BCGДокумент11 страницVacuna BCGEvelin RubОценок пока нет
- Piaget y La Psicología SuizaДокумент19 страницPiaget y La Psicología SuizaAnonymous w6coLSQyfu0% (1)
- Teorias Del CoДокумент3 страницыTeorias Del CoPabloSebastiánОценок пока нет
- Acondicionamiento de Gas IVДокумент23 страницыAcondicionamiento de Gas IVDavid Morales100% (1)
- Biogas A Partir de PollinazaДокумент15 страницBiogas A Partir de Pollinazaledatintaya100% (1)
- Guion Simulacro Octubre de 2018Документ5 страницGuion Simulacro Octubre de 2018juanОценок пока нет
- Trabajo de La ChefДокумент138 страницTrabajo de La ChefDiego Damian Castro FloresОценок пока нет
- Trabajo Práctico N° 2 Sucesiones 2do. Cuatrimestre 2022Документ3 страницыTrabajo Práctico N° 2 Sucesiones 2do. Cuatrimestre 2022Celeste AleОценок пока нет
- PMA-JUL-2022-13 Reubicacion de Material Esteril de Torre Babel-Tajo HerminiaДокумент18 страницPMA-JUL-2022-13 Reubicacion de Material Esteril de Torre Babel-Tajo HerminiajesseniaОценок пока нет
- Estrategia Nacional de Educación InclusivaДокумент3 страницыEstrategia Nacional de Educación InclusivaAlma Berenise Raposo ReyesОценок пока нет
- Barraje de Una SubestacionДокумент6 страницBarraje de Una SubestacionSteven V AnzuateguiОценок пока нет
- Perfil Complejo Nueva AlboradaДокумент91 страницаPerfil Complejo Nueva AlboradaJoseMiguelIzquierdoTapiaОценок пока нет
- Empobrecimiento de Tierras Agrícolas en Zonas Urbanas, Rurales y Su Relación Con La ContaminaciónДокумент10 страницEmpobrecimiento de Tierras Agrícolas en Zonas Urbanas, Rurales y Su Relación Con La Contaminaciónquimica1 equipo 450% (4)
- INVE 235-13 Azul de MétilenoДокумент10 страницINVE 235-13 Azul de MétilenoCarolina Diaz GОценок пока нет
- +evaluacion Multiaxial en DSM PDFДокумент1 страница+evaluacion Multiaxial en DSM PDFDanielaОценок пока нет
- Caso Clínico ColelitiasisДокумент29 страницCaso Clínico ColelitiasisAlejandro Sanchez100% (2)
- RCMДокумент2 страницыRCMaldo madueño cairoОценок пока нет
- Triptico Sobre Relieves PeruanosДокумент1 страницаTriptico Sobre Relieves PeruanosLucero Ascate LudeñaОценок пока нет
- Enfoque PsicométricoДокумент13 страницEnfoque PsicométricoSusan EvelinОценок пока нет
- Trabajo Grupal Sobre Deliberacion Del Uso de PlasticoДокумент2 страницыTrabajo Grupal Sobre Deliberacion Del Uso de PlasticoYunmi TuanamaОценок пока нет
- Estilos InteraccionalesДокумент28 страницEstilos InteraccionaleslaresponsableporsiemОценок пока нет
- Analisis de La Estrategia para La Reduccion de La Pobreza en GuatemalaДокумент20 страницAnalisis de La Estrategia para La Reduccion de La Pobreza en GuatemalaRuben PintoОценок пока нет
- Cartel Tipos de EnergiasДокумент1 страницаCartel Tipos de EnergiasYuki vxxjОценок пока нет
- Apuntes MicrobiologíaДокумент177 страницApuntes MicrobiologíaLean Duarte IbargurenОценок пока нет
- Reg. Capacitacion Uso de Chaleco SalvavidasДокумент1 страницаReg. Capacitacion Uso de Chaleco SalvavidasCristal KramОценок пока нет