Академический Документы
Профессиональный Документы
Культура Документы
Santillana Q11 Ficha de Trabalho Solucoes
Загружено:
Sonia CoelhoАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Santillana Q11 Ficha de Trabalho Solucoes
Загружено:
Sonia CoelhoАвторское право:
Доступные форматы
Parte
2
Fichas de trabalho
FICHa De traBaLHO N.° 5
1 Verdadeiras: a e e; falsas — B, C e D.
2 Opção C.
3 Opções B e C.
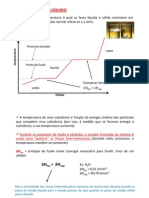
4 4.1 a dissolução deste sal é um processo endotérmico, porque à medida que a temperatura aumenta,
o valor da solubilidade também aumenta.
4.2 O ponto a indica que a solução está sobressaturada, porque o ponto está acima do valor da curva
de solubilidade para a temperatura aproximada de 20 °C.
4.3 O ponto B encontra-se sobre a curva de solubilidade, indicando que a solução está saturada
à temperatura de 40 °C.
4.4 a massa aproximada de sal que é possível dissolver à temperatura de 60 °C é 60 g, por leitura no
gráfico.
4.5 m = 30 - 12 = 18 g soluto
60 g soluto 120
4.6 = x + x = 200 g
100 g água
mágua = 200 g
94 QUÍMICA ENTRE NÓS • Física e Química A • Química • 11.o ano • Material fotocopiável • © Santillana
000731 088-096.indd 94 10/03/16 15:25
Parte
5 5.1 Para 50 °C, a solubilidade é 75 g de soluto em 100 g de água, ou seja, para 200 g (ou 200 mL), a massa
de soluto que é possível dissolver é 150 g. 2
a massa de sal depositado será: 400 g - 150 g = 250 g
Fichas de trabalho
5.2 Para a temperatura TII, não há precipitação, então, 400 g de soluto dissolvem-se em 200 mL de água,
ou então, 200 g de soluto dissolvem-se em 100 mL de água. Por leitura no gráfico, o valor de TII é 90 °C.
6 6.1 Pb3(SbO4)2(s) 3 Pb2+(aq) + 2 SbO3-
4 (aq)
6.2 Ks = (3s)3 # (2s)2 = (3s)3 # (2s)2 = 108s5
7 7.1 MgCO3(s) Mg2+(aq) + CO32-(aq)
2+
PbI2(s) Pb (aq) + 2 I-(aq)
7.2 M(MgCO3) = 84,32 g mol-1
m 5,3 # 10-2
n= &n= + n = 6,3 # 10-4 mol
M 84,32
n 6,3 # 10-4
s= &s= + s = 6,3 # 10-3 mol dm-3
V 0,1
7.3 Ks(MgCO3) = s $ s = s2 + Ks = 4,0 # 10-5
7.4 O sal mais solúvel é o carbonato de magnésio, porque tem um menor valor de solubilidade:
s (MgCO3) = 6,3 # 10-3 mol dm-3
Ks(PbI2) = s $ (2s)2 = 4s3 & 1,4 # 10-8 = 4s3 + s = 1,5 # 10-3 mol dm-3
4,2 # 10-3
8 8.1 [ag+] = = 2,1 # 10-3 mol dm-3
2
1,5 # 10-2
[SO2-
4 ]= = 7,5 # 10-3 mol dm-3
2
Q = [ag+]2 $ [SO2- -3 2
4 ] = (2,1 # 10 ) # 7,5 # 10
-3
= 3,3 # 10-8
Como Q < Ks não há formação de precipitado.
8.2 Ks = [ag+]2 $ [SO2-
4 ] & 1,4 # 10
-5
= [ag+]2 # 7,5 # 10-3 + [ag+] = 4,3 # 10-2 mol dm-3
9 9.1 Zn(C2O4)2(s) Zn2+(aq) + 2 C2O4-(aq)
9.2 a) a adição de uma solução aquosa concentrada de sulfato de zinco vai aumentar a concentração
do ião zinco e, por efeito do ião comum, o equilíbrio desloca-se no sentido inverso, diminuindo
a solubilidade do sal e, consequentemente, a sua precipitação.
b) a adição de uma solução aquosa concentrada de amoníaco origina a formação de um ião
complexo que faz diminuir a concentração do ião zinco em solução e, consequentemente,
desloca o equilíbrio no sentido direto, aumentando a solubilidade do sal.
10 Para eliminar as manchas de calcário do vidro de uma janela, pode utilizar-se agentes amaciadores que
vão dissolver os carbonatos, nomeadamente agentes de limpeza ácidos.
QUÍMICA ENTRE NÓS • Física e Química A • Química • 11.o ano • Material fotocopiável • © Santillana 95
000731 088-096.indd 95 10/03/16 15:25
Вам также может понравиться
- Manuscritos da Dança em Santa Maria/RS: História e MemóriaОт EverandManuscritos da Dança em Santa Maria/RS: História e MemóriaОценок пока нет
- qr11 02 Teste Aval 1 sd1 EnunciadoДокумент5 страницqr11 02 Teste Aval 1 sd1 EnunciadoMargarida CavacoОценок пока нет
- Ae Fqa11 Quimica11 em RevistaДокумент36 страницAe Fqa11 Quimica11 em RevistaMariliaPacОценок пока нет
- Aef11 Teste Ava 3Документ7 страницAef11 Teste Ava 3Sandra SilvestreОценок пока нет
- Solução Questão de AulaДокумент3 страницыSolução Questão de AulaSandra AndradeОценок пока нет
- Santillana - Q11 - Ficha de Avaliacao 3Документ5 страницSantillana - Q11 - Ficha de Avaliacao 3Luísa CarmoОценок пока нет
- 11Q - NL - (Teste 1) - 02 - 2022Документ7 страниц11Q - NL - (Teste 1) - 02 - 2022catarinaОценок пока нет
- 11Q Ficha - Trabalho3 SantillanaДокумент4 страницы11Q Ficha - Trabalho3 SantillanaLuís PedroОценок пока нет
- Ae q11 Prova Global1 v2Документ9 страницAe q11 Prova Global1 v2testeОценок пока нет
- Ficha Trabalho2Документ4 страницыFicha Trabalho2Carla GóisОценок пока нет
- Aequi1015 Ques Aulalab 2Документ3 страницыAequi1015 Ques Aulalab 2Teresa Freitas100% (1)
- Energia e Fenómenos EletricosДокумент4 страницыEnergia e Fenómenos EletricosCristiana PimentaОценок пока нет
- TEXTO 10F Teste3Документ4 страницыTEXTO 10F Teste3smcantunes7956Оценок пока нет
- Novo 11Q NL (Teste1) Fev.2020Документ9 страницNovo 11Q NL (Teste1) Fev.2020Maria Inês DominguesОценок пока нет
- Ae - rq11 - Teste5 - Abr2023 - EnuncДокумент8 страницAe - rq11 - Teste5 - Abr2023 - EnuncJuliana NóbregaОценок пока нет
- Ae q11 Fich Form 1Документ5 страницAe q11 Fich Form 1Ana Raquel PintoОценок пока нет
- 02 - Teste - Avaliacao - q10 - d2 - sd1 Ligações QuimicaДокумент5 страниц02 - Teste - Avaliacao - q10 - d2 - sd1 Ligações QuimicaElsa Viana BaptistaОценок пока нет
- Ae q11 Teste Ava 1Документ6 страницAe q11 Teste Ava 1Verónica MartinsОценок пока нет
- Teste 3 (2016)Документ4 страницыTeste 3 (2016)anaОценок пока нет
- Exame FQ11 Prova-Modelo 5Документ7 страницExame FQ11 Prova-Modelo 5Orlando Meireles0% (1)
- Biogeo11!20!21 Teste1 SolucaoДокумент2 страницыBiogeo11!20!21 Teste1 Solucaogermano machadoОценок пока нет
- 3 Ae rf11 Teste em 2Документ8 страниц3 Ae rf11 Teste em 2Rodrigo VazОценок пока нет
- Hqen11 Questoes Exame d1 sd1 PDFДокумент6 страницHqen11 Questoes Exame d1 sd1 PDFTania FernandesОценок пока нет
- 2019 2020 Eq11 02 Ficha Equilibrio Quimico v1Документ9 страниц2019 2020 Eq11 02 Ficha Equilibrio Quimico v1marianaОценок пока нет
- Novo 11Q NL (Teste2 CC) Abr.2019Документ3 страницыNovo 11Q NL (Teste2 CC) Abr.2019Rui SantosОценок пока нет
- Teste1 11ºДокумент9 страницTeste1 11ºbeterraba roxaОценок пока нет
- Eq11 Cadlab GP TG AlДокумент3 страницыEq11 Cadlab GP TG AlBeatriz DraiblateОценок пока нет
- Ae rq11 Qlab 1Документ2 страницыAe rq11 Qlab 1ana100% (1)
- A.Pnº10 Coelhos - EvolucionismoДокумент3 страницыA.Pnº10 Coelhos - EvolucionismosusanajpОценок пока нет
- 4teste - 11º Ano V1-1101 VFFДокумент6 страниц4teste - 11º Ano V1-1101 VFFSofia DiasОценок пока нет
- Teste N.º7Документ6 страницTeste N.º7Tania FernandesОценок пока нет
- Teste OndasДокумент3 страницыTeste OndasBeatriz MendonçaОценок пока нет
- Al 1Документ23 страницыAl 1Sara Raquel Costa PintoОценок пока нет
- Prova - Modelo 1 FISДокумент12 страницProva - Modelo 1 FISmmpgarciaОценок пока нет
- Fisica e Quimica Exercicios PDFДокумент380 страницFisica e Quimica Exercicios PDFPedro SilvaОценок пока нет
- Texto Editora - Teste 1 (2023) - QuímicaДокумент6 страницTexto Editora - Teste 1 (2023) - QuímicaLuis VarelaОценок пока нет
- Novo 11Q NL (Teste3) Maio2021Документ8 страницNovo 11Q NL (Teste3) Maio2021Ana Paula CristóvãoОценок пока нет
- Fisica - AL 1 1Документ3 страницыFisica - AL 1 1simoes_sandraОценок пока нет
- Novo 10F NL (Teste2) Maio2021Документ3 страницыNovo 10F NL (Teste2) Maio2021teresaОценок пока нет
- Novo 11Q NL (Teste2) Maio2021Документ6 страницNovo 11Q NL (Teste2) Maio2021teresaОценок пока нет
- Ficha 1 Energia e MovimentosДокумент11 страницFicha 1 Energia e MovimentosalunaОценок пока нет
- Fa11 Aval Mecanica Teste Avaliacao 2Документ8 страницFa11 Aval Mecanica Teste Avaliacao 2CARLA LUCIANA SOARES PEREIRA DOS REISОценок пока нет
- Aef11 Teste Ava 3Документ7 страницAef11 Teste Ava 3Beatriz SilvaОценок пока нет
- 11f NL (Teste1 CC)Документ3 страницы11f NL (Teste1 CC)Catarina AlmeidaОценок пока нет
- 02 Eq11 Teste Global v1Документ10 страниц02 Eq11 Teste Global v1Elsa Viana BaptistaОценок пока нет
- Teste 4 Eq11 - Equilibrio - Quimico PE 2022Документ9 страницTeste 4 Eq11 - Equilibrio - Quimico PE 2022Guilherme CunhaОценок пока нет
- Teste-1 11o 19-20 V1Документ5 страницTeste-1 11o 19-20 V1Ana 2005Оценок пока нет
- Fq10a BQ 00010Документ6 страницFq10a BQ 00010Maria DuarteОценок пока нет
- AL 2.2 e 2.3 - Soluções A Partir de Solutos Sólidos e Diluição de SoluçõesДокумент5 страницAL 2.2 e 2.3 - Soluções A Partir de Solutos Sólidos e Diluição de SoluçõesZélia CoelhoОценок пока нет
- todasALfisica PDFДокумент75 страницtodasALfisica PDFEstuda mais por menos100% (1)
- Ae rq11 Teste 3Документ7 страницAe rq11 Teste 3Al. Salomé CamochoОценок пока нет
- Eq11 - Dossie - Prof - Teste - Aval - 2 - CópiaДокумент5 страницEq11 - Dossie - Prof - Teste - Aval - 2 - CópiaClaudia QueirosОценок пока нет
- Qa f1Документ8 страницQa f1SreginadОценок пока нет
- Ficha Formativa BiologiaДокумент6 страницFicha Formativa BiologiaJoão FaroОценок пока нет
- Novo 11Q NL (Teste2) Maio2021Документ7 страницNovo 11Q NL (Teste2) Maio2021Sofia CarvalhoОценок пока нет
- FT Fisica Rev Unidade2 10Документ4 страницыFT Fisica Rev Unidade2 10Adriana BemstarОценок пока нет
- Ae q11 Fich Form 1Документ5 страницAe q11 Fich Form 1carla50% (2)
- Lista Kps - RODRIGO GABRIELДокумент10 страницLista Kps - RODRIGO GABRIELRodrigo Gabriel BastosОценок пока нет
- Ficha Trabalho 10Документ2 страницыFicha Trabalho 10cxrreiafnОценок пока нет
- Julia Serrano - Exercicio - Hidgq2021 - Lote1Документ3 страницыJulia Serrano - Exercicio - Hidgq2021 - Lote1Felipe TorresОценок пока нет
- Apoio Às Atividades Laboratoriais - AL1.1 Movimento Num Plano InclinadoДокумент9 страницApoio Às Atividades Laboratoriais - AL1.1 Movimento Num Plano InclinadoSonia CoelhoОценок пока нет
- Apoio Às Atividades Laboratoriais - AL 3.2 Capacidade Térmica MássicaДокумент9 страницApoio Às Atividades Laboratoriais - AL 3.2 Capacidade Térmica MássicaSonia Coelho100% (1)
- Apoio Às Atividades Laboratoriais - AL 2.1 Características de Uma PilhaДокумент5 страницApoio Às Atividades Laboratoriais - AL 2.1 Características de Uma PilhaSonia CoelhoОценок пока нет
- Apoio Às Atividades Laboratoriais - AL 3.3 Balanço Energético Num Sistema TermodinâmicoДокумент5 страницApoio Às Atividades Laboratoriais - AL 3.3 Balanço Energético Num Sistema TermodinâmicoSonia CoelhoОценок пока нет
- Ficha de Autoavaliação - Física e Química A - Secundário 22-23Документ2 страницыFicha de Autoavaliação - Física e Química A - Secundário 22-23Sonia CoelhoОценок пока нет
- Novo 11Q NL (Teste2 CC) Abr.2019Документ4 страницыNovo 11Q NL (Teste2 CC) Abr.2019Sonia CoelhoОценок пока нет
- Recur SoДокумент18 страницRecur SoSonia CoelhoОценок пока нет
- MatematicaB 11 Aula 9 18maioДокумент11 страницMatematicaB 11 Aula 9 18maioSonia CoelhoОценок пока нет
- AL 1.3 - Densidade RelativaДокумент3 страницыAL 1.3 - Densidade RelativaSonia CoelhoОценок пока нет
- Porto Editora - Novo Espaco - 12 Ano 2017-18 - 1 TesteДокумент12 страницPorto Editora - Novo Espaco - 12 Ano 2017-18 - 1 TesteSonia CoelhoОценок пока нет
- Santillana Q11 Criterios de Correcao Da Ficha de Avaliacao 3Документ2 страницыSantillana Q11 Criterios de Correcao Da Ficha de Avaliacao 3Sonia CoelhoОценок пока нет
- ACFrOgAGSJA4kV 0F6Rvt-t-1qhB4naKZFRmeO4Shcw5G2DKH0njnIShMG6qJByuFJp5RLBeP29 XnFLUQIm5z2Hm7QXNJaGHvT qsSJg4dL2YKTBExyA4cPGVEZFxiBz1FnXIVtbAKOdQj2PwrDДокумент10 страницACFrOgAGSJA4kV 0F6Rvt-t-1qhB4naKZFRmeO4Shcw5G2DKH0njnIShMG6qJByuFJp5RLBeP29 XnFLUQIm5z2Hm7QXNJaGHvT qsSJg4dL2YKTBExyA4cPGVEZFxiBz1FnXIVtbAKOdQj2PwrDSonia CoelhoОценок пока нет
- Matematica B 11 Aula 10 19maioДокумент10 страницMatematica B 11 Aula 10 19maioSonia CoelhoОценок пока нет
- Matematica B 11 Aula 1 20abrilДокумент6 страницMatematica B 11 Aula 1 20abrilSonia CoelhoОценок пока нет
- Matematica B 11 Aula 8 12maioДокумент9 страницMatematica B 11 Aula 8 12maioSonia CoelhoОценок пока нет
- Santillana Q11 Ficha de Avaliacao 3Документ3 страницыSantillana Q11 Ficha de Avaliacao 3Sonia CoelhoОценок пока нет
- ImpuklsaoДокумент16 страницImpuklsaoSonia CoelhoОценок пока нет
- Teste3 - 2P - 7ºanoДокумент10 страницTeste3 - 2P - 7ºanoSonia CoelhoОценок пока нет
- FICHA SucessoesДокумент8 страницFICHA SucessoesSonia CoelhoОценок пока нет
- Ae Macs1015 Gti84 P 207Документ7 страницAe Macs1015 Gti84 P 207Sonia CoelhoОценок пока нет
- FichasДокумент7 страницFichasSonia Coelho100% (1)
- Propriedades Coligativas - AtividadeДокумент1 страницаPropriedades Coligativas - AtividadeÉrica LeticiaОценок пока нет
- 2ano Diluicao de SolucoesДокумент16 страниц2ano Diluicao de Solucoesmarcos rodriguesОценок пока нет
- Termodinâmica Das Misturas SimplesДокумент44 страницыTermodinâmica Das Misturas SimplesHenrique WallançuellaОценок пока нет
- ROTEIRO 5 - Cristalizacao FracionadaДокумент6 страницROTEIRO 5 - Cristalizacao FracionadaAlessandro MartinsОценок пока нет
- Aula 1 - FF LíquidasДокумент34 страницыAula 1 - FF LíquidasJoab Ana MenezesОценок пока нет
- Atualização Calculo MedicaçãoДокумент9 страницAtualização Calculo MedicaçãoLeiliane S. VieiraОценок пока нет
- Trabalho de Química - Aluna Olga 2 AДокумент1 страницаTrabalho de Química - Aluna Olga 2 AHaroldo BertrandОценок пока нет
- Relatorio de Solubilidade de Sais InorgânicosДокумент6 страницRelatorio de Solubilidade de Sais InorgânicosAderson Rafael100% (1)
- SOLUÇÕES - Concentração de Soluções - NovoДокумент69 страницSOLUÇÕES - Concentração de Soluções - Novovictor.costa1Оценок пока нет
- Quimica 18Документ29 страницQuimica 18ascatanho100% (1)
- Exercicios ExtracaoДокумент3 страницыExercicios ExtracaoJeferson Dias100% (1)
- Pratica 06 PDFДокумент2 страницыPratica 06 PDFJoel SamuelОценок пока нет
- QGI - Relatório 5 - Coeficiente de Partição Octanol-Água Do Violeta de GencianaДокумент6 страницQGI - Relatório 5 - Coeficiente de Partição Octanol-Água Do Violeta de GencianaLuisa BiaОценок пока нет
- Fisico Química 7º AnoДокумент4 страницыFisico Química 7º AnoAna Rita Valente Valente100% (1)
- Curvasde SolubilidadeДокумент2 страницыCurvasde SolubilidadeMarcos AurelioОценок пока нет
- Realtorio 2 de Fisico Quimica MiscibilidadeДокумент5 страницRealtorio 2 de Fisico Quimica MiscibilidadeCarolina StrunkisОценок пока нет
- Parâmetros FQ No Desenvolvimento de Medicamentos - SolubilidadeДокумент66 страницParâmetros FQ No Desenvolvimento de Medicamentos - SolubilidadeGeorge GualterОценок пока нет
- Aula 1 - Formas Farmacêuticas LiquidasДокумент22 страницыAula 1 - Formas Farmacêuticas LiquidasExpedito Junior50% (2)
- Soluções-Definições (Net)Документ32 страницыSoluções-Definições (Net)Ricardo AlvesОценок пока нет
- Química RG - SoluçõesДокумент5 страницQuímica RG - SoluçõesQuimica Passei100% (2)
- Relatório 3 - Propriedades ColigativasДокумент13 страницRelatório 3 - Propriedades ColigativasTayane GaruzziОценок пока нет
- QuimicaДокумент4 страницыQuimicaAntonio EduardoОценок пока нет
- Relatório..solubilidade ProntoДокумент14 страницRelatório..solubilidade ProntoGuilherme LimaОценок пока нет
- Memorex Quimica - Solucoes IДокумент1 страницаMemorex Quimica - Solucoes Icon_seguirОценок пока нет
- Relatório Aula 01Документ5 страницRelatório Aula 01Matheus PaivaОценок пока нет
- Ficha de Trabalho - Composição de SoluçõesДокумент3 страницыFicha de Trabalho - Composição de Soluçõessusana vieiraОценок пока нет
- Lista de Exercícios 5 PDFДокумент2 страницыLista de Exercícios 5 PDFBruno Felipe BothОценок пока нет
- Exercicio ConcentraçãoДокумент1 страницаExercicio Concentraçãopedro NetoОценок пока нет
- Fração Molar e MolalidadeДокумент2 страницыFração Molar e MolalidadeMouraci Ribeiro0% (1)
- Mais ExercíciosДокумент1 страницаMais ExercíciosJéssica LealОценок пока нет