Академический Документы
Профессиональный Документы
Культура Документы
Resistencia A Antibioticos
Загружено:
Aresth GV0 оценок0% нашли этот документ полезным (0 голосов)
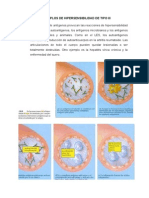
7 просмотров2 страницыLa reducción de la susceptibilidad de un microorganismo frente a drogas antimicrobianas puede originarse por mutaciones a nivel genómico que implican la síntesis de una proteína (diana para la droga), con reducida afinidad por el antimicrobiano en cuestión, este tipo de resistencia se puede trasmitir verticalmente a su descendencia.
Оригинальное название
resistencia-a-antibioticos
Авторское право
© © All Rights Reserved
Доступные форматы
DOCX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документLa reducción de la susceptibilidad de un microorganismo frente a drogas antimicrobianas puede originarse por mutaciones a nivel genómico que implican la síntesis de una proteína (diana para la droga), con reducida afinidad por el antimicrobiano en cuestión, este tipo de resistencia se puede trasmitir verticalmente a su descendencia.
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
7 просмотров2 страницыResistencia A Antibioticos
Загружено:
Aresth GVLa reducción de la susceptibilidad de un microorganismo frente a drogas antimicrobianas puede originarse por mutaciones a nivel genómico que implican la síntesis de una proteína (diana para la droga), con reducida afinidad por el antimicrobiano en cuestión, este tipo de resistencia se puede trasmitir verticalmente a su descendencia.
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате DOCX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 2
La reducción de la susceptibilidad de un microorganismo frente a drogas
antimicrobianas puede originarse por mutaciones a nivel genómico que implican la
síntesis de una proteína (diana para la droga), con reducida afinidad por el
antimicrobiano en cuestión, este tipo de resistencia se puede trasmitir
verticalmente a su descendencia. La transmisión de la resistencia puede también
ocurrir horizontalmente, en este caso el microorganismo adquiere material
genético que porta información para la síntesis de dianas no susceptibles. Existen
diversos mecanismos que explican este fenómeno, y, por ejemplo, en el S.
pneumoniae tiene gran importancia el conocido como transformación, que
consiste en la adquisición de genes que provienen de bacterias que han sufrido
bacteriólisis, las bacterias donadoras pueden ser incluso de otra especie, como S.
viridans, o S. mitis. Una vez incorporados estos fragmentos de ADN, se
recombinan con el genoma de la bacteria aceptora, adquiriendo un fenotipo
resistente (Noda Albelo; et 2011)
En S. pyogenes se describen dos mecanismos de resistencia a macrólidos:
modificación del sitio de sitio blanco y eflujo activo Modificación del sitio blanco
Este mecanismo se produce por la adquisición de un gen erm (erythromycin
ribosome methylase) que codifica una enzima que N_dimetila un residuo
específico de adenina en el 23SrARN, produciendo un cambio conformacional en
el ribosoma que disminuye la afinidad a macrólidos, lincosamidas y streptogramina
B, fármacos químicamente distintos pero con similar mecanismo y sitio de acción.
Eflujo activo. Este mecanismo se produce por la presencia de un gen mef
(macrolide efflux) que codifica la síntesis de una bomba que media el eflujo en
forma activa. Este eflujo activo sólo confiere resistencia a macrólidos por lo que se
conoce como resistencia fenotípica M. Es el mecanismo de resistencia más
frecuentemente descrito en S. pyogenes, lo que concuerda también con lo
encontrado en cepas chilenas, ya que de las 29 cepas resistentes aisladas en el
Laboratorio Integramédica 27 (93,1%) correspondían a este fenotipo y de las 32
cepas resistentes aisladas en Laboratorio Clínico de la Pontificia Universidad
Católica 28 (87,5%), correspondían a este fenotipo detectándose en ellas la
presencia del gen mef mediante amplificación con RPC (Camponovo C.,2002)
El marco estructural básico de la pared celular de los Streptococcus B hemolíticos
es la capa de peptidoglucano, la cual tiene una composición parecida a la de otras
bacterias grampositivas. En el interior de la pared celular se encuentran los
antígenos específicos de grupo y de tipo. El carbohidrato específico de grupo, el
cual constituye aproximadamente el 10% del peso seco de la célula (antígeno del
grupo A de Lancefield), es un dímero de N-acetilglucosamina y de ramosa. Este
antígeno se usa para clasificar a los estreptococos del grupo A y distinguirlos de
otros grupos de estreptococos. La proteína M es la principal proteína específica de
tipo que se asocia a los estreptococos virulentos. Se compone de dos cadenas
polipeptídicas que forman una hélice alfa. La proteína se ancla a la membrana
citoplásmica, se extiende a través de la pared celular y sobresale por encima de la
superficie celular Otros componentes importantes de la pared celular de S.
pyogenes son las proteínas de tipo M, el ácido lipoteicoico y la proteína F. Las
proteínas de tipo M están codificadas por un complejo de más de 20 genes que
componen la superfamilia de genes emm. Las proteínas de tipo M y otras
proteínas que se unen a las inmunoglobulinas (Ig). El ácido lipoteicoico y la
proteína F facilitan la unión a las células del hospedador, al formar un complejo
con la fibronectina que se encuentra presente en la superficie de las células del
hospedador. Algunas cepas de S. pyogenes tienen una cápsula externa de ácido
hialurónico, que no se diferencia a nivel antigénico del ácido hialurónico presente
en los tejidos conjuntivos de mamífero. Dado que la cápsula puede proteger a la
bacteria de la fagocitosis, las cepas encapsuladas son las responsables más
probables de las infecciones sistémicas graves (Jawetz 2014)
Вам также может понравиться
- Practica 04 - ABOДокумент8 страницPractica 04 - ABOAresth GVОценок пока нет
- Metabolismo EnergeticoДокумент8 страницMetabolismo EnergeticoAresth GVОценок пока нет
- Artículo Científico. Acosta Quiroz Johana Del Milagros, Verástegui Gaona Carmen Esther.Документ13 страницArtículo Científico. Acosta Quiroz Johana Del Milagros, Verástegui Gaona Carmen Esther.Aresth GVОценок пока нет
- Definicion de AuditoriaДокумент25 страницDefinicion de AuditoriaAresth GVОценок пока нет
- Riquezas Culturales de La SierraДокумент19 страницRiquezas Culturales de La SierraAresth GV0% (1)
- Clases de AnticuerposДокумент7 страницClases de AnticuerposAresth GVОценок пока нет
- Lactobacillus y sus característicasДокумент19 страницLactobacillus y sus característicasAresth GV100% (1)
- Nematodos en RatasДокумент8 страницNematodos en RatasAresth GVОценок пока нет
- Familia SpirochaetaceaeДокумент15 страницFamilia SpirochaetaceaeAresth GV0% (1)
- SociologiaДокумент3 страницыSociologiaAresth GVОценок пока нет
- Fundamentos Del Control de Los MicroorganismosДокумент5 страницFundamentos Del Control de Los MicroorganismosAresth GV100% (2)
- Clases de AnticuerposДокумент7 страницClases de AnticuerposAresth GVОценок пока нет
- Traducción Del Trabajo Original de Watson y CrickДокумент5 страницTraducción Del Trabajo Original de Watson y CrickAresth GVОценок пока нет
- Gráficos BidimensionalesДокумент2 страницыGráficos BidimensionalesAresth GVОценок пока нет
- Mitosis PracticaДокумент9 страницMitosis PracticaAresth GVОценок пока нет
- Tipos de Radiacion IonizanteДокумент31 страницаTipos de Radiacion IonizanteAresth GVОценок пока нет
- Esther RRДокумент6 страницEsther RRAresth GVОценок пока нет
- Normas Generales de Trabajo en El LaboratorioДокумент6 страницNormas Generales de Trabajo en El LaboratorioAresth GVОценок пока нет
- Cruces Monohibridos Entre Variedades Mutadas y Silvestres de Drosophila Melanogaster Con El Fin de Coroborar La Primera y Segunda Ley DДокумент6 страницCruces Monohibridos Entre Variedades Mutadas y Silvestres de Drosophila Melanogaster Con El Fin de Coroborar La Primera y Segunda Ley DAresth GVОценок пока нет
- Linea de Tiempo - EstherДокумент1 страницаLinea de Tiempo - EstherAresth GVОценок пока нет
- Trabajo de EcologiaДокумент8 страницTrabajo de EcologiaAresth GVОценок пока нет
- Capitulo IIДокумент12 страницCapitulo IIAresth GV0% (1)
- Trabajo Practico de MicroalgasДокумент63 страницыTrabajo Practico de MicroalgasAresth GVОценок пока нет
- Segundo TrabajoДокумент5 страницSegundo TrabajoAresth GVОценок пока нет
- Microeconomía I: Ejercicios resueltos de teoría del consumidor y optimizaciónДокумент32 страницыMicroeconomía I: Ejercicios resueltos de teoría del consumidor y optimizaciónDavid Espinosa100% (2)
- HHHH HMMMMДокумент63 страницыHHHH HMMMMAresth GVОценок пока нет
- GGGGДокумент1 страницаGGGGAresth GVОценок пока нет
- Ejercicios de Distribucion de Poisson ResueltosДокумент3 страницыEjercicios de Distribucion de Poisson ResueltosAresth GVОценок пока нет
- Locomoción JohanaДокумент4 страницыLocomoción JohanaAresth GVОценок пока нет
- Salud y EnfermedadДокумент5 страницSalud y EnfermedadEfrain MoronОценок пока нет
- Atributos Del Espíritu SantoДокумент4 страницыAtributos Del Espíritu SantoJose Fernando PavaОценок пока нет
- Renato Ripa, Pilar Lara, Fernando Rodríguez, Sergio Rojas - Guía de Campo Plagas de Cítricos y Sus Enemigos Naturales (2002)Документ119 страницRenato Ripa, Pilar Lara, Fernando Rodríguez, Sergio Rojas - Guía de Campo Plagas de Cítricos y Sus Enemigos Naturales (2002)Cesar GallardoОценок пока нет
- Bitcoins, DMT y Extraterrestres PDFДокумент6 страницBitcoins, DMT y Extraterrestres PDFgonflynnОценок пока нет
- La Marihuana y La EspiritualidadДокумент1 страницаLa Marihuana y La EspiritualidadBruno MontoyaОценок пока нет
- El auge y declive del Boom latinoamericanoДокумент31 страницаEl auge y declive del Boom latinoamericanoFernanda Alejandrez100% (1)
- Factsheet 71 - Introduccion A Los Trastornos Musculoesqueleticos de Origen LaboralДокумент2 страницыFactsheet 71 - Introduccion A Los Trastornos Musculoesqueleticos de Origen LaboralWesly Mattos RamirezОценок пока нет
- Matematica TareaДокумент4 страницыMatematica TareaSarumi Garcia100% (1)
- Barroco NovohispanoДокумент4 страницыBarroco NovohispanoDanny CallahanОценок пока нет
- Ovo Encuesta A Padres. ResumenДокумент18 страницOvo Encuesta A Padres. ResumenpaulaОценок пока нет
- Ensayo Salud ComunitariaДокумент3 страницыEnsayo Salud ComunitariaSamantha OtavaloОценок пока нет
- Infografia Francisco VillaДокумент1 страницаInfografia Francisco VillaLopez Aguilar Jose Luis 3FОценок пока нет
- Informe 1Документ3 страницыInforme 1maria teresa cutter mitaОценок пока нет
- Enfermedad Trofoblastica GestacionalДокумент34 страницыEnfermedad Trofoblastica GestacionalBrandon Julio Agreda SejasОценок пока нет
- Mar y TierraДокумент8 страницMar y TierraDannyLeoCJОценок пока нет
- Trabajo Final ContabilidadДокумент10 страницTrabajo Final ContabilidadMaridania GilОценок пока нет
- Método de ProyectosДокумент107 страницMétodo de ProyectosCarmen EspinoОценок пока нет
- UNA AUSENCIA PRESENTE La Otra Paradoja Del ComedianteДокумент59 страницUNA AUSENCIA PRESENTE La Otra Paradoja Del ComedianteMarc Georges KleinОценок пока нет
- Genero Dramático Pedro de Valdivia PDFДокумент23 страницыGenero Dramático Pedro de Valdivia PDFCepita Tapice Piceta100% (1)
- Castro Mariana R2 U1Документ6 страницCastro Mariana R2 U1Mariana CastroОценок пока нет
- 3oESO 17 18 TEMA 13 FICHA 16 RESUELTA 1527086582Документ1 страница3oESO 17 18 TEMA 13 FICHA 16 RESUELTA 1527086582Bruce Picón DávilaОценок пока нет
- Examen PlaguicidasДокумент21 страницаExamen Plaguicidasantonio70% (10)
- Folleto - Nutricion InfantilДокумент2 страницыFolleto - Nutricion InfantilveronicaОценок пока нет
- FOA para Fibra Óptica - Insensibles Al Doblado de La FibraДокумент6 страницFOA para Fibra Óptica - Insensibles Al Doblado de La FibraSergio SanchezОценок пока нет
- Psicologia Humanista-Situacion ActualДокумент16 страницPsicologia Humanista-Situacion ActualMarycarmen Lozano CarhuatantaОценок пока нет
- POR QUE PREGUNTARSE POR EL DERECHOДокумент15 страницPOR QUE PREGUNTARSE POR EL DERECHODavid Molinero MartinezОценок пока нет
- Indicadores de Desempeño Naturaleza, Utilidad y Co... - (PG 5 - 8)Документ4 страницыIndicadores de Desempeño Naturaleza, Utilidad y Co... - (PG 5 - 8)ivan tapiaОценок пока нет
- Ana y MartinДокумент2 страницыAna y MartinJhon Freddy MenaОценок пока нет
- DurezaДокумент13 страницDurezasusanОценок пока нет
- CEAL-Mdulo 2Документ38 страницCEAL-Mdulo 2Alvaro SkittehrОценок пока нет