Академический Документы
Профессиональный Документы
Культура Документы
Ejercicio 4 - Punto 4.1
Загружено:
leidy MarcelaОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Ejercicio 4 - Punto 4.1
Загружено:
leidy MarcelaАвторское право:
Доступные форматы
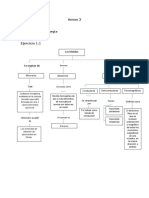
Ejercicio 4.
Historia de la mecánica cuántica
Punto 4.1
Científico Ecuación y explicación
Fecha Aporte teórico
de la ecuación
Descubrió una constante
fundamental, la
denominada constante
de Planck, usada para
calcular la energía de un
fotón. Esto significa que
Máx Planck 1900 la radiación no puede ser E=h . f
emitida ni absorbida de
forma continua, sino
solo en determinados
momentos y pequeñas
cantidades denominadas
cuantos o fotones
Niels Bohr, publica su
modelo atómico Primer postulado
manejando la teoría de Z e 2 me v
2
las órbitas cuantificadas, k 2 =
r r
que en la teoría
mecánica cuántica
Niels Bohr consiste en las Segundo postulado
1913 h
características que, en L=me vr =n
torno al núcleo atómico, 2π
el número de electrones
en cada órbita aumenta Tercer postulado
E γ=hv=En −E n
desde el interior hacia el f i
exterior.
La dualidad onda-
corpúsculo, también
llamada dualidad onda-
partícula es un
fenómeno cuántico, bien
comprobado
empíricamente, por el
cual muchas partículas h
Louis De Broglie 1924 pueden exhibir λ=
p
comportamientos típicos
de ondas en unos
experimentos mientras
aparecen como
partículas compactas y
localizadas en otros
experimentos
Wolfang Pauli 1925 Dos electrones en un Ψ =Ψ 1 ( a ) Ψ 2 ( b )+ ¿−Ψ 1 (b)Ψ 2 (a)
átomo no pueden tener
idéntico número
cuántico.
Wolfang Pauli, formula
el principio de exclusión
El principio de
incertidumbre de
Heisenberg nos dice que h
es imposible determinar
Werner Heisenberg 1927 2π
la velocidad y la σ x σ p≥
2
posición de un electrón
al mismo tiempo en un
instante determinado.
Postulo un modelo
cuántico no relativista.
En este modelo los
electrones se
contemplaban
originalmente como una
onda estacionaria de i h ∂ Ψ ( r , t )= H
^ Ψ ( r ,t )
Erwin Scrödinger 1926
materia cuya amplitud 2 π ∂t
decaía rápidamente al
sobrepasar el radio
atómico y donde la zona
deprobabilidad de
encontrar un electrón se
llama orbital.
Las contribuciones de
Pauling fueron
sumamente útiles para
explicar la organización
orbital de los electrones
de los átomos, así como
también desarrollar el
Linus Pauling 1940
conocimiento sobre los
enlaces iónicos, en los
que se transfieren los
electrones desde un
átomo hacia otro.
Paul Dirac 1928 El modelo atómico de 3
h ∂ψ
Dirac Jordan nace con
una base muy parecida
( j=1
)
α 0 mc 2 + ∑ α j p j c ψ ( x , t ) =i
2π ∂t
( x , t)
al modelo de
Schrödinger. Sin
embargo, el modelo de
Dirac introduce como
novedad la
incorporación de manera
natural del espín del
electrón, así como la
revisión y corrección de
ciertas teorías
relativistas.
En la Universidad de
Cambridge , introdujo el
esquema de
aproximación de campo
auto consistente que es
Douglas Hartree 1930 la base para la mayoría
de los cálculos atómicos
y para la comprensión
física predominante de
la Mecánica de ondas de
los átomos
El método de
aproximación de
Hartree-Fock para la
determinación de la
función de onda en
problemas de muchos
cuerpos o el espacio de
Fock utilizado para
Vladimir Fock 1930
describir estados
cuánticos en situaciones
en las que el número de
partículas no es fijo, se
reconocen como
contribuciones
fundamentales a la física
cuántica
Erich Hückel 1937 En 1937 desarrolló la
Teoría de Orbitales
Moleculares, generados
a partir de la
combinación de orbitales
atómicos. Aunque
existen varias teorías
acerca de los orbitales
moleculares la de Erich
Hückel determino la más
acertada de ellas, ya que
su método entra más en
detalle con respecto a los
orbitales y el tipo de
estos, con lo cual creo
varias expresiones para
determinar la función de
onda, los coeficientes
atómicos entre otras, las
cuales se plantearan en
este ensayo.
Formuló la teoría de la
funcional densidad que
permite averiguar la
geometría de las
moléculas y sus
propiedades de enlace.
Demostró que a fin de
Walter Kohn 1950 obtener de forma teórica
la geometría de una
molécula más o menos
compleja no es necesario
considerar el
movimiento de cada
electrón de forma
individual
Interesado en la síntesis
química de sustancias
orgánicas.
Sus trabajos teóricos
incluyen su colaboración
con Roald Hoffmann,
Robert Woodward 1965 con quien realizó
estudios de los
mecanismos de reacción
de los productos
químicos, instaurando
las reglas de Woodward-
Hoffmann.
Roald Hoffmann 1963 Hoffman ha investigado
las sustancias orgánicas
e inorgánicas,
desarrollando
herramientas
computacionales, así
como métodos como el
método Hückel
extendido, el cual
propuso en 1963.
También desarrolló,
junto con Robert Burns
Woodward, las reglas
para elucidar los
mecanismos de reacción
de los productos
químicos, conocidos
como las Reglas de
Woodward-Hoffma
Вам также может понравиться
- Paso 3 Software Avanzado PDFДокумент25 страницPaso 3 Software Avanzado PDFLiliana IdroboОценок пока нет
- Tarea 3 - Grupo - 7Документ17 страницTarea 3 - Grupo - 7UnadОценок пока нет
- Fisica Fredy OrtizДокумент2 страницыFisica Fredy OrtizFredy Alexander Ortiz LeonОценок пока нет
- Ejercicios Electromagnetismo Unidad 1 UnadДокумент3 страницыEjercicios Electromagnetismo Unidad 1 UnadMarcio Arun50% (2)
- Practica 1 Laboratorio Robotica Jhon LagunaДокумент25 страницPractica 1 Laboratorio Robotica Jhon LagunaJhonWuilquerLagunaCastellanosОценок пока нет
- Tarea1 - G114 - Franklin GranadosДокумент15 страницTarea1 - G114 - Franklin GranadosAndresFelipeLeonОценок пока нет
- Trabajo Final Control Analogico - ArticuloДокумент6 страницTrabajo Final Control Analogico - ArticuloDeimy TorresОценок пока нет
- Grupo30 Fase 1Документ26 страницGrupo30 Fase 1Andres CriolloОценок пока нет
- Tarea2 Jhonatan Insuasty Grupo17Документ9 страницTarea2 Jhonatan Insuasty Grupo17jhonatan insuasty100% (1)
- Análisis algoritmo SPWM inversor potenciaДокумент15 страницAnálisis algoritmo SPWM inversor potenciaAndres GarzonОценок пока нет
- Pre Tarea ESTRUCTURA MOLECULARДокумент6 страницPre Tarea ESTRUCTURA MOLECULARSuministros FerreterosОценок пока нет
- Practica Laboratorio 1 Electronica AnalogaДокумент15 страницPractica Laboratorio 1 Electronica AnalogaJuan Fernando Castrillon RuizОценок пока нет
- Tarea 2 Sistemas de ComunicacionДокумент4 страницыTarea 2 Sistemas de Comunicacionedwinsuarez1404Оценок пока нет
- Anexo 3 Formato Tarea 2 - CONSOLIDADOДокумент34 страницыAnexo 3 Formato Tarea 2 - CONSOLIDADOJulian GonzálezОценок пока нет
- Fase 1Документ7 страницFase 1FERNANDOОценок пока нет
- Análisis de Circuito Fase 4Документ14 страницAnálisis de Circuito Fase 4Elvis RussoОценок пока нет
- Fisica Moderna Quiz 1Документ8 страницFisica Moderna Quiz 1Renzo Alexander RestrepoОценок пока нет
- Tarea 2 - Trabajo Colaborativo Unidad 2 - Entrega de La Actividad PDFДокумент24 страницыTarea 2 - Trabajo Colaborativo Unidad 2 - Entrega de La Actividad PDFAndres AcevedoОценок пока нет
- Operaciones básicas sobre señales continuas y discretasДокумент30 страницOperaciones básicas sobre señales continuas y discretaslmtc7ster100% (1)
- Tarea1 Sistemas de Comunicacion E-LearningДокумент6 страницTarea1 Sistemas de Comunicacion E-LearningGerman CorreaОценок пока нет
- Sistemas de numeración y funciones lógicasДокумент15 страницSistemas de numeración y funciones lógicasAstrid Liliana Blanco CerqueraОценок пока нет
- Tarea3 299003 35Документ28 страницTarea3 299003 35Alejandro Barrera BravoОценок пока нет
- Ejercicios Literal CДокумент4 страницыEjercicios Literal CdanielОценок пока нет
- Fase 2 Electronica de Potencia Aporte 1Документ9 страницFase 2 Electronica de Potencia Aporte 1anaОценок пока нет
- Recolecta información introductoria al PDSДокумент10 страницRecolecta información introductoria al PDSMilton RojasОценок пока нет
- Anexo 2 Formato Tarea 1Документ12 страницAnexo 2 Formato Tarea 1Cristian CarmonaОценок пока нет
- Pretarea - Conocimientos Previos (II)Документ7 страницPretarea - Conocimientos Previos (II)Jose Elias Perafan LealОценок пока нет
- Aporte-Tarea 3Документ12 страницAporte-Tarea 3Fernando RinconОценок пока нет
- Revision Presaberes Electronica de Potencia 2020Документ4 страницыRevision Presaberes Electronica de Potencia 2020C T AОценок пока нет
- Paso 2 - Grupo 309696 - 1Документ17 страницPaso 2 - Grupo 309696 - 1Wilmer Cortes100% (1)
- Tarea2 G1Документ40 страницTarea2 G1H Bam BamОценок пока нет
- Diseño filtros RL RC RLCДокумент6 страницDiseño filtros RL RC RLCCristian Fabian Miranda Palomino0% (1)
- Unidad 1 2 3 Tarea 4 Componente PracticoДокумент28 страницUnidad 1 2 3 Tarea 4 Componente PracticoJorge Fabian GualteroОценок пока нет
- Mapa Mental Jardin de Newton - DrawioДокумент1 страницаMapa Mental Jardin de Newton - DrawioJhon RojasОценок пока нет
- Fase 1 - Presentar Solución Al Problema Del Interruptor CrepuscularДокумент5 страницFase 1 - Presentar Solución Al Problema Del Interruptor CrepuscularJeison Jair González VargasОценок пока нет
- Paso 4 309696 34Документ19 страницPaso 4 309696 34Leonardo Conde Cardenas100% (2)
- Actividad Individual Fase 1Документ7 страницActividad Individual Fase 1CRISTIAN DE LA CRUZ PONTÓNОценок пока нет
- Mente FactoДокумент1 страницаMente FactoTanhy Jr100% (1)
- Tarea 3 - ElectromagnetismoДокумент12 страницTarea 3 - ElectromagnetismoFernando Rincon100% (1)
- Tarea 4 Grupo 9 PDFДокумент6 страницTarea 4 Grupo 9 PDFhoolmanОценок пока нет
- Teoría especial de relatividad: Diferencia de tiempo entre relojes en movimiento y en reposoДокумент47 страницTeoría especial de relatividad: Diferencia de tiempo entre relojes en movimiento y en reposojohnbitaОценок пока нет
- Circuito Trabajo 4Документ22 страницыCircuito Trabajo 4Jeferson CastañedaОценок пока нет
- Tarea 2 Física Moderna Estudiante 1Документ8 страницTarea 2 Física Moderna Estudiante 1DiegoОценок пока нет
- Tarea 3 - G20Документ45 страницTarea 3 - G20JuanОценок пока нет
- BORRADORДокумент11 страницBORRADORFabian TorresОценок пока нет
- Metales y metalurgia: minerales y usos industrialesДокумент19 страницMetales y metalurgia: minerales y usos industrialesGerardinn Nathalia SANZ TAFURОценок пока нет
- Fase 1 JohanPerezДокумент10 страницFase 1 JohanPerezEvelin AndradeОценок пока нет
- Fase 6 - Implementar La Solución Al Problema Planteado - Jeyson CalderonДокумент13 страницFase 6 - Implementar La Solución Al Problema Planteado - Jeyson CalderonJeyson Calderon100% (1)
- Unidad 2 Fase 2 - Diseñar La Etapa de Conmutación Por SPWMДокумент9 страницUnidad 2 Fase 2 - Diseñar La Etapa de Conmutación Por SPWMFrancisco BadilloОценок пока нет
- Conceptos Teóricos - JonathanCarvajalДокумент9 страницConceptos Teóricos - JonathanCarvajalAndres ManosalvaОценок пока нет
- Unidad 2 - Fase 2 - Intercambio Cultural - LUIS TORRESДокумент4 страницыUnidad 2 - Fase 2 - Intercambio Cultural - LUIS TORRESDiana Muñoz CОценок пока нет
- Laboratorio Electromagnetismo 1Документ8 страницLaboratorio Electromagnetismo 1edwtrimoОценок пока нет
- Fase3 Analisis de Circuitos UNADДокумент15 страницFase3 Analisis de Circuitos UNADGiovanny Correa ChavezОценок пока нет
- Conceptos Teóricos - Jonathan GomezДокумент2 страницыConceptos Teóricos - Jonathan GomezJose AffleckОценок пока нет
- Ejercicio 4.1Документ3 страницыEjercicio 4.1Karen G RamosОценок пока нет
- Guía N°2 Química ComúnДокумент18 страницGuía N°2 Química ComúnlalaОценок пока нет
- SACO OLIVEROS Capítulo 5 Envoltura Electrónica UNI 2023 TeoríaДокумент38 страницSACO OLIVEROS Capítulo 5 Envoltura Electrónica UNI 2023 TeoríaWILLIAM HERNANDEZ TORCATTYОценок пока нет
- Mecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosОт EverandMecánica Cuántica Relativista y No Relativista: las dos a la vez: Parte I: Estados estacionariosОценок пока нет
- Fase 3 Leidy Martinez LДокумент4 страницыFase 3 Leidy Martinez Lleidy Marcela0% (1)
- Compilacion evaluacionesECUACIONES DIFERENCIALESДокумент188 страницCompilacion evaluacionesECUACIONES DIFERENCIALESJuan Carlos Restrepo Salcedo56% (18)
- Avance FisicoquimicaДокумент6 страницAvance Fisicoquimicaleidy MarcelaОценок пока нет
- Trabajo Individual Simulaciones Nancy Sthefany Jimenez 1057584585Документ37 страницTrabajo Individual Simulaciones Nancy Sthefany Jimenez 1057584585leidy MarcelaОценок пока нет
- Solucion de Sistemas de Ecuaciones Linea PDFДокумент60 страницSolucion de Sistemas de Ecuaciones Linea PDFJimmy LingОценок пока нет
- Guía para la solución de la Tarea 2 de CromatografíaДокумент11 страницGuía para la solución de la Tarea 2 de Cromatografíaleidy MarcelaОценок пока нет
- Anexo 4 Paso 4 - Solucionar Situaciones Problemicas en Relación Con Reacciones de PardeamientoДокумент6 страницAnexo 4 Paso 4 - Solucionar Situaciones Problemicas en Relación Con Reacciones de Pardeamientoleidy MarcelaОценок пока нет
- Guía para El Desarrollo Del Componente Práctico Virtual 301203Документ8 страницGuía para El Desarrollo Del Componente Práctico Virtual 301203leidy MarcelaОценок пока нет
- Cuadro SinopticoДокумент7 страницCuadro Sinopticoleidy MarcelaОценок пока нет
- Avance Tabla 1 Fisico Quimica.1Документ13 страницAvance Tabla 1 Fisico Quimica.1leidy MarcelaОценок пока нет
- Preinforme 8 QuimicaДокумент13 страницPreinforme 8 Quimicaleidy MarcelaОценок пока нет
- Ejercicios - Leidy - Transporte de SolidosДокумент4 страницыEjercicios - Leidy - Transporte de Solidosleidy MarcelaОценок пока нет
- Anexo 4 Paso 4 - Solucionar Situaciones Problemicas en Relación Con Reacciones de PardeamientoДокумент6 страницAnexo 4 Paso 4 - Solucionar Situaciones Problemicas en Relación Con Reacciones de Pardeamientoleidy MarcelaОценок пока нет
- Anexo Fase 2 - Matriz de Marco Lógico - Marolyn CardenasДокумент2 страницыAnexo Fase 2 - Matriz de Marco Lógico - Marolyn Cardenasleidy MarcelaОценок пока нет
- Fase 5 - Gestion de ProyectossДокумент36 страницFase 5 - Gestion de Proyectossleidy MarcelaОценок пока нет
- Ejercicios Unidad 3 Calculo BДокумент6 страницEjercicios Unidad 3 Calculo Bleidy MarcelaОценок пока нет
- 0-Protocolo de Prácticas de Laboratorio de BioquímicaДокумент62 страницы0-Protocolo de Prácticas de Laboratorio de BioquímicaLina Marcela Saenz Reyes100% (1)
- Leidy Martinez - CromatografiaДокумент16 страницLeidy Martinez - Cromatografialeidy MarcelaОценок пока нет
- Anexo 3 - Tarea 3Документ2 страницыAnexo 3 - Tarea 3leidy MarcelaОценок пока нет
- Termodinamica 2Документ5 страницTermodinamica 2leidy MarcelaОценок пока нет
- Química Analítica - Fase 3 - AdrianaДокумент5 страницQuímica Analítica - Fase 3 - Adrianaleidy MarcelaОценок пока нет
- Ejercicios Unidad 3 Calculo BДокумент6 страницEjercicios Unidad 3 Calculo Bleidy MarcelaОценок пока нет
- Trabajo ColaborativoДокумент6 страницTrabajo Colaborativoleidy MarcelaОценок пока нет
- Guia de Actividades y Rubrica de Evaluacion - Tarea 2 - Dualidad y Análisis Post-ÓptimoДокумент19 страницGuia de Actividades y Rubrica de Evaluacion - Tarea 2 - Dualidad y Análisis Post-ÓptimoAdri AndradeОценок пока нет
- EVALUACIÓN DE CONTAMINANTES EN MUESTRAS MEDIOAMBIENTALESДокумент2 страницыEVALUACIÓN DE CONTAMINANTES EN MUESTRAS MEDIOAMBIENTALESMelissa Marulanda RamosОценок пока нет
- Calcular tiempo probable proyecto UNADДокумент2 страницыCalcular tiempo probable proyecto UNADleidy MarcelaОценок пока нет
- Guía para la solución de la Tarea 2 de CromatografíaДокумент11 страницGuía para la solución de la Tarea 2 de Cromatografíaleidy MarcelaОценок пока нет
- Taller Termodinamica Fase 5Документ4 страницыTaller Termodinamica Fase 5leidy MarcelaОценок пока нет
- Anexo Fase 2 - Identificar Las Variables Básicas para La Planificación Del ProyectoДокумент2 страницыAnexo Fase 2 - Identificar Las Variables Básicas para La Planificación Del Proyectoleidy MarcelaОценок пока нет
- Flujo de Calor CalentadorДокумент2 страницыFlujo de Calor Calentadorleidy MarcelaОценок пока нет
- Estados Ligados de Potenciales CentralesДокумент18 страницEstados Ligados de Potenciales CentralesJohan BautistaОценок пока нет
- I Unidad - Distribuciones T Student - Chi CuadradoДокумент8 страницI Unidad - Distribuciones T Student - Chi CuadradoEstefany AscateОценок пока нет
- Los Estresados - Trabajo FinalДокумент16 страницLos Estresados - Trabajo FinalGeorgina HernandezОценок пока нет
- Diseño Con Repeticiones en El Centro2Документ4 страницыDiseño Con Repeticiones en El Centro2Cristian GuillermoОценок пока нет
- Distribucion Normal SencilloДокумент10 страницDistribucion Normal SencilloSantiago Santos100% (1)
- Análisis de La Varianza ANOVAДокумент7 страницAnálisis de La Varianza ANOVAGetsemani CumareОценок пока нет
- Regresión lineal y pronósticosДокумент25 страницRegresión lineal y pronósticosManuel Rodso100% (1)
- Teorema de BayesДокумент14 страницTeorema de BayesLuigi ItaloОценок пока нет
- Los Números CuánticosДокумент3 страницыLos Números CuánticosRuth SanchezОценок пока нет
- Wuolah Free P028Документ4 страницыWuolah Free P028Lorena IstrateОценок пока нет
- S11.s1 - MaterialДокумент17 страницS11.s1 - MaterialCristhian ZacariasОценок пока нет
- Teoría atómica: evolución de los modelos del átomoДокумент4 страницыTeoría atómica: evolución de los modelos del átomoLina Gonzalez100% (1)
- Teoría Cuántica de CamposДокумент4 страницыTeoría Cuántica de CamposMariah Rae IzelОценок пока нет
- Econometria de Datos en Panel PDFДокумент50 страницEconometria de Datos en Panel PDFLuis GuillenОценок пока нет
- Biologia Gabriel JacomeДокумент2 страницыBiologia Gabriel JacomeGabriel JacomeОценок пока нет
- Formulas de DistribucionesДокумент1 страницаFormulas de Distribucionescesar del rio sullonОценок пока нет
- Tarea 01 Monografia Test Números Pseudoaleatorios MOD1Документ13 страницTarea 01 Monografia Test Números Pseudoaleatorios MOD1Keny Orlando M. CanoОценок пока нет
- Regresion LinealДокумент15 страницRegresion LinealEduard M ForeroОценок пока нет
- Variable Aleatoria DiscretaДокумент6 страницVariable Aleatoria DiscretaAndre Edy Ramos PeñaОценок пока нет
- Docente: Aleman Gonzales Leonid Tema: Introducción Al "BAYESIANISMO" Semestre: 2023-IДокумент6 страницDocente: Aleman Gonzales Leonid Tema: Introducción Al "BAYESIANISMO" Semestre: 2023-Ijuan marcelo doseОценок пока нет
- Semana 01 Tarea de Ejercicios de Movimientos - Fisica - Ruiz Saavedra YomiraДокумент9 страницSemana 01 Tarea de Ejercicios de Movimientos - Fisica - Ruiz Saavedra YomiraYomira YulissaОценок пока нет
- Distribución de Fermi-Dirac y Distribución de Bose-EinsteinДокумент12 страницDistribución de Fermi-Dirac y Distribución de Bose-EinsteinYazzz GarciaLОценок пока нет
- Hipótesis Específica 1Документ5 страницHipótesis Específica 1Marco Antonio Alfonzo BriceñoОценок пока нет
- Estadística pública pruebasДокумент7 страницEstadística pública pruebasIsrael Diego100% (1)
- Aplicaciones de Analisis de Varianza PattyДокумент5 страницAplicaciones de Analisis de Varianza PattyLuis Aluizo Rdz0% (1)
- DMAIC MedirДокумент21 страницаDMAIC MedirEffect MtzОценок пока нет
- Tema 4Документ23 страницыTema 4eleazarОценок пока нет
- Poema Sobre El Universo CuánticoДокумент2 страницыPoema Sobre El Universo CuánticoismaelОценок пока нет
- Teoría de colas M/M/2Документ12 страницTeoría de colas M/M/2Perla MartinezОценок пока нет