Академический Документы
Профессиональный Документы
Культура Документы
1 - Equilíbrio Líq-Vapor
Загружено:
Juliane Froncheti de MouraАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
1 - Equilíbrio Líq-Vapor
Загружено:
Juliane Froncheti de MouraАвторское право:
Доступные форматы
_________________________________________________________________Físico-Química II
1) Equilíbrio Líquido-Vapor
1.1) Entalpia de Vaporização
É a diferença entre a entalpia do vapor e a entalpia do liquido em equilíbrio numa dada
temperatura:
∆Hv = H(g) – H(l)
A vaporização isotérmica se realiza sob pressão constante, que é a pressão de vapor do
liquido na temperatura considerada. O processo é:
a) reversível;
b) isotérmico e isobárico;
c) termelástico (w’ = 0)
Nessas condições, de acordo com o Primeiro Princípio, a entalpia de vaporização é igual
ao calor de vaporização:
∆Hv = qr
Por outro lado, H = U + PV e, a pressão constante,
∆Hv = ∆Uv + P ∆H
Considerando um mol, tem-se:
∆Hv = ∆Uv + P [V(g) – V(l)]
A temperaturas bastante inferiores à crítica pode-se desprezar o volume molar do líquido
diante do volume molar do vapor.
∆Hv = ∆Uv + PV(g) → ∆Hv = ∆Uv + RT
Quando a temperatura se aproxima do valor crítico, os volumes V (g) e V(l)] tornam-se cada
vez mais próximos e a segunda parcela da equação se torna cada vez menor. Portanto, a medida
que aumenta a temperatura, ∆Hv e ∆Uv convergem e tendem ambos para um valor nulo, porque
na temperatura crítica não há mais diferença de densidade entre líquido e vapor.
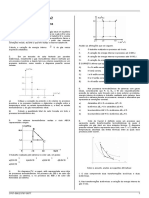
O calor de vaporização diminui com o aumento da temperatura mas a capacidade
calorífica do vapor é sempre inferior à do líquido em equilíbrio e, por isso, a entalpia de
vaporização sempre aumenta com a temperatura.
Variação do calor de vaporização da água com a temperatura
1.2) Entropia e energia livre de vaporização
A vaporização isotérmica de um líquido, em equilíbrio com o seu vapor, é um processo
reversível e, por isso o calor de vaporização é recebido reversivelmente.
∆Sv = qr = ∆Hv
T T
Como ∆Hv é sempre uma quantidade positiva, a entropia do vapor será sempre maior que
a entropia do líquido e este acréscimo corresponde ao aumento de desordem molecular que sofre
uma substância ao transferir-se do líquido para o vapor.
1.3) Regra de Trouton
Trouton encontrou a seguinte relação empírica: o quociente entre o calor molar de
vaporização, na temperatura de ebulição, e esta mesma temperatura expressa em graus
absolutos é aproximadamente igual a 21 cal mol-1 K-1 para um grande número de líquidos:
∆Hv ≈ 21 cal mol-1 K-1
Te0
0
LÍQUIDO ∆Hv Te ∆Hv/Te0 LÍQUIDO ∆Hv Te0 ∆Hv/Te0
He 24 -268,9 5,7 CCl4 7170 76,7 20,5
H2 216 -252,7 10,6 SCl4 7900 112 20,5
CH3COO 5830 118,2 14,9 C6H6 7353 80,1 20,8
H
HCOOH 5760 100,8 15,4 CHCl3 7050 61,5 21,0
N2 1330 -195,5 17,1 H2s 4500 -59,6 21,1
n-C4H10 5320 -1,5 19,6 Hg 14166 356,6 22,5
C10H8 9670 218 19,7 NH3 5560 -33,4 23,2
CH4 2216 -161,4 19,8 CH3OH 8430 64,7 24,9
(C2H5)2O 6210 34,6 20,2 H2O 9717 100,0 26,0
C6H12 7190 80,7 20,3 C2H5OH 9220 78,5 26,2
A tabela anterior dá a constante de Trouton para diversos líquidos. Os que obedecem a
regra são em geral, apolares ou de reduzida polaridade, possuem massa molecular em torno de
100 e temperatura de ebulição moderada. Tais líquidos são denominados normais, em
contraposição aos que não obedecem a regra. Esses últimos são em geral, líquidos polares
(água, álcool) ou então substâncias de elevado ponto de ebulição (mercúrio, que dão valores
muito altos para a constante de Trouton, ou ainda os que possuem ponto de ebulição e massa
molecular muito reduzidos (hidrogênio e hélio) que dão valores muito baixos para a referida
constante.
Líquidos polares possuem maior grau de organização do que os apolares. Nos primeiros,
formam-se em geral, ligações hidrogênicas que, entretanto, se desfazem na vaporização:
acréscimo de entropia (ou desordem) acima do comum, durante a vaporização.
Verifica-se nos ácidos carboxílicos um desvio oposto, apesar das fortes ligações
hidrogênicas neles existentes. É que estas moléculas formam dímeros que se mantêm no vapor,
em grande parte. Então, ao vaporizar-se um mol de líquido, o número de unidades (partículas)
que se transferem é realmente muito inferior ao número de Avogadro.
1.4) Equação de Clapeyron
A equação de Clapeyron dá a taxa de variação da pressão de equilíbrio entre duas fases
de uma substância pura, com a temperatura, em torno de uma certa temperatura T:
∆P = ∆H
∆T T∆V
Nota-se que as quantidades extensivas, ∆H e ∆V, referem-se a mesma massa de
substância e a mesma temperatura T.
Aplicada ao equilíbrio líquido-vapor esta equação dá:
∆P = ∆Hv
∆T T [V(g) – V(l)]
1) Uma aplicação desta equação é a determinação do calor de vaporização de um líquido
numa dada temperatura:
∆Hv = T [V(g) – V(l)] .
∆P
∆T
Se o coeficiente ∆P/∆T for expresso em atm K -1 e os volumes em litros, ∆H v será dado em
atm litros, notando-se que 1 atm litro = 24,217 cal.
Exemplo: Calcular o calor de vaporização de um grama de água a 100ºC. São fornecidos os
seguintes dados:
TºC P(mm Hg)
99,9 757,29
100,1 762,72
V(g) = 1,674 litros g-1 V(l) = 1 x 10-3 litros g-1
EXERCÍCIOS
1) Para os líquidos abaixo, verificar quais obedecem a regra de Trouton.
02) O calor de vaporização do clorobenzeno em sua temperatura normal de ebulição (132ºC) é 73,7
cal g-1. Calcule, aproximadamente, a pressão sob a qual o liquido ferve a 130ºC. A diferença entre
os volumes específicos do gás e do líquido para esta substancia é de 277,5 cm 3 g-1 no seu ponto de
ebulição.
03) A temperatura normal de ebulição do benzeno é 80,1ºC. A partir deste único dado, calor o calor
de vaporização para o benzeno, admitindo que ele é um líquido normal, segundo o critério de
Trounton.
Вам также может понравиться
- 3 - Soluções ReaisДокумент4 страницы3 - Soluções ReaisJuliane Froncheti de MouraОценок пока нет
- 1 - Equilíbrio Líq-VaporДокумент3 страницы1 - Equilíbrio Líq-VaporJuliane Froncheti de MouraОценок пока нет
- 2 - Termodinâmica Dassoluções Não-Eletrolíticas - Soluções IdeaisДокумент3 страницы2 - Termodinâmica Dassoluções Não-Eletrolíticas - Soluções IdeaisJuliane Froncheti de MouraОценок пока нет
- Apostila Química Orgânica ExperimentalДокумент18 страницApostila Química Orgânica ExperimentalJuliane Froncheti de MouraОценок пока нет
- Segurança em LaboratórioДокумент16 страницSegurança em LaboratórioJuliane Froncheti de MouraОценок пока нет
- Potenciometria - Aula PráticaДокумент1 страницаPotenciometria - Aula PráticaJuliane Froncheti de MouraОценок пока нет
- Segurança em LaboratórioДокумент3 страницыSegurança em LaboratórioJuliane Froncheti de MouraОценок пока нет
- Aula Prática - Preparo de SoluçõesДокумент1 страницаAula Prática - Preparo de SoluçõesJuliane Froncheti de MouraОценок пока нет
- Gases ideais e misturasДокумент3 страницыGases ideais e misturasJuliane Froncheti de MouraОценок пока нет
- Segunda Lei Da TermodinÂmicaДокумент47 страницSegunda Lei Da TermodinÂmicaJuliane Froncheti de MouraОценок пока нет
- Determinação de Cr6+ por espectrofotometriaДокумент12 страницDeterminação de Cr6+ por espectrofotometriaJuliane Froncheti de MouraОценок пока нет
- Espectometria de Absorção Atômica - FaasДокумент8 страницEspectometria de Absorção Atômica - FaasJuliane Froncheti de MouraОценок пока нет
- Calorimetria - Aula Prática 1Документ1 страницаCalorimetria - Aula Prática 1Juliane Froncheti de MouraОценок пока нет
- Equilíbrio QuímicoДокумент3 страницыEquilíbrio QuímicoJuliane Froncheti de MouraОценок пока нет
- Cromatografia Líquida de Alta EficiênciaДокумент10 страницCromatografia Líquida de Alta EficiênciaJuliane Froncheti de MouraОценок пока нет
- Corrosão de ligas metálicas experimentoДокумент2 страницыCorrosão de ligas metálicas experimentoJuliane Froncheti de MouraОценок пока нет
- Espectroscopia de Absorção Atômica - Forno de GrafiteДокумент11 страницEspectroscopia de Absorção Atômica - Forno de GrafiteJuliane Froncheti de MouraОценок пока нет
- Espectroscopia de Absorção Molecular UV-vísДокумент65 страницEspectroscopia de Absorção Molecular UV-vísJuliane Froncheti de Moura100% (1)
- Gases ideais: leis de Boyle, Charles e Gay-LussacДокумент2 страницыGases ideais: leis de Boyle, Charles e Gay-LussacJuliane Froncheti de MouraОценок пока нет
- Físico-Química II - Soluções IdeaisДокумент1 страницаFísico-Química II - Soluções IdeaisJuliane Froncheti de MouraОценок пока нет
- Aula Experimental 01Документ1 страницаAula Experimental 01Juliane Froncheti de MouraОценок пока нет
- Equação de NernstДокумент1 страницаEquação de NernstJuliane Froncheti de MouraОценок пока нет
- Comportamento de GasesДокумент3 страницыComportamento de GasesJuliane Froncheti de MouraОценок пока нет
- Cinética QuímicaДокумент4 страницыCinética QuímicaJuliane Froncheti de MouraОценок пока нет
- Aula Prática - Preparo de SoluçõesДокумент1 страницаAula Prática - Preparo de SoluçõesJuliane Froncheti de MouraОценок пока нет
- Cxjme0z51tbc5j55il11wt45Isotermas de Frendlich e BETДокумент3 страницыCxjme0z51tbc5j55il11wt45Isotermas de Frendlich e BETJuliane Froncheti de MouraОценок пока нет
- Exercícios Gases Lei do Gás IdealДокумент1 страницаExercícios Gases Lei do Gás IdealJuliane Froncheti de MouraОценок пока нет
- Lista de Exercícios - 1 TermodinâmicaДокумент1 страницаLista de Exercícios - 1 TermodinâmicaJuliane Froncheti de MouraОценок пока нет
- 2 - Combustiveis - CombustaoДокумент18 страниц2 - Combustiveis - CombustaoGilmar DemenekОценок пока нет
- Me Salva Fisica UFRGS 2019Документ19 страницMe Salva Fisica UFRGS 2019Bravo Construções & ServiçosОценок пока нет
- Revisão de TermodinâmicaДокумент22 страницыRevisão de TermodinâmicaSilvio EduardoОценок пока нет
- Exercicios Hidraulica - GabaritoДокумент20 страницExercicios Hidraulica - Gabaritodanielfortal100% (1)
- Máquinas agrícolas e fontes de potênciaДокумент71 страницаMáquinas agrícolas e fontes de potêncialandimarduarteОценок пока нет
- Dicionário de Termos Técnicos de EngenhariaДокумент472 страницыDicionário de Termos Técnicos de EngenhariaJohnSiilvaОценок пока нет
- Simulado Física 1º Ano - Mu e MuvДокумент6 страницSimulado Física 1º Ano - Mu e MuvManú OliveiraОценок пока нет
- Motor parts catalogDOCUMENTOДокумент579 страницMotor parts catalogDOCUMENTOErich Alves Carneiro67% (3)
- Gabarito - Exercicios de Teorico HidráulicaДокумент6 страницGabarito - Exercicios de Teorico HidráulicaGabriel ZancanellaОценок пока нет
- 1 LISTA DE EXERCÍCIOS - Processos de Conformação Mecânica.2022.2Документ4 страницы1 LISTA DE EXERCÍCIOS - Processos de Conformação Mecânica.2022.2Marcos RodriguesОценок пока нет
- Check List de Inspeção de Plataforma AéreaДокумент2 страницыCheck List de Inspeção de Plataforma AéreaAdilsonОценок пока нет
- Aplicação Leis de Newton AvançadoДокумент3 страницыAplicação Leis de Newton AvançadoLok SoaresОценок пока нет
- Curso Termodinâmica Gás IdealДокумент2 страницыCurso Termodinâmica Gás IdealLucas RosarioОценок пока нет
- Manual de Instruções: Motores Série Citius 8370 62615Документ51 страницаManual de Instruções: Motores Série Citius 8370 62615Reginaldo Bersani100% (1)
- Análise de estabilidade de taludes em mina de calcárioДокумент106 страницAnálise de estabilidade de taludes em mina de calcárioNanda RibeiroОценок пока нет
- Sistema eletropneumático caixa mudanças ZF 16 S 1650Документ3 страницыSistema eletropneumático caixa mudanças ZF 16 S 1650Alex Diagnostico Diesel100% (1)
- Ap 04 Mruv Cap Ufrr 2018Документ9 страницAp 04 Mruv Cap Ufrr 2018Ronaldo Da Costa CunhaОценок пока нет
- Abraçadeiras StauffДокумент69 страницAbraçadeiras StauffAlecsandro PereiraОценок пока нет
- Operação e manutenção do motor MWM Série 10Документ248 страницOperação e manutenção do motor MWM Série 10Carlinhos PoffoОценок пока нет
- Aplicações Da Física Clássica Na Engenharia MecânicaДокумент27 страницAplicações Da Física Clássica Na Engenharia MecânicaAlan AlmeidaОценок пока нет
- Sistema de Lubrificação MotoresДокумент7 страницSistema de Lubrificação MotoresWillianAlvesОценок пока нет
- As origens das falhas nas máquinasДокумент7 страницAs origens das falhas nas máquinasDélcio BangaОценок пока нет
- Ensaio de Fadiga em Materiais de ConstruçãoДокумент24 страницыEnsaio de Fadiga em Materiais de Construçãocarol_arqengОценок пока нет
- Hm100 Ehc-S Pdwc31412 Portegees 1Документ103 страницыHm100 Ehc-S Pdwc31412 Portegees 1Edgar AbdulaОценок пока нет
- Resistência dos Materiais Aula Sexta-feiraДокумент3 страницыResistência dos Materiais Aula Sexta-feiraWalbertОценок пока нет
- Funcionamento elevador hidráulicoДокумент25 страницFuncionamento elevador hidráulicoMariani CancellierОценок пока нет
- Tabela de Dimetro X CursoДокумент1 страницаTabela de Dimetro X CursoIezo aparecido Sanches netoОценок пока нет
- SoluçõesДокумент5 страницSoluçõescatarina moraisОценок пока нет
- Inspecao Boroscopica em Motores PDFДокумент26 страницInspecao Boroscopica em Motores PDFDenisОценок пока нет
- Energia mecânica e sua conservaçãoДокумент4 страницыEnergia mecânica e sua conservaçãoIzabelly Karine100% (1)