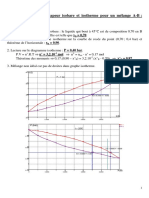
Академический Документы
Профессиональный Документы
Культура Документы
Gaz Parfaits
Загружено:
YRO AUBAINОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Gaz Parfaits
Загружено:
YRO AUBAINАвторское право:
Доступные форматы
Thermodynamique-Cycle 2 2015-2016
TABLE DES MATIERES
Chapitre 6 : PROPRIETES ENERGETIQUES DES GAZ PARFAITS ......................................................... 2
6.1- Lois fondamentales des Gaz Parfaits............................................................................................ 2
6.1.1- Transformation isochore : loi de Charles .............................................................................. 2
6.1.2- Transformation isobare : loi de Gay-Lussac .......................................................................... 2
6.1.3- Transformation isotherme : loi de Mariotte ......................................................................... 3
6.1.4- Energie interne, Enthalpie : lois (1ére et 2éme lois) de Joule ................................................... 3
6.2- Lois de Gay-Lussac et Charles....................................................................................................... 3
6.3- Equation des gaz parfaits ............................................................................................................. 4
6.4- Densité d’un gaz parfait par rapport à un autre .......................................................................... 6
6.4.1- Masse volumique d’un gaz parfait ........................................................................................ 6
6.4.2- Volume Molaire normal d’un gaz parfait .............................................................................. 6
6.4.3- Densité d’un gaz parfait ........................................................................................................ 7
6.5- Expérience caractérisant les gaz parfaits ..................................................................................... 7
6.6- Variation d’énergie des gaz parfaits pour une transformation quelconque................................ 8
6.6.1- Variation d’énergie interne d’un gaz parfait ......................................................................... 8
6.6.2- Variation d’enthalpie d’un gaz parfait .................................................................................. 9
6.5- Relation de Robert Mayer .......................................................................................................... 10
6.7- Bilan des grandeurs énergétiques pour les différentes transformations .................................. 11
Yro Aubain aubainyro@gmail.com Page 1
Thermodynamique-Cycle 2 2015-2016
Chapitre 6 : PROPRIETES ENERGETIQUES DES GAZ PARFAITS
6.1- Lois fondamentales des Gaz Parfaits
Un gaz parfait est un gaz dont les molécules n’ont aucune action mutuelle. Lorsque l’on fait
croître le volume occupé par un gaz, la pression du gaz décroît tandis que les interactions
entre molécules diminuent. Le gaz parfait est le modèle le plus simple que l’on puisse
imaginer pour représenter le comportement d’un gaz. Un gaz réel tend vers le gaz parfait
quand la pression tend vers zéro.
Le gaz parfait obéit aux lois suivantes :
6.1.1- Transformation isochore : loi de Charles
Il est possible de chauffer ou refroidir un gaz en maintenant son volume constant. Une
évolution à volume constant est dite isochore. Lorsque le volume d’un gaz parfait est
constant, ses propriétés varient selon la relation :
P
cste (6.1)
T
La loi Charles permet d’écrire :
P P0 (1 T ) (6.2)
Une autre formulation de la loi s’écrit :
Pi Pf
(6.3)
Ti T f
6.1.2- Transformation isobare : loi de Gay-Lussac
Il est possible de chauffer ou refroidir un gaz en maintenant sa pression constante. Une
évolution à pression constante est dite isobare. Lorsque la pression est constante, les
propriétés du gaz varient selon la relation :
V
cste (6.4)
T
Yro Aubain aubainyro@gmail.com Page 2
Thermodynamique-Cycle 2 2015-2016
La loi de Gay-Lussac permet d’écrire :
V V0 (1 T ) (6.5)
Une autre formulation de la loi s’écrit
Vi V f
(6.7)
Ti T f
6.1.3- Transformation isotherme : loi de Mariotte
Il est possible de chauffer ou refroidir un gaz en maintenant sa température constante. Une
évolution à température constante est dite isotherme. Pour un gaz parfait, une évolution à
température constante se fait toujours à énergie constante. Lorsque la température d’un gaz
parfait reste constante, ses propriétés varient selon la relation :
PV cste
Une autre formulation de cette loi donne :
i i Pf V f
PV
6.1.4- Energie interne, Enthalpie : lois (1ére et 2éme lois) de Joule
Les principales formes d’énergie d’un gaz parfait (Energie inter, Enthalpie, PV) sont
directement proportionnelles à la température.
U f (T ) ; H f (T )
6.2- Lois de Gay-Lussac et Charles
Déterminons la relation entre les coefficients de dilatation et de variation de pression à
273,15°K d’un gaz parfait. Considérons les transformations suivantes de la figure 6.1 :
A B : Transformation à V = Cst de T0 à TB
A C : Transformation à P = Cste de T0 à TB=TC
Volume Pression
A V0 P0
B V0 P0 (1 T )
C V0 (1 T ) P0
Yro Aubain aubainyro@gmail.com Page 3
Thermodynamique-Cycle 2 2015-2016
P
TB
TA
B
P0 C
A
V
V0
Figure 6.1 : Dilatation isochore et isobare des gaz parfaits
En appliquant la loi de Mariotte aux points B et C à la même température :
P0 (1 T ) .V0= P0 V0 (1 T )
Soit :
Pour un gaz parfait, on montre que :
1 1
0 0
T0 273,15
6.3- Equation des gaz parfaits
Considérons les points A et B définis par :
A : PA=P0 ; VA=V0
B : PB= P0 (1 T ) ; VB=V0
P TB
TA
B
P0 A
V
V0
Figure 6.2 : Relation entre les coefficients de dilatation et de variation de pression
Yro Aubain aubainyro@gmail.com Page 4
Thermodynamique-Cycle 2 2015-2016
Le produit PBVB donne :
PBVB= P0 (1 T ) V0
1 TB
Avec 0 soit 1 T
T0 T0
On obtient :
PV PV
0 0
B B C ste
T0 TB
Ainsi la loi s’écrit sous la forme :
PV C steT
La constante de proportionnalité Cste est nommée constante des gaz et notée R.
Enoncé
Un gaz parfait est un fluide à l’état gazeux dont le produit de la pression P et du volume V,
PV, reste proportionnel à sa température T :
PV nRT
Pour une masse m donnée de ce gaz ;
PV mrT
R
Avec r
M
R: constante molaire des gaz parfaits (J.K-1.mol-1)
M: masse molaire moléculaire du gaz considéré (g.mol-1)
n: nombre de moles (mol)
Remarque :
D’après la loi d’Avogadro, les masses molaires de tous les gaz occupent dans les mêmes
conditions de température et de pression le même volume. Donc R a la même valeur
universelle pour une mole de gaz parfait.
R 8,31J 1mol 1 K 1
Yro Aubain aubainyro@gmail.com Page 5
Thermodynamique-Cycle 2 2015-2016
6.4- Densité d’un gaz parfait par rapport à un autre
6.4.1- Masse volumique d’un gaz parfait
La masse volumique d’un gaz parfait est le quotient de sa masse m par son volume V.
On sait que l’équation des gaz parfaits s’écrit :
m
PV nRT PV RT
M
m PM
V RT
PM
D’où :
RT
6.4.2- Volume Molaire normal d’un gaz parfait
Le volume molaire Vm d’un gaz parfait est le volume d’une mole de gaz à 0°C sous la
pression atmosphérique normale (P0 = 1,01325.105 Pa)
PV nRT Pour 1mole PV RT
RT0
Alors Vm
P0
8,31 273,15
AN : Vm
101325
Vm = 22,41L.mol-1
Expérimentalement on trouve pour certains gaz :
Gaz He H2 N2 O2 CO2
Vm (L) 22,426 22,428 22,402 22,393 22,228
Yro Aubain aubainyro@gmail.com Page 6
Thermodynamique-Cycle 2 2015-2016
6.4.3- Densité d’un gaz parfait
La densité d d’un volume de gaz A par rapport au même volume de gaz B dans les mêmes
conditions de pression P et de température T est le quotient de la masse volumique du gaz A
par la masse volumique du gaz B.
A
d
B
PM
Avec :
RT
On a :
MA
d
MB
Remarque :
Les densités s’expriment en général par rapport à l’air. La masse volumique de l’air dans les
conditions normales de pression et de température est :
air 1, 293.103 gcm3
La masse molaire M de l’air est :
M air 22, 411, 293 29 g
D’où :
M Gaz
dGaz
29
6.5- Expérience caractérisant les gaz parfaits
On considère deux récipients adiabatiques A et B pouvant communiquer par l’ouverture d’un
robinet T. Le récipient A est rempli avec un gaz comprimé, le récipient B est vide.
Figure 6.3 – Détente de Joule - Gay-Lussac (1845)
Yro Aubain aubainyro@gmail.com Page 7
Thermodynamique-Cycle 2 2015-2016
Dans leur expérience la plus remarquable, Joule et Gay-Lussac cherchent à faire varier la
pression et le volume d’un gaz sans lui transférer de chaleur ou de travail. Pour cela, ils
laissent un gaz comprimé dans le récipient A se détendre dans un second récipient B vide
(figure 6.4). Le travail effectué est nul, car aucune surface n’a été déplacée – l’évolution est
entièrement irréversible. Joule et Gay-Lussac ne mesurent ni transfert de chaleur, ni variation
de température, ni travail échangé (pas de déplacement de parois) : L’énergie interne du gaz
ne varie pas ΔU = 0.
Or dans cette expérience P et V varient. Donc l’énergie interne U ne dépend ni de P ni de V.
L’énergie interne d’un gaz parfait ne dépend donc que de la température :
U f (T )
Remarque :
Si l’énergie interne d’un gaz parfait ne dépend que de la température, l’enthalpie d’un gaz
parfait ne dépend que de la température :
U ( PV )
U nRT
g (T )
6.6- Variation d’énergie des gaz parfaits pour une transformation quelconque
6.6.1- Variation d’énergie interne d’un gaz parfait
Considérons deux points quelconques A et B dans le diagramme de Clapeyron. L’énergie
interne ne dépendant pas du chemin suivi, nous pouvons décomposer le chemin AB selon une
transformation isotherme AA’ suivie d’une transformation isochore A’B.
Yro Aubain aubainyro@gmail.com Page 8
Thermodynamique-Cycle 2 2015-2016
Figure 6.4 – Variation d’énergie interne d’un gaz pour une transformation quelconque
Calcul de la variation d’énergie interne d’un gaz parfait
U AB U AA ' U A ' B
U AB 0 WA ' B QA ' B
U AB 0 0 nCV (TB TA )
U AB nCV (TB TA )
6.6.2- Variation d’enthalpie d’un gaz parfait
Considérons deux points quelconques A et B dans le diagramme de Clapeyron. L’enthalpie de
ne dépendant pas du chemin suivi, nous décomposons le chemin AB selon une transformation
isotherme AB’ suivie d’une transformation isobare B’B.
Figure 6.5 – Variation d’enthalpie d’un gaz pour une transformation quelconque
Yro Aubain aubainyro@gmail.com Page 9
Thermodynamique-Cycle 2 2015-2016
Calcul de la variation d’enthalpie d’un gaz parfait
AB AB ' B ' B
AB 0 QB ' B
AB 0 nCP (TB TA )
AB nCP (TB TA )
Remarque :
Les expressions de ΔU et ΔH sont valables pour des transformations quelconques :
U AB nCV (TB TA ) ; AB nCP (TB TA )
Par contre :
ΔQV = nCV(TB − TA) n’est exact que pour une transformation isochore.
ΔQP = nCP(TB − TA) n’est exact que pour une transformation isobare.
6.7- Relation de Robert Mayer
Déterminons la différence entre les chaleurs massiques Cv et Cp.
Différencions l’expression de l’enthalpie H = U +PV soit pour une mole :
d d (U PV )
d dU d ( PV )
d nCV dT d (nRT )
nCP dT nCV dT nRdT
Soit en simplifiant par ndT :
CP CV R
La relation de Robert Mayer s’écrit de la façon suivante :
R CP CV
Yro Aubain aubainyro@gmail.com Page 10
Thermodynamique-Cycle 2 2015-2016
6.8- Bilan des grandeurs énergétiques pour les différentes transformations
6.8.1- Transformation isochore
Pour une transformation isochore, V=Cst ; P et T varient :
Wisoch PdV 0
QV nCV dT
6.8.2- Transformation isobare
Pour une transformation isobare, P=Cste ; V et T varient :
2 2
Wisob PdV P1 dV
1 1
Wisob P1 (V2 V1 )
QP nCP dT
6.8.3- Transformation isotherme
Pour une transformation isotherme, T=Cste ; V et P varient
2 2
nRT
Wisoth PdV dV
1 1
V
V2
Wisoth nRT ln( )
V1
Le gaz parfait est maintenu au cours de la transformation à température constante, donc :
U 0 W Q 0 Q W
V2
Qisoth nRT1 ln( )
V1
Yro Aubain aubainyro@gmail.com Page 11
Thermodynamique-Cycle 2 2015-2016
6.8.4- Transformation adiabatique
Pour une transformation isotherme, les trois variables d’état P, T et V varient simultanément,
il est donc nécessaire d’établir une nouvelle relation entre ces variables :
Le premier principe s’écrit :
dU nRdT Q W PdV
dV
dU nRT
V
Soit :
CV dT dV
0
R T V
Expression de l’équation différentielle :
CV
Calcul du rapport :
R
R CV 1
R CP CV 1
CV R 1
L’équation différentielle devient :
1 dT dV
0
1 T V
dT dV
( 1) 0
T V
Intégration de l’équation différentielle :
dT dV
( 1) 0
T V
T V
ln( ) ( 1) ln( ) 0
T0 V0
TV 1 Cste
Soit :
TV 1 Cste
A partir de la loi des gaz parfaits on obtient :
Yro Aubain aubainyro@gmail.com Page 12
Thermodynamique-Cycle 2 2015-2016
(P,V) PV C ste
(T,V) TV 1 C ste
(P,T) T P1 C ste
Calcul du travail échangé au cours d’une transformation adiabatique
2
Wadiab PdV avec PV
1 1 PV
2 2 PV
2
PV
Wadiab 1 1
dV
1
V
2
dV
V
Wadiab PV
1 1
1
V2
V 1
Wadiab PV
1 1
1 V1
2 2 PV
PV
Wadiab 1 1
1
L’expression du travail pour une transformation adiabatique peut également s’écrire :
2 2 PV
PV nRT2 nRT1
Wadiab 1 1
1 1
6.9- Mélange de gaz parfaits
La théorie cinétique des gaz montre que les gaz, qui ne réagissent pas entre eux, se mélangent
au bout d’un certain temps. La composition du gaz est la même, en tous les points du volume,
au bout d’un temps suffisant. L’on suppose que le mélange de gaz se comporte comme un gaz
parfait.
Yro Aubain aubainyro@gmail.com Page 13
Thermodynamique-Cycle 2 2015-2016
6.9.1- Pression partielle d’un gaz
La pression partielle p d’un gaz est la pression qu’aurait un gaz constituant le mélange s’il
occupait seul le volume du mélange. Pour chaque gaz appartenant au mélange, on a :
p1V n1RT ; p2V n2 RT ; ….
6.9.2- Loi de Dalton
La pression totale P d’un mélange gazeux est égale à la somme des pressions partielles p1 , p2
, ....de chacun des constituants.
i n
P pi
i 1
6.9.3- Equation d’état d’un mélange de gaz parfait
Considérons n gaz parfaits distincts occupant des volumes distincts. Les états de ces gaz sont
caractérisés par :
P1 ,V1 , T1
Etat initial des gaz : P2 ,V2 , T2
P ,V , T
n n n
Mélangeons ces gaz dans un récipient de volume V maintenu à la température T. Appelons P
la pression finale. Cherchons une relation entre ces grandeurs. Soient p1, p2 , ..... les pressions
partielles des gaz dans le volume V à la température T. On peut écrire :
Etat initial Etat final
PV pV
P1,V1,T1 p1,V,T 1 1
1
T1 T
PV pV
P2,V2,T2 p2,V,T 2 2
2
T2 T
…………………………………………………………………............
Yro Aubain aubainyro@gmail.com Page 14
Thermodynamique-Cycle 2 2015-2016
PV pV
Pn,Vn,Tn pn,V,T n n
n
Tn T
La pression totale du mélange est :
P= p1 + p2 + p3……… + pn
Soit :
PV i n PV
i i
T i 1 Ti
Yro Aubain aubainyro@gmail.com Page 15
Вам также может понравиться
- Lakoff G - Les Métaphores Dans La Vie QuotidienneДокумент18 страницLakoff G - Les Métaphores Dans La Vie QuotidienneThierry Manirambona67% (3)
- Isomerisaion Des Cyclohexane en MethylcyclopentaneДокумент8 страницIsomerisaion Des Cyclohexane en MethylcyclopentaneHadjer zitОценок пока нет
- SPECTROSCOPIE INFRAROUGE - Partie1Документ11 страницSPECTROSCOPIE INFRAROUGE - Partie1مكتبة الأمانيОценок пока нет
- Dilatation SДокумент3 страницыDilatation Sckhaled30% (1)
- 2eme Cours 2019 Tizi ParaffineДокумент11 страниц2eme Cours 2019 Tizi ParaffineopheОценок пока нет
- TD2 2018Документ6 страницTD2 2018Hassan ChehouaniОценок пока нет
- Mecanique de FluideДокумент15 страницMecanique de FluideJoshua Carpenter100% (1)
- TD Ir 2019Документ39 страницTD Ir 2019khouloud bensalemОценок пока нет
- Génie Chimique Partie II-2Документ44 страницыGénie Chimique Partie II-2khaoula khaoulaОценок пока нет
- CHAPITRE III La SolubilitéДокумент9 страницCHAPITRE III La Solubilitéfullhd qatkaОценок пока нет
- ThermodynamiqueДокумент37 страницThermodynamiqueyounessmaОценок пока нет
- TP Chimie 2Документ16 страницTP Chimie 2khraifi RimОценок пока нет
- UntitledДокумент2 страницыUntitledRima mimiОценок пока нет
- A-TP-1 RedoxДокумент7 страницA-TP-1 RedoxPathmanathanОценок пока нет
- Travaux Dirigés CHM101 - Série N°1Документ5 страницTravaux Dirigés CHM101 - Série N°1RV EtseОценок пока нет
- Diagramme D'ostwald ProfДокумент9 страницDiagramme D'ostwald ProfOmar KetfiОценок пока нет
- Chap 3 Diagrammes EpHДокумент7 страницChap 3 Diagrammes EpHayoub echraaОценок пока нет
- ExamensДокумент5 страницExamensHassan AboulfadamОценок пока нет
- Exposer de PétrochimieДокумент37 страницExposer de PétrochimieNoureddine FrhОценок пока нет
- Nitration Des AromatiquesДокумент11 страницNitration Des AromatiquesHadjer zitОценок пока нет
- Exos CH 05Документ2 страницыExos CH 05lol testОценок пока нет
- TP1 Génie PétrochimiqueДокумент6 страницTP1 Génie Pétrochimiqueياسمين لقرافОценок пока нет
- 5351 Entrainement TSДокумент6 страниц5351 Entrainement TSmohammed laadili100% (1)
- Phénomènes de Surface Et Catalyse Hétérogène ConvertiДокумент179 страницPhénomènes de Surface Et Catalyse Hétérogène Convertipc ghomri100% (1)
- Corrigé de TD2 - Pétrochimie 2 - L3 Raffinage Et PétrochimieДокумент3 страницыCorrigé de TD2 - Pétrochimie 2 - L3 Raffinage Et Pétrochimieabdo myОценок пока нет
- O2 - Binaires G2D CorrigeДокумент8 страницO2 - Binaires G2D Corrigeoumayma afdhalОценок пока нет
- Examen Final L3 GP 2016-2017Документ2 страницыExamen Final L3 GP 2016-2017AnesОценок пока нет
- Détermination de La Constante D'aciditéДокумент3 страницыDétermination de La Constante D'aciditéAnis Dahnen100% (2)
- TD1 - CorrectionДокумент8 страницTD1 - Correctionmm72c48gbgОценок пока нет
- Corrigé Type Chimie Des Surfaces Master 1 CHIMIE M S1 2019 2020Документ2 страницыCorrigé Type Chimie Des Surfaces Master 1 CHIMIE M S1 2019 2020Zahra l زهرة50% (2)
- Cours - Piles A CombutiblesДокумент13 страницCours - Piles A Combutiblesenergiesrenouvelables25Оценок пока нет
- Fabrication Et Contrôle de Qualité Du Médicament PARALGAN® 300mg en SachetДокумент49 страницFabrication Et Contrôle de Qualité Du Médicament PARALGAN® 300mg en Sachetkenzadiamant20Оценок пока нет
- TP Chemie 02Документ6 страницTP Chemie 02Before SunriseОценок пока нет
- Chapitre 1 - AdsorptionДокумент47 страницChapitre 1 - AdsorptionSara Qrm100% (1)
- Polycope TP-TMДокумент4 страницыPolycope TP-TMamiour krimo100% (1)
- Banc KoflerДокумент2 страницыBanc KoflerTaouil MohamedОценок пока нет
- Serie 2Документ8 страницSerie 2Mourad MatmourОценок пока нет
- Orca Share Media1586856710132 PDFДокумент1 страницаOrca Share Media1586856710132 PDFAabed omairОценок пока нет
- CoursДокумент66 страницCoursAkrem HkimiОценок пока нет
- Chapitre 4 Transition de Phase Version Simplifiée STДокумент45 страницChapitre 4 Transition de Phase Version Simplifiée STArmel YmgОценок пока нет
- Cours Cinet Chimiq 3Документ45 страницCours Cinet Chimiq 3hicham bouatlaouiОценок пока нет
- TP2 RéacteurДокумент9 страницTP2 RéacteurÄyyoüb El-BchiriОценок пока нет
- Chrono Potent I Om Ét RieДокумент33 страницыChrono Potent I Om Ét RieIsmail HisashiОценок пока нет
- Potentiel ChimiqueДокумент28 страницPotentiel ChimiquescienziatoОценок пока нет
- 1er Cours Petro 2019Документ12 страниц1er Cours Petro 2019slimane mohandОценок пока нет
- Chapitre 2Документ9 страницChapitre 2Saïda CHERIFОценок пока нет
- Correction Serie 1 Modelisation 2021 PDFДокумент8 страницCorrection Serie 1 Modelisation 2021 PDFlola benrОценок пока нет
- Chapitre 1Документ4 страницыChapitre 1Amina BadaouiОценок пока нет
- Examen - Final - 2012-2013.docx Filename - UTF-8''Examen Final 2012-2013-1Документ2 страницыExamen - Final - 2012-2013.docx Filename - UTF-8''Examen Final 2012-2013-1sidi mohamed el amine nekkalОценок пока нет
- Le Composé C Défini À Fusion Congruente Est Un Composé Dont Le Liquide Et Le Solide Ont Même CompositionДокумент3 страницыLe Composé C Défini À Fusion Congruente Est Un Composé Dont Le Liquide Et Le Solide Ont Même Compositionsamir ghebouli100% (1)
- Correction Du TD-Inégnierie de La Réaction CatalytiqueДокумент4 страницыCorrection Du TD-Inégnierie de La Réaction CatalytiqueBenito BenitoОценок пока нет
- Electrochimie ChafouДокумент12 страницElectrochimie ChafouSamah SoltaneОценок пока нет
- Corrigé Serie 3Документ4 страницыCorrigé Serie 3Imane Bsr100% (1)
- Série 1Документ2 страницыSérie 1slh 01Оценок пока нет
- M M - I - T N - F: M M: La Masse Finale (MG) S: Surface Totale (CM T: Temps D'immersion (H)Документ2 страницыM M - I - T N - F: M M: La Masse Finale (MG) S: Surface Totale (CM T: Temps D'immersion (H)Ãdël ÃïssānîОценок пока нет
- 2005 AmSud Correction Exo3 Cinetique Sapo 6 5ptsДокумент3 страницы2005 AmSud Correction Exo3 Cinetique Sapo 6 5ptsFoudil LaouiciОценок пока нет
- Applications de la spectrophotomérie en phytochimie: sciencesОт EverandApplications de la spectrophotomérie en phytochimie: sciencesОценок пока нет
- Conversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanОт EverandConversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanОценок пока нет
- 2-Etude Des GazДокумент33 страницы2-Etude Des Gazyoulmafia99Оценок пока нет
- Syst Me InternationalДокумент9 страницSyst Me InternationalYRO AUBAINОценок пока нет
- Equation Aux DimensionsДокумент3 страницыEquation Aux DimensionsYRO AUBAINОценок пока нет
- Recrutement Enseignants Chercheurs 2023Документ2 страницыRecrutement Enseignants Chercheurs 2023YRO AUBAINОценок пока нет
- Ask Ai 501200Документ1 страницаAsk Ai 501200YRO AUBAINОценок пока нет
- TD Part3 ClimatisationДокумент18 страницTD Part3 ClimatisationYRO AUBAINОценок пока нет
- Thermochimie1Документ77 страницThermochimie1Olivia GallagherОценок пока нет
- CNC Si MP 2015c1Документ19 страницCNC Si MP 2015c1Hechmi ChermitiОценок пока нет
- Courant AlternatifДокумент7 страницCourant Alternatifadyady1100% (1)
- Ing 0067Документ127 страницIng 0067Nabil Merabet100% (2)
- Chapitre IДокумент18 страницChapitre IMamadou BambaОценок пока нет
- Matériaux Ferromagnétiques AmorphesДокумент13 страницMatériaux Ferromagnétiques AmorphesAnes ArcОценок пока нет
- Chapitre 4. TorsionДокумент4 страницыChapitre 4. Torsionmoura dalabraОценок пока нет
- CHAHOUR Kahina PDFДокумент123 страницыCHAHOUR Kahina PDFBroni BrusconiОценок пока нет
- Lycee Zahrouni-Tunis-: Mouvement Du Point MatérielДокумент2 страницыLycee Zahrouni-Tunis-: Mouvement Du Point MatérielAnonymous YhXkmsEQWkОценок пока нет
- TP Enonce EMДокумент19 страницTP Enonce EMabdessalam MedjОценок пока нет
- Chaitre 5. Capteur de ForceДокумент8 страницChaitre 5. Capteur de Forceredouane lotfiОценок пока нет
- TD-corrigé THER 2015Документ4 страницыTD-corrigé THER 2015Mohamed EL FAGHLOUMIОценок пока нет
- LAMOURI Mohammed El Haouari ABDELKANI FatehДокумент54 страницыLAMOURI Mohammed El Haouari ABDELKANI FatehNur UhoОценок пока нет
- 2S TDC2 2011Документ2 страницы2S TDC2 2011Magatte DiopОценок пока нет
- Cours DiodeДокумент38 страницCours DiodebachirОценок пока нет
- Biophysique 1ére EMD Cheref ResuméДокумент15 страницBiophysique 1ére EMD Cheref Resumékhealou0% (1)
- Chapitre 3. Caractéristiques Géométriques Des Sections PlanesДокумент12 страницChapitre 3. Caractéristiques Géométriques Des Sections PlanesBakary KeitaОценок пока нет
- 1 Actions MecaniquesДокумент3 страницы1 Actions MecaniquesAbdel ElouaerОценок пока нет
- TP DiffractionДокумент11 страницTP DiffractionIdir AmrousОценок пока нет
- Devoir de Mecanique Du PointДокумент2 страницыDevoir de Mecanique Du PointJudicialОценок пока нет
- Cours SMP S6 SEANCE 1Документ26 страницCours SMP S6 SEANCE 1Said MrfОценок пока нет
- CFMR - Poly de Cours PDFДокумент173 страницыCFMR - Poly de Cours PDFIMARОценок пока нет
- Mouv Relatif CoursДокумент12 страницMouv Relatif CoursAbd Elfateh MouloudjОценок пока нет
- Chapitre VII: 1. Principe Des Calculs DFTДокумент12 страницChapitre VII: 1. Principe Des Calculs DFTMoha Med100% (1)
- Travaux Dirigés de Mécanique AnalytiqueДокумент71 страницаTravaux Dirigés de Mécanique AnalytiquehassegouteОценок пока нет
- BEMAnnex1 (BielleManivelle Dynamique) PDFДокумент6 страницBEMAnnex1 (BielleManivelle Dynamique) PDFGannouni AymenОценок пока нет
- TD Serie6 CorrДокумент4 страницыTD Serie6 Corrraniaghegaglia31Оценок пока нет
- TD 4 + CorrectionДокумент10 страницTD 4 + CorrectionRahal karimОценок пока нет
- Fluid MechanicsДокумент4 страницыFluid Mechanicshaddar.takiОценок пока нет