Академический Документы
Профессиональный Документы
Культура Документы
Unidad 2 Materiales
Загружено:
Luis Sáez AmorrichОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Unidad 2 Materiales
Загружено:
Luis Sáez AmorrichАвторское право:
Доступные форматы
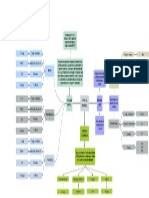
UNIDAD 2 MATERIALES SIDERÚRGICOS, CERÁMICOS Y POLIMÉRICOS
Materiales siderúrgicos
Definición: Son aquellos materiales que tienen como base el hierro.
Para saciar nuestras necesidades y dar solución técnica a nuestros problemas
empleamos los materiales para diversas aplicaciones. Entre estos materiales están los metales.
Curvas de enfriamiento
Para trabajar los metales (entre ellos el hierro), se llevan hasta su temperatura
de fusión para después darles la forma deseada. La representación de la temperatura frente al
tiempo durante el proceso de enfriamiento del material se conoce como curva de enfriamiento.
Aleaciones
Los metales puros tienen unas propiedades poco útiles, por tanto hemos de
modificar los materiales para así poder usarlos, por ello aparecen las aleaciones.
Definición: Una aleación es una sustancia homogénea constituida por un metal
y otro/s material/es sean metálicos o no.
El resultado de la aleación debe ser:
1) Un material con carácter metálico.
2) Debe ser homogénea, ello implica que los componentes sean
totalmente miscibles en estado líquido.
En toda aleación siempre habrá:
a) Disolvente: Es el componente que se encuentra en mayor
proporción.
b) Soluto/s: Es el componente que se encuentra en menor
proporción.
Soluciones sólidas
Al fin y al cabo una aleación es una solución sólida, en la que los átomos de los
aleantes se sitúan en la red cristalina del metal base. Dependiendo de la disposición de
los átomos del disolvente y del soluto tenemos dos tipos de soluciones:
1) Solución por sustitución: Los átomos de soluto ocupan nudos de la
red cristalina. Se producen si los átomos del metal base y de los átomos aleantes son
semejantes en tamaño, composición y forma de cristalización. Son habituales cuando
el disolvente y el soluto son metales.
2) Solución por inserción: Los átomos de aleantes se alojan en los
intersticios de la red cristalina del disolvente (metal base). Los átomos aleantes deben ser lo
suficientemente pequeños para introducirse en la red. Se dan cuando los aleantes son no
metales (H, B, C, N).
Diagramas de equilibrio de fases. Regla de las fases de Gibbs
La fabricación de aleaciones puede llegar a ser un proceso complejo
dependiendo del número de aleantes que haya que añadir al metal base y de su proporción.
Para estudiar las aleaciones hemos de saber que:
a) Sistema: Es la porción de materia que ha sido aislada para su estudio.
b) Fase: Parte de un sistema material homogéneo y separado físicamente.
Los diagramas de equilibrio de fases (también denominados de solidificación)
nos permiten reconocer las transformaciones que tiene lugar en el proceso de
enfriamiento de las aleaciones, dependiendo de la composición de éstas. Recogen toda
la información sobre la estructura de las fases de la aleación objeto de estudio.
Se deben tener en cuenta en el diagrama de equilibrio: Presión, temperatura y
composición.
Supondremos que la aleación es creada a presión atmosférica y que
prácticamente no influye en la aleación resultado. Por tanto representaremos:
- En el eje de ordenadas la TEMPERATURA.
- En el eje de abcisas la proporción de cada uno de los componentes
en % en la aleación.
Los diagramas más sencillos son los que corresponden a las aleaciones
binarias.
Para poder conocer las variables que podemos modificar para influir en la
aleación final hemos de tener en cuenta criterios termodinámicos, que se concretan en
la reglas de las fases de Gibbs. Esta regla dice:
F+N=C+2
Donde: F = nº de fases que pueden coexistir.
N = Grados de libertad. Variables que puedo modificar según donde nos
situemos en el diagrama.
C = Número de componentes de un sistema material.
Tipos de diagramas de fases:
Según el número de componentes:
a) Binarios: Son los que representan aleaciones formadas por
dos componentes.
b) Ternarios: Son los que representan aleaciones formadas por
tres componentes.
Interpretación general del diagrama de fases:
Conociendo la concentración y la temperatura de equilibrio, los diagramas de
fases nos proporcionan la siguiente información:
A) Número de fases presentes en el equilibrio:
B) Determinación de la composición de las fases:
Se nos pueden presentar aquí distintos casos:
1) Si al localizar el punto en equilibrio sólo existe una fase, trazamos
una paralela al eje de abcisas (eje x) por el punto y así
determinaremos ene le corte con el eje de ordenadas (eje y) la
TEMPERATURA. De igual modo trazamos por el punto una
paralela al eje de ordenadas y donde corte al eje de abcisas
tendremos la COMPOSICIÓN en % de la aleación.
2) Si al localizar el punto en equilibrio coexisten dos fases, la solución
se complica: En estas regiones podemos trazar imaginariamente
líneas horizontales a la temperatura determinada, que
denominaremos rectas de reparto o isotermas. Las
concentraciones en equilibrio de las dos fases presentes se
calculan siguiendo los pasos siguientes:
A) Se traza una recta a través de la región bifásica a la
temperatura de la aleación.
B) Se anotan las intersecciones de la recta de reparto con
los dos límites de la fase de los extremos.
C) A partir de las intersecciones, se trazan perpendiculares
hasta el eje de abcisas y las intersecciones resultantes
corresponden a las composiciones de las fases
presentes.
C) Determinación de la cantidad de fases:
La cantidad relativa, como fracción o como porcentaje, de las fases
presentes en el equilibrio se puede calcular mediante los diagramas de
fases. Los campos monofásicos y bifásicos se han de tratar
separadamente:
A) Punto en campo monofásico:
A partir de lo relatado en el apartado anterior se
determina la cantidad de componente que hay en la
aleación y toda ella será 100% fase estudiada (sólido o
líquido).
B) Punto en campo bifásico:
Pretendemos saber qué cantidad hay de cada
componente y qué cantidad está en estado líquido y cual
en estado sólido. Para conocerlo se realizan cálculos
aplicando la REGLA DE LA PALANCA:
A) A la temperatura de la aleación se traza un
segmento de recta de reparto a través de la región
bifásica.
B) La composición total de la aleación está localizada
en el segmento de recta de reparto.
C) La fracción de una fase se calcula midiendo la
longitud del segmento de la recta de reparto, desde
la composición de la aleación hasta el límite de la
otra fase, y dividiéndola por la longitud total del
segmento de isoterma.
D) La fracción de la otra fase se determina del mismo
modo.
E) Si lo que interesa son los porcentajes de fases, se
multiplican por 100 las fracciones de fase. Si la
abscisa de la composición está expresada en
porcentaje en peso, las fracciones de fase
calculadas utilizando la regla de la palanca son
fracciones de masa ( la masa o peso de una fase
específica dividida por la masa o peso total de la
aleación). La masa de cada fase se calcula a partir
del producto de cada fracción de fase por la masa
total de la aleación. A veces es conveniente
calcular las fracciones de volumen de las fases,
que se obtienen teniendo en cuenta las densidades
de las fases.
La longitud del segmento de la recta de reparto se mide con la ayuda de una regla, o
bien restando los valores de composición que figuran en el eje de abcisas.
D) Puntos de interés de un diagrama de fases:
1) Punto eutéctico: Se trata de aquel punto del diagrama de fases
donde se da una reacción eutéctica, que es aquella en la cual toda
la fase líquida se transforma por enfriamiento en dos fases
sólidas isotérmicamente.
2) Punto eutectoide: Se trata de aquel punto del diagrama donde se
da una reacción eutectoide, que es aquella en la cual una fase
sólida se transforma por enfriamiento en dos fases sólidas
isotérmicamente.
Вам также может понравиться
- MSDS Nitrogeno PraxairДокумент7 страницMSDS Nitrogeno PraxairMel Janice Fran ChangОценок пока нет
- Quimica Modalidad de Exámenes - Semana 4Документ1 страницаQuimica Modalidad de Exámenes - Semana 4González Medina Jesús100% (1)
- Plan de manejo ambiental para la implementación de la unidad de deshidratación de LGN en la planta MalvinasДокумент89 страницPlan de manejo ambiental para la implementación de la unidad de deshidratación de LGN en la planta MalvinasVictor PerezОценок пока нет
- Adsorcion DesorcionДокумент3 страницыAdsorcion DesorcionBernabé Machaca NúñezОценок пока нет
- Johnjmar Taller No1Документ2 страницыJohnjmar Taller No1Cristian SalcedoОценок пока нет
- ASIGNACIÓN UNIDAD III Equipos de Procesos IДокумент16 страницASIGNACIÓN UNIDAD III Equipos de Procesos IRaulid SandreaОценок пока нет
- Trabajo Final Integrador Litio - AmbienteДокумент26 страницTrabajo Final Integrador Litio - Ambientepedobearsuelto100% (1)
- Examen-Gases-Materia y Estados de AgregacionДокумент2 страницыExamen-Gases-Materia y Estados de Agregacionbeita33100% (1)
- Factores bióticos y abióticos en los ecosistemasДокумент12 страницFactores bióticos y abióticos en los ecosistemasAnac MSolОценок пока нет
- El espacio geográfico peruano: relieve, geomorfología y litoralДокумент15 страницEl espacio geográfico peruano: relieve, geomorfología y litoralMelissa Berrios CoaquiraОценок пока нет
- Atencion A Derrames de Materiales o Residuos PeligrososДокумент2 страницыAtencion A Derrames de Materiales o Residuos PeligrososTlali NeliОценок пока нет
- Calculo coeficientes transferencia calor intercambiadoresДокумент2 страницыCalculo coeficientes transferencia calor intercambiadoresgladysdcarloОценок пока нет
- TierrLa Tierra es el mayor de los planetas rocosos. Eso hace que pueda retener una capa de gases, la atmósfera, que dispersa la luz y absorbe calor. De día evita que la Tierra se caliente demasiado y, de noche, que se enfríe.aДокумент2 страницыTierrLa Tierra es el mayor de los planetas rocosos. Eso hace que pueda retener una capa de gases, la atmósfera, que dispersa la luz y absorbe calor. De día evita que la Tierra se caliente demasiado y, de noche, que se enfríe.aJESUS EMILIO BENAVIDES PATIÑOОценок пока нет
- Material compuesto de fibras de cisco de café para construcciónДокумент3 страницыMaterial compuesto de fibras de cisco de café para construcciónJairo MartinezОценок пока нет
- Degradacion Suelos/Caso de Estudio, EcuadorДокумент19 страницDegradacion Suelos/Caso de Estudio, EcuadorJair Montaño CañolaОценок пока нет
- MATRIZ DE LEOPOLD - ListadoДокумент8 страницMATRIZ DE LEOPOLD - ListadoDiego Arley Guzman LinaresОценок пока нет
- Mapa ConceptualДокумент1 страницаMapa ConceptualJhoner Diaz TellesОценок пока нет
- Tratado de Pedagogia y AntropologiaДокумент415 страницTratado de Pedagogia y AntropologiaJosé PalmaSantyagoОценок пока нет
- Ensayo Grupo 5-1Документ73 страницыEnsayo Grupo 5-1Franck Jara QuirozОценок пока нет
- Transferencia de Calor Por RadiaciónДокумент3 страницыTransferencia de Calor Por RadiaciónCristy López RivasОценок пока нет
- EL OBRAR COMO ACTUACIÓN EFICIENTEДокумент3 страницыEL OBRAR COMO ACTUACIÓN EFICIENTEingehuachanoОценок пока нет
- Balance de Materia y Energia ExposiciónДокумент38 страницBalance de Materia y Energia ExposiciónJimmy Wilder Gilbonio100% (1)
- Sem. 3 - Informe Estructura Del SueloДокумент29 страницSem. 3 - Informe Estructura Del SueloJose Fernando Lucar RoqueОценок пока нет
- Práctica de Laboratorio #3 I. TITULO: Presión en Una Jeringa Con Aire II. ObjetivoДокумент9 страницPráctica de Laboratorio #3 I. TITULO: Presión en Una Jeringa Con Aire II. ObjetivoLimberth JulioОценок пока нет
- Electroestática y propiedades de los átomosДокумент8 страницElectroestática y propiedades de los átomosEberto Leones100% (1)
- Ciencia ExperimentalДокумент19 страницCiencia ExperimentalMerlys SolorzanoОценок пока нет
- 1 Estudio Analisis de Peligro, Riesgos y VulnerabilidadДокумент24 страницы1 Estudio Analisis de Peligro, Riesgos y Vulnerabilidadjohnny florОценок пока нет
- Taller 1 - Física de SuelosДокумент4 страницыTaller 1 - Física de SuelosLyriomizaОценок пока нет
- Examen 3Документ9 страницExamen 3Ale SerranoОценок пока нет
- 2 PC Física II NivelacionДокумент1 страница2 PC Física II NivelacionJair Molina LopezОценок пока нет