Академический Документы
Профессиональный Документы
Культура Документы
Quimica Mapping
Загружено:
Lau CastruitaИсходное описание:
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Quimica Mapping
Загружено:
Lau CastruitaАвторское право:
Доступные форматы
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
UNIDAD I INTRODUCCIN Y CONCEPTOS FUNDAMENTALES
1.1 El estudio de la qumica.
La primera finalidad de la Qumica es averiguar cmo los materiales pueden identificarse o distinguirse, no en lo que se refiere a cuerpos u objetos representados por vocablos, como vaso o llave, sino ms bien por las substancias de que estn formados los objetos, expresadas por palabras como vidrio o hierro. La Qumica no est interesada en las propiedades accidentales o atributos tales como el tamao y la forma sino en las propiedades especficas de la clase de materia que pueden reconocerse en cualquier cuerpo formado por ella. As, por ejemplo, una moneda de plata, una copa de plata y un electrodo de plata difieren en tamao, forma, utilidad e incluso aspecto esttico, pero desde el punto de vista qumico son esencialmente lo mismo al estar formados por el mismo metal, la plata. Al contemplar nuestro mundo material se observan incesantes cambios en los que unos cuerpos desaparecen y se transforman en otros distintos. Estos cambios o transformaciones se conocen como reacciones qumicas. Muchas veces no nos interesamos en las nuevas substancias que se originan en las reacciones qumicas sino en la energa producida en las mismas. As, quemamos carbn en el hogar, no para obtener las cenizas que se forman y se van acumulando, ni para utilizar el dixido de carbono que escapa por la chimenea, sino para aprovechar el calor desprendido en su combustin. El estudio de las reacciones qumicas, esto es, la posibilidad de su realizacin, la extensin en que tienen lugar, la velocidad con que se verifican y las relaciones cuantitativas entre las substancias que intervienen en la transformacin o entre ellas y la energa desprendida o absorbida en la misma es la segunda finalidad de la Qumica. El mecanismo de las reacciones qumicas depende de la estructura ntima de las substancias y, en consecuencia, el objeto final de la Qumica es el de la constitucin de la materia, puesto que este conocimiento permite identificar y diferenciar las substancias, comprender sus propiedades y establecer su comportamiento frente a otras clases de substancias o bajo la accin de cualquier forma de energa. La Qumica no se limita al estudio de las substancias que componen los seres vivos e inanimados existentes sobre la tierra, as como de las que constituyen las estrellas, sino que, ms importante, extiende incluso su finalidad al descubrir incesantemente nuevas substancias que no se encuentran en la Naturaleza y cuyas propiedades y aplicaciones las hacen en muchsimos casos de incalculable valor.
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
1.2 Definicin de QUIMICA.
La qumica es el estudio integrado de la preparacin, propiedades, estructura y reacciones de los elementos y sus compuestos, as como de los sistemas que forman.
1.1.2 Porqu estudiar qumica?
La qumica es una disciplina cuyo objeto de estudio es la descripcin de las propiedades de las sustancias y los intercambios de materia que se establecen entre ellas, denominados reacciones qumicas. Dentro de las ciencias, la qumica es una de las ms entretenidas, pues con ella se puede aprender y conocer una serie de nuevos conceptos, los cuales se pueden poner a prueba por medio de la experimentacin. Sin embargo, la qumica no solo se encarga de estudiar los elementos qumicos, su estructura y organizacin en la tabla peridica y las reacciones qumicas en las cuales interactan. Es una ciencia integral y disciplinaria, pues por medio de su estudio podemos comprender otras ciencias, como la bioqumica, la biologa, la fisiologa y la fsico-qumica la mecnica y otras ingenieras.
1.1.3 Desarrollo de la qumica.
En la Qumica actual, en concreto, hay tres aspectos fundamentales: estructural, dinmico y de sntesis. El estructural, por cuando el conocimiento de la estructura de la materia resulta transcendental para el conocimiento y explicacin de sus propiedades. El dinmico, por ser el aspecto ms importante de la Qumica: el estudio de las transformaciones. La sntesis, por constituir la manifestacin ms importante en Qumica: preparar sustancias con propiedades determinadas. La Qumica debe dar cuenta de las relaciones entre todos estos aspectos sobre bases tericas, que encuentran fundamento en los avances de la Fsica y el impacto de las Matemticas. La Mecnica cuntica aport las bases tericas para un conocimiento estructural de la materia y una comprensin de sus propiedades.
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
La termodinmica y la cintica de reacciones alcanzaron un desarrollo satisfactorio para el estudio de las transformaciones qumicas. Sobre estas bases avanz de forma asombrosa, destacando fundamentalmente la preparacin de numerossimos complejos y compuestos organometlicos, de elementos y compuestos en estado de alta pureza, etc.
1.1.4 Campos e importancia de la qumica. Las disciplinas de la qumica han sido agrupadas por la clase de materia que estudian y se divide en la qumica inorgnica y la qumica orgnica. La bioqumica, que es el estudio de substancias en organismos biolgicos; la fsico-qumica, comprende los aspectos energticos de sistemas qumicos a escalas macroscpicas, moleculares y atmicas; la qumica analtica, que analiza muestras de materia tratando de entender su composicin y estructura. Otras ramas de la qumica han emergido en tiempos recientes, por ejemplo, la neuroqumica que estudia los aspectos qumicos del cerebro.
1.2 Materia y Energa.
La materia en s no contiene calor, lo que contiene es energa. El calor representa la energa transferida de un cuerpo con mayor temperatura a otro con menor temperatura. Concluida la transferencia, la energa deja de ser calor y pasa a ser energa interna.
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Mapa conceptual que muestra la categorizacin de la materia, dependiendo de las caractersticas y composicin de las sustancias constituyentes.
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Energa El movimiento de los constituyentes de la materia, los cambios qumicos y fsicos y la formacin de nuevas sustancias se originan gracias a cambios en la energa del sistema; conceptualmente, la energa es la capacidad para realizar un trabajo o transferir calor; la energa a su vez se presenta como energa calrica, energa mecnica, energa qumica, energa elctrica y energa radiante; estos tipos de energa pueden ser adems potencial o cintica. La energa potencial es la que posee una sustancia debido a su posicin espacial o composicin qumica y la energa cintica es la que posee una sustancia debido a su movimiento.
Tipos de energa Manifestaciones de la energa
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Energa Mecnica: El movimiento de las hlices del molino de viento es transferido a un sistema mecnico de piones, para producir energa elctrica o lograr la ascensin de agua de un pozo subterrneo
Energa Calrica o radiante: El calor o la luz emitida desde el sol es aprovechada por las plantas para producir energa qumica en forma de carbohidratos.
Energa Elctrica: El movimiento de electrones libres, produce la energa elctrica, usada para hacer funcionar electrodomsticos, trenes, y artefactos industriales.
Energa Qumica: La combustin de hidrocarburos como el petrleo, liberan gran cantidad de energa.
Formas de medicin de la energa
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Poseer un referente de la cantidad de energa que se intercambia en las diferentes interacciones de la materia requiere de patrones de medicin. Como la forma de energa que tiene mayor expresin es la energa calrica, entendida sta como la energa que se intercambia entre dos sustancias cuando existe diferencias de temperatura entre ambas, trataremos las unidades de medida de esta. La cantidad de energa cedida o ganada por una sustancia se mide en caloras o joules. Una calora (cal) es igual a la cantidad de calor necesario para elevar de 14,5o C a 15,5o C 1 gramo de agua. Como factor de conversin diremos que una calora equivale a 4,184 joules.
1 cal = 4,184 J
Es necesario diferenciar la calora utilizada como herramienta de medicin de la energa calrica en qumica, de la calora utilizada en nutricin, ya que la calora contenida en los alimentos (Cal) o gran calora, equivale a 1.000 caloras o 1 Kilocalora (Kcal).
1.2.1 Definiciones bsicas. MATERIA Materia es todo lo que tiene masa y ocupa un lugar en el espacio; Masa es la cantidad de materia que tiene un cuerpo; Volumen es el espacio ocupado por la masa Cuerpo es una porcin limitada de materia
Mezcla homognea Es aquella que es uniforme en su composicin y en sus propiedades y presenta una sola fase, ejemplo de ello sera un refresco gaseoso, la solucin salina, el Cloruro de Sodio o sal de cocina; este tipo de materia se presenta en formas homogneas, soluciones y sustancias puras. Mezcla heterognea
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Es aquella que carece de uniformidad en su composicin y en sus propiedades y presenta dos o ms fases, ejemplo de ello sera la arena, el agua con aceite; este tipo de materia es tambin conocida como mezcla y se caracteriza por el mantenimiento de las propiedades de los componentes y la posibilidad que existe de separarlos por medio de mtodos fsicos. Sustancias puras, elementos y compuestos Sustancia pura Una sustancia es pura cuando se encuentra compuesta por uno o ms elementos en proporciones definidas y constantes y cualquier parte de ella posee caractersticas similares, definidas y constantes; podramos decir que una sustancia es pura cuando se encuentra compuesta en su totalidad por ella y no contiene cantidades de otras sustancias; ejemplos de ello seran la sacarosa, el agua, el oro. Elemento: Sustancia pura imposible de descomponer mediante mtodos qumicos ordinarios, en dos o ms sustancias, ejemplo: el Hidrgeno (H), el Oxgeno (O), el Hierro (Fe), el Cobre (Cu). Compuesto: Sustancia pura posible de descomponer mediante mtodos qumicos ordinarios, en dos o ms sustancias, ejemplos: El agua (H2O), la sal (NaCl), el cido Sulfrico (H2SO4).
Calor especifico El calor especfico es la cantidad de calor necesario para elevar la temperatura de una sustancia determinada; desde el punto de vista qumico, es la cantidad de caloras requeridas para elevar en un grado centgrado la temperatura de un gramo de una sustancia, o es el nmero de joules requeridos para elevar en un grado kelvin la temperatura de un kg de una sustancia.
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Calor Especfico del agua: 1 cal/g o C Este valor significa que para elevar 1 grado centgrado la temperatura de 1 g de agua, se requiere 1 calora.
Calor Especifico del Aluminio: 0,217 cal/g o C Este valor significa que para elevar 1 grado centgrado la temperatura de 1 g de Aluminio se requieren 0,217 caloras.
Valores comparativos del calor especfico del agua en estado lquido y el aluminio en estado slido. Ley de la conservacin de Masa-Energa Para concluir esta parte temtica, abordemos una pregunta: en el momento de ocurrir un cambio fsico o qumico (reaccin qumica) en una sustancia, existe perdida de masa y/o energa? Antoine Laurent Lavoiser (743-1749) y James Prescott Joule (1818-1889), dedicaron parte de su trabajo cientfico en la solucin de este problema, llegando a la conclusin de que en las reacciones qumicas y en los cambios fsicos las masas de las sustancias participantes no se crean ni destruyen, solo se transforman; esta conclusin se conoce con el nombre de Ley de la conservacin de la masa.
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
En este ejemplo de reaccin qumica, 4.032 g de Hidrgeno gaseoso, reaccionan con 141.812 g de cloro gaseoso, para formar 145.844 g de cido clorhdrico. La suma de los reactivos es igual a la suma de los productos. La masa de los reactivos no se destruy, estos se combinaron y se transformaron en una nueva sustancia. Ejemplo de la ley de la conservacin de la materia: formacin del cido clorhdrico, mediante la reaccin del Hidrgeno con el Cloro.
1.2.2 Estados de la materia
Estados fsicos de la materia En trminos conceptuales, materia se puede definir como cualquier sustancia que posee masa y ocupa un lugar en el espacio (volumen); la cual como cualquier otro componente de la naturaleza reacciona a factores ambientales como la presin y la temperatura, manifestndose en tres estados: Gaseoso. Lquido. Slido. Gel o plasma. Estos estados obedecen fundamentalmente a la energa cintica o energa de movimiento de las molculas que conforman dicha materia y a la forma de agregacin de las mismas.
10
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Los estados de la materia dependen de Factores del ambiente como presin y temperatura.
Estados de la materia en relacin a cambios de la temperatura del ambiente
11
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Los diferentes estados de la materia se caracterizan por la energa cintica de las molculas y los espacios existentes entre estas.
Estados de la materia en relacin a cambios de la energa cintica de las molculas
Cada uno de los estados le confiere a la materia caractersticas propias, a pesar de no cambiar su composicin. La figura siguiente complementa los conceptos aqu formulados, obsrvelo haciendo nfasis en las relaciones y diferentes vas existentes:
Los estados de la materia: efecto de las condiciones del medio Principales Caractersticas de los estados de la materia
12
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
SLIDOS Poseen forma definida. Poseen volumen fijo. Baja compresibilidad.
LQUIDOS
GASES
No poseen forma definida, por No poseen forma definida, por lo lo tanto adoptan la forma del tanto adoptan la forma del recipiente que los contiene. recipiente que los contiene. Poseen volumen fijo. Compresin limitada. Poseen volumen variable. Alta Compresibilidad.
1.2.3 Sustancias puras y mezclas. La materia se clasifica en sustancias puras y mezclas, las cuales a su vez se clasifican en elementos, compuestos, mezclas homogneas o soluciones y mezclas heterogneas, tal como est ilustrado en el siguiente esquema:
INCLUDEPICTURE "http://www.amschool.edu.sv/Paes/science/la_mat1.gif" \*
MERGEFORMATINET INCLUDEPICTURE "http://www.amschool.edu.sv/Paes/science/la_mat2.gif" \* MERGEFORMATINET
13
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N. Las sustancias puras son aquellas que son uniformes (homogneas) y tienen una composicin definida o determinada. Los elementos y los compuestos comprenden las sustancias puras. Estas sustancias no pueden ser separadas fsicamente sino nicamente por medios qumicas, cambiando as sus propiedades mediante la separacin. Las mezclas son aquellas combinaciones fsicas de dos o ms sustancias puras, cada una de las cuales mantienen sus propiedades dentro de la combinacin. La composicin de las mezclas es variable y su separacin puede ser mediante medios fsicos o mecnicos, como la filtracin, la decantacin y la destilacin. Dentro de las mezclas estn aquellas que son homogneas, comnmente denominadas soluciones (disoluciones), las cuales son uniformes ante la observacin y tienen los componentes en una sola fase. Las mezclas heterogneas constan de dos o ms fases, por lo cual no son uniformes.
Sustancias Puras
Mezclas
composicin definida separadas qumicamente, pierden propiedades ante la separacin comprenden elementos y compuestos
composicin variable separadas fsicamente, componentes conservan propiedades ante la separacin comprenden mezclas homogneas y heterogneas
1.2.4 Separacin de muestras Destilacin.
14
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
La destilacin es el procedimiento ms utilizado para la separacin y purificacin de lquidos, y es el que se utiliza siempre que se pretende separar un lquido de sus impurezas no voltiles.
La destilacin, como proceso, consta de dos fases: en la primera, el lquido pasa a vapor y en la segunda el vapor se condensa, pasando de nuevo a lquido en un matraz distinto al de destilacin. Evaporacin. Consiste en calentar la mezcla hasta el punto de ebullicin de uno de los componentes, y dejarlo hervir hasta que se evapore totalmente. Este mtodo se emplea si no tenemos inters en utilizar el componente evaporado. Los otros componentes quedan en el envase. Un ejemplo de esto se encuentra en las Salinas. All se llenan enormes embalses con agua de mar, y los dejan por meses, hasta que se evapora el agua, quedando as un material slido que contiene numerosas sales tales como cloruro de slido, de potasio, etc Centrifugacin. Es un procedimiento que se utiliza cuando se quiere acelerar la sedimentacin. Se coloca la mezcla dentro de una centrifuga, la cual tiene un movimiento de rotacin constante y rpido, logrndose que las partculas de mayor densidad, se vayan al fondo y las ms livianas queden en la parte superior.
15
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
CENTRIFUGADORA Un ejemplo lo observamos en las lavadoras automticas o semiautomticas. Hay una seccin del ciclo que se refiere a secado en el cual el tambor de la lavadora gira a cierta velocidad, de manera que las partculas de agua adheridas a la ropa durante su lavado, salen expedidas por los orificios del tambor. Levigacin. Se utiliza una corriente de agua que arrastra los materiales ms livianos a travs de una mayor distancia, mientras que los ms pesados se van depositando; de esta manera hay una separacin de los componentes de acuerdo a lo pesado que sean. Imantacin. Se fundamenta en la propiedad de algunos materiales de ser atrados por un imn. El campo magntico del imn genera una fuente atractora, que si es suficientemente grande, logra que los materiales se acerquen a l. Para poder usar este mtodo es necesario que uno de los componentes sea atrado y el resto no.
Cromatografa de Gases.
La cromatografa es una tcnica cuya base se encuentra en diferentes grados de absorcin, que a nivel superficial, se pueden dar entre diferentes especies qumicas. En la cromatografa de gases, la mezcla, disuelta o no, es transportada por la primera especie qumica sobre la segunda, que se encuentran inmvil formando un lecho o camino. Ambos materiales utilizarn las fuerzas de atraccin disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmvil para que se queden adheridos a su superficie.
16
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Cromatografa en Papel. Se utiliza mucho en bioqumica, es un proceso donde el absorbente lo constituye un papel de Filtro. Una vez corrido el disolvente se retira el papel y se deja secar, se trata con un reactivo qumico con el fin de poder revelar las manchas. En la cromatografa de gases, la mezcla, disuelta o no, es transportada por la primera especie qumica sobre la segunda, que se encuentran inmvil formando un lecho o camino. Ambos materiales utilizarn las fuerzas de atraccin disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmvil para que se queden adheridos a su superficie. Decantacin. Consiste en separar materiales de distinta densidad. Su fundamento es que el material ms denso
En la cromatografa de gases, la mezcla, disuelta o no, es transportada por la primera especie qumica sobre la segunda, que se encuentran inmvil formando un lecho o camino. Ambos materiales utilizarn las fuerzas de atraccin disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmvil para que se queden adheridos a su superficie.
17
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Tamizado. Consiste en separar partculas slidas de acuerdo a su tamao. Prcticamente es utilizar coladores de diferentes tamaos en los orificios, colocados en forma consecutiva, en orden decreciente, de acuerdo al tamao de los orificios. Es decir, los de orificios ms grandes se encuentran en la parte superior y los ms pequeos en la inferior. Los coladores reciben el nombre de tamiz y estn elaborados en telas metlicas.
Filtracin. Se fundamenta en que alguno de los componentes de la mezcla no es soluble en el otro, se encuentra uno slido y otro lquido. Se hace pasar la mezcla a travs de una placa porosa o un papel de filtro, el slido se quedar en la superficie y el otro componente pasar. Se pueden separar slidos de partculas sumamente pequeas, utilizando papeles con el tamao de los poros adecuados.
18
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
1.2.5 Elementos.
Un elemento qumico es un tipo de materia, constituida por tomos de la misma clase. En su forma ms simple posee un nmero determinado de protones en su ncleo, hacindolo pertenecer a una categora nica clasificada con el nmero atmico, aun cuando este pueda ostentar distintas masas atmicas. Es un tomo con caractersticas fsicas nicas, que por tradicin se define como aquella sustancia que no puede ser descompuesta mediante una reaccin qumica, en otras ms simples. No existen dos tomos de un mismo elemento con caractersticas distintas y, en el caso de que estos posean masa distinta, pertenecen al mismo elemento pero en lo que se conoce como uno de sus istopos. Tambin es importante diferenciar entre un elemento qumico de una sustancia simple.
1.2.6 Compuestos.
Un compuesto es una sustancia formada por la unin de dos o ms elementos de la tabla peridica, en una razn fija. Una caracterstica esencial es que tiene una frmula qumica. Por ejemplo, el agua es un compuesto formado por hidrgeno y oxgeno en la razn de 2 a 1 (en nmero de tomos).
19
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
1.3 Propiedades de la materia.
Las propiedades generales de la materia se presentan tanto en la materia como en los cuerpos que son porciones de la misma. Si el color verde fuera propiedad general de la materia, todos los cuerpos seran verdes; como no es as, el color verde nicamente es propiedad especfica de algunos cuerpos. Las principales propiedades generales son: Extensin. Todos los cuerpos ocupan un lugar en el espacio. El lugar que ocupa un cuerpo es su volumen. Impenetrabilidad. Como cada cuerpo ocupa un lugar en el espacio, su lugar no puede ser ocupado al mismo tiempo por otro cuerpo. Inercia. Consiste en la tendencia que tienen los cuerpos de continuar en su estado de reposo o movimiento en que se encuentran si no hay una fuerza que los cambie. Masa. Es la cantidad de materia contenida en un volumen cualquiera, la masa de un cuerpo es la misma en cualquier parte de la Tierra o en otro planeta. Peso. Es la accin de la gravedad de la Tierra sobre los cuerpos. En los lugares donde la fuerza de gravedad es menor, por ejemplo, en una montaa o en la Luna, el peso de los cuerpos disminuye. Divisibilidad. Es la propiedad que tiene cualquier cuerpo de poder dividirse en pedazos ms pequeos, hasta llegar a las molculas y los tomos. Porosidad. Como los cuerpos estn formados por partculas diminutas, stas dejan entre s espacios vacos llamados poros. Elasticidad. Propiedad que tienen los cuerpos de cambiar su forma cuando se les aplica una fuerza adecuada y de recobrar la forma original cuando se suspende la accin de la fuerza.
20
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N. La elasticidad tiene un lmite, si se sobrepasa el cuerpo sufre una deformacin permanente o se rompe. Hay cuerpos especiales en los cuales se nota esta propiedad, como en una liga, en la hoja de un cuchillo; en otros, la elasticidad se manifiesta poco, como en el vidrio o en la porcelana. Propiedades particulares Son las que tienen determinadas clases de materia, entre ellas tenemos las siguientes: Dureza. Es la resistencia que opone un cuerpo al corte, a la penetracin y a ser rayado. La materia ms dura que se conoce es el diamante. Son muy blandos la cera, el jabn, etctera. Tenacidad. Es la resistencia que ofrece un cuerpo a romperse o a deformarse cuando se le golpea. Lo contrario a la tenacidad es la fragilidad. El acero es tenaz y el vidrio es frgil. Ductilidad. Es la propiedad que tienen algunas materias, principalmente los metales, de estirarse para formar hilos o alambres. Se elaboran alambres de hierro, cobre, aluminio. El oro y la plata son de los ms dctiles porque con ellos se obtienen los hilos ms delgados. Maleabilidad. Consiste en la facilidad que tienen algunas materias para extenderse en lminas. Los metales son maleables. Se hacen lminas de hierro, zinc, estao, etc. El oro es el ms maleable, sus lminas pueden ser tan delgadas que son transparentes y flotan en el aire. Propiedades especficas Las propiedades especficas de algunas sustancias sirven para distinguir unas sustancias de otras. Propiedades especificas son el color, el brillo, el sabor, el olor, el punto de ebullicin, el peso especfico, etctera. La naftalina se reconoce por su color blanco y su olor caracterstico. El azcar, por su color blanco y su sabor dulce. El agua tiene como propiedades especficas el hervir a los 100 C, y un peso especfico de un gramo por cada centmetro cbico de volumen. El alcohol se distingue por su olor, su punto de ebullicin que es de 72 C y su peso especfico que es menor al del agua.
21
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N. Peso especfico. Es el peso en gramos de un centmetro cbico de una sustancia.
1.3.1 Cambios fsicos y qumicos
Cambios fsicos y cambios qumicos Las modificaciones en la presin, la temperatura o las interrelaciones de las sustancias, pueden originar cambios fsicos o qumicos en la materia. Cambios fsicos de la materia: Son aquellos cambios que no generan la creacin de nuevas sustancias, lo que significa que no existen cambios en la composicin de la materia, como se ve en la figura siguiente.
El cambio fsico se caracteriza por la no existencia de reacciones qumicas y de cambios en la composicin de la materia.
Cambio fsico de la materia: cambio de estado slido (hielo) a estado lquido del agua, mediante el aumento en la temperatura del sistema.
Cambios qumicos: Son aquellos cambios en la materia que originan la formacin de nuevas sustancias, lo que indica que existieron reacciones qumicas.
22
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
El cambio Qumico de la materia se caracteriza por la existencia de reacciones qumicas, de cambios en la composicin de la materia y la formacin de nuevas sustancias.
Cambio Qumico de la materia: Formacin de cido Clorhdrico, mediante la reaccin de Cloro e Hidrgeno. Observe que en los cambios qumicos la materia sometida al cambio posee unas caractersticas diferentes a la materia inicial.
. . . 1.3.2 Propiedades fsicas y qumicas.
La sustancias en el mundo, tal y como lo conocemos, se caracterizan por sus propiedades fsicas o qumicas, es decir, cmo reaccionan a los cambios sobre ellas. Las propiedades fsicas son aquellas que se pueden medir, sin que se afecte la composicin o identidad de la sustancia. Podemos poner como ejemplo, el punto de fusin (ejemplo del agua). Las propiedades Qumicas, las cuales se observan cuando una sustancia sufre un cambio qumico, es decir, en su estructura interna, transformndose en otra sustancia, dichos cambios qumicos, son generalmente irreversibles. (Ejemplo: formacin de agua, huevo cocido, madera quemada). Las propiedades que caracterizan la materia son las Extensivas e Intensivas, las propiedades Extensivas se caracterizan porque dependen de la cantidad de materia presente. La masa es una propiedad Extensiva, mas materia significa ms masa, adems, las propiedades Extensivas se pueden sumar (son aditivas), el Volumen tambin lo es. Las propiedades Intensivas, no dependen de la cantidad de masa, adems, no son aditivas, tenemos un ejemplo, la densidad, esta no cambia con la cantidad de materia, la temperatura tambin es una propiedad intensiva.
23
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
Propiedades de la materia: GENERALES: volumen, inercia, peso, porosidad, impenetrabilidad. ESPECIFICAS: punto de fusin, punto de ebullicin, peso especifico, densidad, ndice de refraccin, solubilidad. FISICAS: cambios de estado, estado fsico, olor, color, sabor, dureza. QUIMICAS: combustibilidad, comburencia, carcter oxidante, carcter reductor. 1.4 Unidades de medicin.
Para el estudio de la qumica se utilizan parmetros establecidos por el hombre, todas las mediciones son arbitrarias, pero no en el sentido del desorden, no, en el sentido que fueron escogidas por el hombre a su conveniencia. En un laboratorio, existen aparatos para medir, longitud, masa, volumen, etc. Las propiedades de la materia pueden ser Microscpicas y Microscpicas, las primeras se pueden determinar directamente, y las segundas son a nivel molecular o atmico, deben ser determinadas por mtodos indirectos.
1.4.1 Unidades SI.
SISTEMA INTERNACIONAL DE MEDIDAS La unidad de una medicin indica una escala o un standard que se usa para representar los resultados de un sistema. A partir de 1960 la Conferencia general de pesos y medidas, propuso un Sistema Internacional de Unidades (SI, del francs, Systeme Internationale d'United).
1.4.2 Longitud y masa. Longitud: Es la distancia del segmento lineal que une a dos puntos. El metro se define en trminos de la longitud de onda de un cierto color del espectro electromagntico. Masa: Es la medida de la cantidad de materia. En el sistema SI la masa se define como 1 Kg. 1.4.3 Temperatura. El calor es una forma de energa. El calor siempre fluye de una regin de mayor intensidad a otra de menor intensidad. La temperatura es una medida de la intensidad de calor. El instrumento mas comn para medir las intensidades calorficas es el termmetro. 24
UNIVERSIDAD AUTNOMA DE COAHUILA
Facultad de Ingeniera Mecnica y Elctrica U.N.
1.4.4 Unidades SI derivadas 1.4.5 Volumen. 1.4.6 Densidad. 1. 1.4.7 Prefijos y exponentes.
5 Manejo de nmeros. 1.5.1 Precisin y exactitud. 1.5.2 Cifras significativas. 1.5.3 Notacin cientfica. 1.5.4 Redondeo. 1.6 Anlisis dimensional. 1.6.1 Factores de conversin. 1.6.2 Aplicacin.
25
Вам также может понравиться
- Fisicoquímica II: Materia, electricidad y magnetismo. Fuerzas y camposОт EverandFisicoquímica II: Materia, electricidad y magnetismo. Fuerzas y camposОценок пока нет
- Descripcion de La QuimicaДокумент6 страницDescripcion de La Quimicacibermarifer100% (2)
- Manual AMAE03Документ124 страницыManual AMAE03erani62Оценок пока нет
- Taller N4. Algunos Básicos de QuímicaДокумент4 страницыTaller N4. Algunos Básicos de QuímicaTatiana CostézОценок пока нет
- QUIMICAДокумент133 страницыQUIMICABrándon Alfredo RecinosОценок пока нет
- 1 Define Los Siguientes ConceptosДокумент4 страницы1 Define Los Siguientes Conceptosdrindys16853826Оценок пока нет
- La Naturaleza de La Quimica General I PDFДокумент9 страницLa Naturaleza de La Quimica General I PDFCeilimar AguiñoОценок пока нет
- TEXTO de Actividad Fisica y QuimicaДокумент3 страницыTEXTO de Actividad Fisica y QuimicavalejymОценок пока нет
- Conclusion 1Документ15 страницConclusion 1DIANAОценок пока нет
- Curso de NivelaciónДокумент52 страницыCurso de Nivelaciónvaleria sanchezОценок пока нет
- Modulo Quimica 10Документ73 страницыModulo Quimica 10John Visbal Hernandez100% (1)
- CAÑÓN ElectroquimicoДокумент28 страницCAÑÓN ElectroquimicoVanessa Molina40% (5)
- CARATULAДокумент29 страницCARATULAdani blogsОценок пока нет
- Modulo 1 ECGДокумент29 страницModulo 1 ECGSara GuzmánОценок пока нет
- Tarea QumicaДокумент5 страницTarea QumicaEduardo SotoОценок пока нет
- Antecedentes de La QuimicaДокумент9 страницAntecedentes de La QuimicaJose Gpe Reyes67% (9)
- Química Sus Ramas Modelo Atomico de Rutheford y BohrДокумент21 страницаQuímica Sus Ramas Modelo Atomico de Rutheford y BohrdjesusunefaОценок пока нет
- Los Paradigmas de La QuimicaДокумент7 страницLos Paradigmas de La QuimicaIsa Fernández Bedoya100% (1)
- Presentación Tema 10 2021.Документ30 страницPresentación Tema 10 2021.Maria Valle AlbaОценок пока нет
- Resumen Primer Parcial - Andy Josue Areano Giron 20191033435Документ30 страницResumen Primer Parcial - Andy Josue Areano Giron 20191033435An- DОценок пока нет
- Química Inorgánica TareaДокумент3 страницыQuímica Inorgánica TareaRhadel RosarioОценок пока нет
- Cuestionario de Introducción A La QuimicaДокумент9 страницCuestionario de Introducción A La QuimicaemileannyОценок пока нет
- Deficion de La Quimica e HistoriaДокумент2 страницыDeficion de La Quimica e HistoriaRolando MichelОценок пока нет
- Qué Es La QuímicaДокумент12 страницQué Es La QuímicaRomina RodríguezОценок пока нет
- Ciencias Auxiliares de La QuimicaДокумент4 страницыCiencias Auxiliares de La QuimicaloyrusОценок пока нет
- Quimica Primer Año de BachilleratoДокумент5 страницQuimica Primer Año de BachilleratoIP Mary25% (4)
- Documento Que Es La QuimicaДокумент10 страницDocumento Que Es La Quimicaedgar omar velazquez avilaОценок пока нет
- Trabajo Práctico #1 QuimicaДокумент11 страницTrabajo Práctico #1 QuimicaFederico FretesОценок пока нет
- Libro de QuímicaДокумент3 страницыLibro de QuímicaSegundo Noe Flores SanchezОценок пока нет
- FisicoquimicaДокумент4 страницыFisicoquimicaJavier BernardoОценок пока нет
- 20 Conceptos de QuimicaДокумент3 страницы20 Conceptos de QuimicaRicardo MarZaОценок пока нет
- Química para DummiesДокумент11 страницQuímica para DummiesAnonymous 3snKQJp25% (4)
- Inorganica TeoДокумент259 страницInorganica TeoDiego OttonelloОценок пока нет
- Tema 10 Fenómenos FísicosДокумент20 страницTema 10 Fenómenos FísicosAlejandro Díaz GonzálezОценок пока нет
- Quimica-Todo Sobre La MateriaДокумент27 страницQuimica-Todo Sobre La MateriaMauricio Vargas RojasОценок пока нет
- Ciencias Basicas y La ElectricidadДокумент17 страницCiencias Basicas y La ElectricidadDAMIANAОценок пока нет
- QuímicaДокумент8 страницQuímicaLuis Alonso Pumarrumi MarceloОценок пока нет
- Química Del Carbono 2año Faciano SilvanaДокумент3 страницыQuímica Del Carbono 2año Faciano Silvanaraul benjaminОценок пока нет
- Tema 1 Introducción A La Física y FisicoquímicaДокумент36 страницTema 1 Introducción A La Física y FisicoquímicaMoco LocoОценок пока нет
- Guia 10° 2018Документ78 страницGuia 10° 2018Patricia Gómez Quintero0% (1)
- AstroquímicaДокумент4 страницыAstroquímicaSofia SanchezОценок пока нет
- La Química Es La Ciencia Que Estudia La ComposiciónДокумент4 страницыLa Química Es La Ciencia Que Estudia La ComposiciónJosé MiguelОценок пока нет
- Ciencia y MateriaДокумент3 страницыCiencia y Materiakatherine.ruiz2912Оценок пока нет
- GUIA QUÍMICA GENERAL 2020-Convertido1Документ35 страницGUIA QUÍMICA GENERAL 2020-Convertido1Lino AndresОценок пока нет
- Guia Química General 2020 PDFДокумент82 страницыGuia Química General 2020 PDFEvelin CarpioОценок пока нет
- Teoria de QuímicaДокумент7 страницTeoria de QuímicaLuis Diego Aguilar Lizarraga100% (1)
- ingreso2016-IngenieriaQuimic UNCДокумент146 страницingreso2016-IngenieriaQuimic UNCUrssi MurciОценок пока нет
- Introducción A La Química...Документ13 страницIntroducción A La Química...Nayeli ValverdeОценок пока нет
- Qui MicaДокумент90 страницQui MicaDavid ApazaОценок пока нет
- Portafolio Del Curso de Quimica AvanseДокумент9 страницPortafolio Del Curso de Quimica AvanseGabriela Quispe MoranОценок пока нет
- Apuntes de QuimicaДокумент200 страницApuntes de QuimicaLuís FernándezОценок пока нет
- QuímicaДокумент16 страницQuímicaNahomi MirandaОценок пока нет
- QUIMICAДокумент11 страницQUIMICADayan MonroyОценок пока нет
- Ramas Química OrganometálicaДокумент10 страницRamas Química OrganometálicaElmer GarcíaОценок пока нет
- Taller de QuimicaДокумент4 страницыTaller de Quimicayenifer riveraОценок пока нет
- Química Tecnica UesДокумент29 страницQuímica Tecnica UesSteliosОценок пока нет
- Quimica ConceptosДокумент8 страницQuimica ConceptosEMYОценок пока нет
- 1 - Introducción Al Estudio de La Química y Conceptos FundamentalesДокумент5 страниц1 - Introducción Al Estudio de La Química y Conceptos FundamentalesJose RamosОценок пока нет
- Unidad 1-2Документ33 страницыUnidad 1-2Alumnos UCongresoОценок пока нет
- Sistema Preventivo Salesiano (Don Bosco) )Документ1 страницаSistema Preventivo Salesiano (Don Bosco) )Yilder Ruiz SalinasОценок пока нет
- Preguntero OratoriaДокумент26 страницPreguntero Oratoriaale80% (5)
- Sika RodДокумент3 страницыSika Rodpmendonic3738Оценок пока нет
- Guía Metodológica de Educación AmbientalДокумент69 страницGuía Metodológica de Educación AmbientalMariangela PrietoОценок пока нет
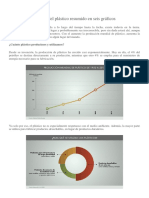
- El Problema Mundial Del Plástico Resumido en Seis GráficosДокумент5 страницEl Problema Mundial Del Plástico Resumido en Seis GráficosMarian ElizabethОценок пока нет
- Coraggio Jose Luis - Economia Urbana - La Perspectiva PopularДокумент0 страницCoraggio Jose Luis - Economia Urbana - La Perspectiva PopularagustinmaceioОценок пока нет
- Prototipo y Pruebas - Design ThinkingДокумент22 страницыPrototipo y Pruebas - Design Thinkingjehu alanisОценок пока нет
- Resumen de La Conquista de La FelicidadДокумент5 страницResumen de La Conquista de La FelicidadsalgoraОценок пока нет
- Unidad 1 - Fase 2-Costos y PresupuestosДокумент8 страницUnidad 1 - Fase 2-Costos y PresupuestosCASA DE PASO IPSI MINGAОценок пока нет
- Conceptos BásicosДокумент14 страницConceptos BásicosWillyAlegriaОценок пока нет
- La Agroindustria en La Republica DominicanaДокумент2 страницыLa Agroindustria en La Republica DominicanaAngélica Nuñez GorisОценок пока нет
- Entrevista DinámicaДокумент2 страницыEntrevista DinámicaJennifer Escobedo MartellОценок пока нет
- Loros NicaraguaДокумент128 страницLoros NicaraguaJust... Me.Оценок пока нет
- Actividad - Introducción A Las FuncionesДокумент3 страницыActividad - Introducción A Las FuncionesCarlos RealpeОценок пока нет
- Portada Trabajos Act 2Документ4 страницыPortada Trabajos Act 2jose luisОценок пока нет
- Políticas, Normas y Procedimientos para La Elaboración de SistemasДокумент13 страницPolíticas, Normas y Procedimientos para La Elaboración de SistemasAlgys MojicaОценок пока нет
- Compendio RV 1° PDFДокумент30 страницCompendio RV 1° PDFHugoОценок пока нет
- Entrevista ElectromecanicoДокумент3 страницыEntrevista ElectromecanicoDaniel Cruz67% (3)
- El Martillo de La Historia - S11Документ2 страницыEl Martillo de La Historia - S11Patrick DanielОценок пока нет
- Funciones PLДокумент15 страницFunciones PLCristina Palacios SanchezОценок пока нет
- Conectores de BúsquedaДокумент8 страницConectores de BúsquedaValentina RomeroОценок пока нет
- Trabajo Sobre La VIOLACIONДокумент10 страницTrabajo Sobre La VIOLACIONPablo HdezvazОценок пока нет
- Libro Artroplastia de Cadera - Junta de AndaluciaДокумент133 страницыLibro Artroplastia de Cadera - Junta de AndaluciaMelisa Agustina TobarОценок пока нет
- Tesis Sistema Factura ClipperДокумент96 страницTesis Sistema Factura ClipperDonald Cajina100% (1)
- 88 Preguntas A Un NaziДокумент16 страниц88 Preguntas A Un NaziAndres AndfiredОценок пока нет
- Fenomeno Capilar y Proceso de ContraccionДокумент20 страницFenomeno Capilar y Proceso de ContraccionJhon Vargas100% (1)
- Examen Final - Semana 8 - INV - PRIMER BLOQUE-ORGANIZACION Y METODOSДокумент8 страницExamen Final - Semana 8 - INV - PRIMER BLOQUE-ORGANIZACION Y METODOSluisferОценок пока нет
- Tipos de PeritosДокумент27 страницTipos de PeritossusanaОценок пока нет
- Identifique El Tipo de Lenguaje Empleado y Anote El Nmero Que Correspond AДокумент3 страницыIdentifique El Tipo de Lenguaje Empleado y Anote El Nmero Que Correspond Amedea2mil2534Оценок пока нет