Академический Документы
Профессиональный Документы
Культура Документы
Equilíbrio Químico - Exercícios
Загружено:
Jean FrankИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Equilíbrio Químico - Exercícios
Загружено:
Jean FrankАвторское право:
Доступные форматы
Exerccios EQUILBRIO QUMICO
1.
Prof. Leori
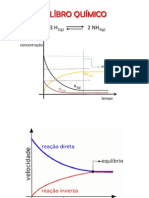
Escreva expresses para Kc para os sistemas a) 2 SO3 (g) 2 SO2 (g) + O2 (g) b) CuO (s) + H2 (g) Cu (s) + H2O (g)
Suponha que a reao em 1 (b) seja efetuada a uma temperatura baixa suficiente para permitir a presena da gua lquida. Qual a expresso para Kc? 3. Quando cloreto de amnio aquecido, ele atinge o equilbrio com amnia e cloreto de hidrognio:
2.
NH4CI(s)
NH3(g) + HCI(g)
Foi determinado que, no equilbrio a 500C em um recipiente de 5,0 L, h 2,0 moles de NH3. 2,0 moles de HCI e 1,0 mol de NH4CI. Calcule Kc para este sistema a 500C. 4. Suponha que, para o sistema mencionado no exerccio nmero 1: a) [SO2] = [O2] = 0,10 mol/L e [SO3] = 0,20 mol/L. Calcule Kc .
5.
Considere o equilbrio representado pela Equao (I). Suponha que comecemos com HI puro a uma concentrao de 0,100 mol/L a 520C. A concentrao de equilbrio do H2 0.010 mol/L. Calcule a. [I2], b. [HI], 2 HI (g) c. Kc para a reao (I) H2 (g) + I2 (g) (I)
6. Suponha que, a uma temperatura diferente, comecemos com HI puro a 0,100 mol/L e que sua concentrao no equilbrio seja 0, 074 mol/L. Qual o valor de Kc a esta temperatura? (Ver equao (I)) 7. Para o sistema em equilbrio, N2(g) + O2(g) 2 NO(g)
Kc 1 x 10-30 a 25oC. Suponha que, em uma mistura a 25C, as concentraes de N2 e O2 sejam 0,040 e 0,010 mol/L, respectivamente. Calcule a concentrao de equilbrio do NO.
8.
A 2000 oC, Kc para este sistema bem maior, cerca de 0,10. Calcule [NO] a 2000 o C se [N2] = 0,040 M, [O2] = 0,010 M.
9. Para o sistema CO2(g) + H2(g) CO(g) + H2O(g)
Kc 0,64 a 900 K. Suponha que comecemos com CO2 e H2, ambos a uma concentrao de 0,100 mol/L. Quando o sistema alcana o equilbrio, quais so as concentraes dos produtos e reagentes?
10. considere o sistema N2O4(g) 2 NO2(g) ; Kc = 0,36 a 100C
Suponha que comecemos com N2O4 puro a uma concentrao de 0,100 mol/L. Quais so as concentraes de equilbrio de NO2 e N2O4?
11. No
exerccio 5, vimos que este sistema est em equilbrio a 520C quando [Hl] = 0,080 mol/L e [H2] = [I2] = 0,010 mol/L. Suponha que a esta mistura adicionemos suficiente HI para elevar sua concentrao temporariamente para 0,096 mol/L. Quando o equilbrio restabelecido, quais sero [HI], [H2] e [I2]?
12. A presso em cada um dos seguintes sistemas reduzida de tal modo que o volume aumenta de 2 L para 10 L. Como deslocado o equilbrio? a. 2 CO2(g) b. H2(g) + I2(g) c. H2(g) + l2(s)
13. Para
2 CO(g) + O2(g) 2 HI(g) 2 Hl(g)
aumentar a produo de NO2 na reao NO(g) + 1/2 O2(g) NO2(g)
voc comprimiria o sistema, expandiria o sistema ou adicionaria um gs inerte?
Respostas:
1.
b. Kc = [SO2]2 x [O2] [SO3]2
a.
7.
[NO] = 2 x 10-17 mol/L [CO] = [H2O] = x = 0,044 mol/L [CO2]=[H2]=0,100 - x =0,056 mol/L = 0,120 mol/L [N2O4] = 0,040 mol/L = 0,010 + 0,002 = 0,012 mol/L [I2] = 0,010 + 0,002 = 0,012 mol/L [HI] = 0,096 - 0,004 = 0,092 mol/L
8. 0,0063 M.
9.
Kc = [H2O] [H2]
2.
1/[H2] 0,025
10. [NO2] 11. [H2]
3. Kc = 0,16 4. 5. Kc= 0,016
6.
Kc = 0,031 12. a. (2 moles de gs 3 moles de gs). O efeito imediato do aumento do volume diminuir o nmero de molculas por unidade de volume. Isto parcialmente compensado por um aumento no nmero de molculas. b. nenhum efeito: mesmo nmero de moles de gs em ambos os lados. c. (1 mol de gs 2 moles de gs). Note que o nmero de moles de gs que importante; slidos e lquidos no contam. 13. Voc deve comprimir o sistema.
Вам также может понравиться
- Lista de equilíbrios químicosДокумент5 страницLista de equilíbrios químicosAnderson_NizОценок пока нет
- Equi Lib Rio CompletoДокумент50 страницEqui Lib Rio CompletoLeonardo JunglesОценок пока нет
- Lista de Exercícios Equilíbrio Químico UFPBДокумент3 страницыLista de Exercícios Equilíbrio Químico UFPBAline MirandaОценок пока нет
- Equilibrio Quimico 2009Документ47 страницEquilibrio Quimico 2009Pedro LessaОценок пока нет
- Equilíbrios químicos e iônicosДокумент4 страницыEquilíbrios químicos e iônicosmailas33Оценок пока нет
- Introdução à Química-Física - Equilíbrio QuímicoДокумент10 страницIntrodução à Química-Física - Equilíbrio QuímicofersayОценок пока нет
- Cap 9 Equilibrio Quimico 2009Документ37 страницCap 9 Equilibrio Quimico 2009Pedro LessaОценок пока нет
- 1a FichaДокумент4 страницы1a FichaAlexandre DiazОценок пока нет
- Lista de Exercícios Equilíbrio QuímicoДокумент3 страницыLista de Exercícios Equilíbrio QuímicoDebora SeguchiОценок пока нет
- Equilíbrio Químico da Reação do Ácido CarbônicoДокумент4 страницыEquilíbrio Químico da Reação do Ácido CarbônicoNeiliane SouzaОценок пока нет
- Equilibrio Quimico - Parte 1Документ28 страницEquilibrio Quimico - Parte 1Maria Luísa M. LiraОценок пока нет
- QUIB50-Lista 3Документ2 страницыQUIB50-Lista 3Thiago ThaylorОценок пока нет
- EXERCICIOS CINÉTICA EQUIL Isct 12 CLASSE PDFДокумент5 страницEXERCICIOS CINÉTICA EQUIL Isct 12 CLASSE PDFKeila Jessica SamsonОценок пока нет
- Equi Lib Rio Qui MicoДокумент5 страницEqui Lib Rio Qui MicoRogerio AndradeОценок пока нет
- Expressões de equilíbrio e cálculo de constantes Kc e KpДокумент3 страницыExpressões de equilíbrio e cálculo de constantes Kc e Kpbolota4Оценок пока нет
- Equilíbrio químico - Constante de equilíbrio kcДокумент36 страницEquilíbrio químico - Constante de equilíbrio kcbrandownОценок пока нет
- EXERCÍCIOS DE FÍSICOQUIMICA (KC)Документ2 страницыEXERCÍCIOS DE FÍSICOQUIMICA (KC)wagner amadoОценок пока нет
- 3-Equilibrio QuimicoДокумент3 страницы3-Equilibrio Quimicojuliana dinizОценок пока нет
- Equilibrios ConstantesДокумент6 страницEquilibrios ConstantesFred DiasОценок пока нет
- Segunda Prova de QG - Gabarito - Versão FinalДокумент3 страницыSegunda Prova de QG - Gabarito - Versão FinalThomas JacobsenОценок пока нет
- Exercícios de equilíbrio químicoДокумент2 страницыExercícios de equilíbrio químicoedu_araujo_18Оценок пока нет
- UFCE - Lista 3 de exercícios de QuímicaДокумент2 страницыUFCE - Lista 3 de exercícios de Químicapedro alcantara100% (1)
- Exerc EquilibrioДокумент4 страницыExerc EquilibrioJr FantinellОценок пока нет
- CálculosestequiométricoДокумент8 страницCálculosestequiométricompedroleesilvaОценок пока нет
- Lista Exercícios - Equilíbrio QuímicoДокумент3 страницыLista Exercícios - Equilíbrio QuímicoMarianaCamargosОценок пока нет
- Exercícios Fixação para ProvaДокумент7 страницExercícios Fixação para ProvaJoãoОценок пока нет
- QFL0605 - Lista de Exercicios - Equilíbrio Químico 26-03-2020Документ3 страницыQFL0605 - Lista de Exercicios - Equilíbrio Químico 26-03-2020Esperança FLORENTINOОценок пока нет
- 3-Equilibrio QuimicoДокумент3 страницы3-Equilibrio QuimicoFranck PereiraОценок пока нет
- Exercicios de Aplicação 2Документ3 страницыExercicios de Aplicação 2Martinõ MarcellОценок пока нет
- Lista 2 - Equilíbrio QuímicoДокумент4 страницыLista 2 - Equilíbrio Químicogabrielli yamakawaОценок пока нет
- Lista de Exercícios II - Equilíbrio QuímicoДокумент6 страницLista de Exercícios II - Equilíbrio QuímicoErenilson SantosОценок пока нет
- Equilíbrio Químico e Cálculo de Constante de Equilíbrio KcДокумент3 страницыEquilíbrio Químico e Cálculo de Constante de Equilíbrio KcAlda Maria Dinis Ginja100% (1)
- Aula de Cálculos em Química - EstequiometriaДокумент29 страницAula de Cálculos em Química - EstequiometriadavidОценок пока нет
- Equilíbrio químico - Lista de exercíciosДокумент4 страницыEquilíbrio químico - Lista de exercíciosSamara CristinyОценок пока нет
- Equilíbrio químico - exercícios de químicaДокумент8 страницEquilíbrio químico - exercícios de químicaThania ArrudaОценок пока нет
- Equilíbrio químico: exercícios sobre Kc e KpДокумент3 страницыEquilíbrio químico: exercícios sobre Kc e KpLetícia Rossi0% (1)
- QuimicaДокумент3 страницыQuimicaum jojofag qualquerОценок пока нет
- 3a Atividade - Constante de EquilíbrioДокумент2 страницы3a Atividade - Constante de EquilíbrioERIK CESARОценок пока нет
- Exercicios de Equilibrio QuimicoДокумент2 страницыExercicios de Equilibrio QuimicoDaniloОценок пока нет
- Exercicios Equilibrio Químico12 B Classe ESSG2024Документ2 страницыExercicios Equilibrio Químico12 B Classe ESSG2024Sandra SengoОценок пока нет
- Lista de Equilíbrio QuímicoДокумент5 страницLista de Equilíbrio QuímicoMÁRIO LIMAОценок пока нет
- 2em Lista Exercicios Quim EmmanuelДокумент2 страницы2em Lista Exercicios Quim EmmanuelLuiz Felipe SantoroОценок пока нет
- Química Física - Exercícios de ConsolidaçãoДокумент3 страницыQuímica Física - Exercícios de ConsolidaçãoGildo Salai MacalaneОценок пока нет
- Equilíbrio Químico 3Документ6 страницEquilíbrio Químico 3Milton LopesОценок пока нет
- Teste 3 - CeppeaДокумент4 страницыTeste 3 - CeppeaMartins AiupaОценок пока нет
- Lista de Exercicios - Equilíbrio Químico - 21-03-2017Документ2 страницыLista de Exercicios - Equilíbrio Químico - 21-03-2017Esperança FLORENTINOОценок пока нет
- Lista de Exercícios Equlíbrio QuímicoДокумент2 страницыLista de Exercícios Equlíbrio QuímicoBrandie ThompsonОценок пока нет
- Simulação FT 11Q reações químicasДокумент2 страницыSimulação FT 11Q reações químicasSérgio MarquesОценок пока нет
- Equilíbrio químico - lista de exercícios resume de forma concisa e otimizada para o conteúdo do documento, que trata de uma lista de exercícios sobre equilíbrio químico, como solicitadoДокумент5 страницEquilíbrio químico - lista de exercícios resume de forma concisa e otimizada para o conteúdo do documento, que trata de uma lista de exercícios sobre equilíbrio químico, como solicitadoLussandra MarquezОценок пока нет
- 6 Lista de Exercícios - 2019 1Документ3 страницы6 Lista de Exercícios - 2019 1Pedro FelipeОценок пока нет
- Química Geral - Soluções, Cinética e EquilíbrioДокумент5 страницQuímica Geral - Soluções, Cinética e Equilíbrioismaelsilva3692Оценок пока нет
- Equilíbrio QuímicoДокумент43 страницыEquilíbrio QuímicoSilvio RobertoОценок пока нет
- Avaliação Diagnóstica de QuímicaДокумент3 страницыAvaliação Diagnóstica de QuímicaAmanda BarcelosОценок пока нет
- Prova Fisico QuimicaДокумент5 страницProva Fisico QuimicaBianca 90Оценок пока нет
- Lista de Exercicio 1 CEFETДокумент6 страницLista de Exercicio 1 CEFETVictor FabianoОценок пока нет
- Apostila Química Orgânica: Terpenos E Rotas De SínteseОт EverandApostila Química Orgânica: Terpenos E Rotas De SínteseОценок пока нет
- Apostila Química Orgânica: Carbono, Dienos E AromáticosОт EverandApostila Química Orgânica: Carbono, Dienos E AromáticosОценок пока нет
- 1 Avaliaçao Risco QuimicoДокумент3 страницы1 Avaliaçao Risco QuimicoJean FrankОценок пока нет
- Isótopos radioativos em medicinaДокумент2 страницыIsótopos radioativos em medicinaJean FrankОценок пока нет
- Lista de ExercíciosДокумент8 страницLista de ExercíciosJean FrankОценок пока нет
- Constante de equilíbrio química Kc expressõesДокумент3 страницыConstante de equilíbrio química Kc expressõesJean Frank100% (1)
- TermoquimicaДокумент3 страницыTermoquimicaJean FrankОценок пока нет
- Química reações equações substânciasДокумент4 страницыQuímica reações equações substânciasAna LuisОценок пока нет
- BIOENERGÉTICAДокумент16 страницBIOENERGÉTICADrago DJ758Оценок пока нет
- Lista 2 EstequiometriaДокумент3 страницыLista 2 EstequiometriaJoão VitorОценок пока нет
- (20161112194013) Aula 7 Cosmética Capilar 2016.2Документ38 страниц(20161112194013) Aula 7 Cosmética Capilar 2016.2Adriano costaОценок пока нет
- IQA122 - Material Complementar Grupo IVДокумент9 страницIQA122 - Material Complementar Grupo IVCleber JosonОценок пока нет
- AdubosДокумент27 страницAdubosCarlos RegisОценок пока нет
- questions_quimica_ligacoes-quimicas_ligacoesДокумент9 страницquestions_quimica_ligacoes-quimicas_ligacoessamstudyyyОценок пока нет
- Aminoácidos: introdução, classificação e metabolismoДокумент70 страницAminoácidos: introdução, classificação e metabolismoJorge100% (1)
- Catálogo Estofados 2023Документ7 страницCatálogo Estofados 2023Andressa ConradoОценок пока нет
- Material para Estudo - Olimpíada de Química - 5 - 5Документ116 страницMaterial para Estudo - Olimpíada de Química - 5 - 5Rafael VanolliОценок пока нет
- Caminho Das Pedras - ApostilaДокумент23 страницыCaminho Das Pedras - ApostilaSilvanaОценок пока нет
- Fórmulas químicas Pré-VestibularДокумент5 страницFórmulas químicas Pré-VestibularandreventuraОценок пока нет
- OBQ Jr2016-FaseI1Документ4 страницыOBQ Jr2016-FaseI1youngОценок пока нет
- NBR 13802 (Abr 1997) - Água - Determinação de Selênio Pelo Método Colorimétrico Da DiaminobenzidinaДокумент3 страницыNBR 13802 (Abr 1997) - Água - Determinação de Selênio Pelo Método Colorimétrico Da DiaminobenzidinaYuri Bahia de VasconcelosОценок пока нет
- Relatório de TBL - Reações de PrecipitaçãoДокумент6 страницRelatório de TBL - Reações de PrecipitaçãoVitoria MedeirosОценок пока нет
- Tabela Atkins para Revisão GibbsДокумент10 страницTabela Atkins para Revisão GibbsDarkThiОценок пока нет
- Caracteristicas SilicaДокумент21 страницаCaracteristicas SilicaMarcelo CastroОценок пока нет
- ProEJA ATIVIDADE-2Документ4 страницыProEJA ATIVIDADE-2Raquel alyne drumondОценок пока нет
- Indicadores ácido-base e preparação de sangue falsoДокумент9 страницIndicadores ácido-base e preparação de sangue falsoGleisonОценок пока нет
- Mapa Mental - Funções Orgânicas (Química) PDFДокумент2 страницыMapa Mental - Funções Orgânicas (Química) PDFMariana Queiroz100% (2)
- Fundamentos de Química Geral com ExercíciosДокумент3 страницыFundamentos de Química Geral com ExercíciosBruno AraújoОценок пока нет
- Classificação de cadeias carbônicas em compostos orgânicosДокумент24 страницыClassificação de cadeias carbônicas em compostos orgânicosCamila Barreiros100% (1)
- Execução e inspeção de piso cerâmicoДокумент2 страницыExecução e inspeção de piso cerâmicoAnderson SousaОценок пока нет
- Zintek 200Документ6 страницZintek 200Tiago ChalinskiОценок пока нет
- Isômeros: estudo sobre isomeria plana, geométrica e ópticaДокумент16 страницIsômeros: estudo sobre isomeria plana, geométrica e ópticaGabriel NoboaОценок пока нет
- Analise Titrimetrica Sem2 2013 Versao 2Документ32 страницыAnalise Titrimetrica Sem2 2013 Versao 2Hércules SantiagoОценок пока нет
- FISPQ Cristalizador de VidrosДокумент11 страницFISPQ Cristalizador de VidrosMuquequ@Оценок пока нет
- Exercícios - Mudança de Fase, Substancias e Misturas, Separação de MisturasДокумент4 страницыExercícios - Mudança de Fase, Substancias e Misturas, Separação de MisturasChristiane AlvesОценок пока нет
- REBOLOSДокумент14 страницREBOLOSapi-3853601100% (3)