Академический Документы
Профессиональный Документы
Культура Документы
Evolución Del Concepto de Potencial de Reposo Neuronal
Загружено:
Daniela Catalina Vasquez RossierИсходное описание:
Оригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Evolución Del Concepto de Potencial de Reposo Neuronal
Загружено:
Daniela Catalina Vasquez RossierАвторское право:
Доступные форматы
REVISIN EN NEUROCIENCIA
Evolucin del concepto de potencial de reposo neuronal. Aspectos bsicos y clnicos
J.A. Lamas
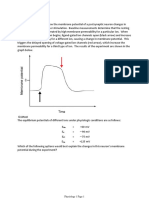
THE DEVELOPMENT OF THE CONCEPT OF NEURONAL RESTING POTENTIAL. FUNDAMENTAL AND CLINICAL ASPECTS Summary. Introduction and aims. Since the classical works carried out on the squid giant axon far less attention has been directed towards the study of the resting membrane potential than to the study of changes in potential (action potential, synaptic potentials, and so forth). It is often assumed that the resting potential depends on an independent current of the voltage called the leakage current, although, except on rare occasions, it has not been possible to characterise such a current either pharmacologically or molecularly. In this work our aim is to review and update the concept of resting potential. Development. The outlook at present offers a complex situation in which several factors, in addition to leakage currents, play a role in maintaining resting potentials. These factors include ionic currents across non-inactivating voltage-dependent channels, the sodium/potassium pump, and certain currents with characteristics that are similar to those of the classical leakage current. The interaction of all these components gives rise to complex sub-threshold behaviours in the neurons, such as intrinsic rhythmic oscillations, which leads us away from the passive concept of the resting potential. Conclusions. An everincreasing number of descriptions of intrinsic sub-threshold, rhythmic activity are being reported, which could suggest that they are a generalised phenomenon in the nervous system. Further studies need to be conducted into the complex mechanisms that determine the resting potential in order to gain an understanding of the phenomena of neuronal excitability and to find an explanation for some of the many pathological conditions that affect the nervous system. [REV NEUROL 2005; 41: 538-49] Key words. Channelopathies. Leakage currents. Low-threshold oscillations. Resting potential. Voltage-dependent channels.
INTRODUCCIN Y OBJETIVO Las membranas de las neuronas y de las dems clulas del organismo separan dos fluidos con distinta composicin inica, el lquido intracelular (citoplasma) y extracelular. A esta asimetra de concentraciones contribuyen un buen nmero de factores, entre los que destaca la presencia, en las membranas, de bombas y transportadores de iones. Es de especial relevancia la bomba de sodio/potasio, que gasta gran cantidad de energa para mantener, de forma continuada, la asimetra de estos dos iones. La naturaleza lipdica de las membranas, que impide el paso de molculas cargadas a su travs, funciona como una barrera a la homogeneizacin de concentraciones. La presencia de canales inicos, poros que permiten la fuga de ciertos iones en funcin de su gradiente electroqumico, determinan el valor final del potencial de membrana (Vm), y le confieren una permeabilidad selectiva. Es tambin importante la gran cantidad de aniones orgnicos intracelulares que no pueden atravesar la membrana principalmente protenas con carga negativa atrapadas en el citoplasma. Las diferencias de concentracin afectan a iones de gran importancia biolgica como sodio, potasio, clo-
ro y calcio. Todos estos factores y algunos ms hacen que las membranas de las clulas excitables funcionen como pequeas pilas con voltajes de unas decenas de milivoltios; el polo negativo sera el interior celular y el polo positivo el lquido extracelular (Fig. 1). Aunque la generacin del potencial de membrana se fundamenta principalmente en la actividad de la bomba de sodio/potasio, el valor final de dicho potencial depende mucho de la permeabilidad de la membrana a los diferentes iones; es decir, del nmero y tipo de canales inicos en estado abierto que posea. Tambin las variaciones que se producen en el potencial de reposo (Vr), bien sean subumbrales (potenciales sinpticos, oscilaciones intrnsecas) o supraumbrales (potenciales de accin), son el reflejo de los cambios en la permeabilidad de la membrana. En esta revisin se trata de explicar cmo se ha pasado de un concepto que defina el potencial de membrana en reposo como un equilibrio dinmico estable, a un concepto en el que se puede considerar como un equilibrio dinmico inestable. Este cambio supone una modificacin trascendental en la manera de abordar el estudio de los mecanismos de excitabilidad neuronal. POTENCIAL DE EQUILIBRIO. ECUACIN DE NERNST Si situamos distintas concentraciones de una sal de potasio (p. ej., AK) a ambos lados de una membrana semipermeable permeable al potasio (K+), pero no al anin (A), el in para el que la membrana es permeable fluir, en un primer momento, desde el compartimiento donde la sal est ms concentrada al compartimiento donde lo est menos. Este movimiento hace que uno de los compartimentos se vuelva negativo con respecto al otro, y genera as una fuerza electromotriz. El flujo de potasio se detendr cuando la fuerza electromotriz generada por la diferencia de carga se iguala a la fuerza quimicomotriz generada por la diferencia de concentracin; cuando llega ese mo-
Aceptado tras revisin externa: 28.09.05. rea de Fisiologa. Departamento de Biologa Funcional y Ciencias de la Salud. Facultad de Biologa. Universidad de Vigo. Vigo, Pontevedra, Espaa. Correspondencia: Dr. Jos Antonio Lamas Castro. Laboratorio de Neurociencia. Departamento de Biologa Funcional y Ciencias de la Salud. Facultad de Biologa. Universidad de Vigo. Rua das Abelairas. Campus Lagoas-Marcosende. E-36310 Vigo (Pontevedra). Fax: +34 986 812 556. E-mail: antoniolamas@uvigo.es Agradecimientos. Al profesor Antonio Canedo y a los doctores Antonio Reboreda, Marcos Romero y Estela Snchez, que realizaron parte del trabajo experimental. Trabajo financiado por el Ministerio de Ciencia y Tecnologa, la Xunta de Galicia y la Universidad de Vigo. 2005, REVISTA DE NEUROLOGA
538
REV NEUROL 2005; 41 (9): 538-549
POTENCIAL DE MEMBRANA
donde EK es el potencial de equilibrio para el potasio (en voltios), R (constante de los gases) = 8,314 J K1 mol1 o V C K1 mol1, T (temperatura absoluta, K) = 273,15 + C, Z (valencia del in) = 1, F (constante de Faraday) = 9,649 104 C mol1, ln = 2,303 lg10, [K]e es la concentracin extracelular de potasio y [K]i es la concentracin intracelular de potasio. RT/ZF es una constante que depende de la temperatura y ln es igual a 2,303 log10, de modo que a 37 C la ecuacin de Nernst para el potasio se convierte en [3]: [K]e EK = 61,54 log10 [K]i
Figura 1. Esquema de registro del potencial de membrana. Mientras el electrodo de registro intracelular (electrodo de vidrio relleno con ClK 3M) y el electrodo de referencia (alambre de plata clorado) estn ambos en el exterior, no hay diferencia de potencial entre ambos electrodos (0 mV; izquierda). Cuando el electrodo de registro penetra la membrana, el amplificador mide la diferencia de potencial entre el interior y el exterior de la clula; es decir, el potencial de membrana en reposo (en este caso 70 mV; derecha). El interior es negativo con respecto al exterior.
Tabla I. Concentraciones inicas y potenciales de equilibrio en una neurona de mamfero. In Na+ K+ Cl Ca2+ A
Intracelular (mM) 18 135 7 100 nM 138
Extracelular (mM) 145 3 120 1,2 9
E(in) a 37 C (mV)
+55,39 101,54 76,31 +125,54
Permeabilidad (cm/s) 5 109 5 107 1 108
mento, se dice que el sistema ha alcanzado el equilibrio [1]. Aunque puede ser intuitivamente difcil de asimilar, cuando se alcanza el equilibrio la concentracin del in a ambos lados de la membrana es todava esencialmente la inicial, ya que la cantidad de cargas (iones) que han cambiado de compartimiento es despreciable con respecto a la cantidad de cargas iniciales. Con un sistema como ste, en el que la membrana es permeable solamente a un in, se alcanza con el tiempo un equilibrio esttico y estable. En el equilibrio, el movimiento neto del in es nulo y se puede medir una diferencia de potencial entre ambos compartimentos. A esta diferencia de potencial se le llama potencial de equilibrio para el in que es capaz de atravesar la membrana (en este ejemplo, potasio; EK). Intuitivamente, el potencial de equilibrio para un in es aquel potencial de membrana al cual el in no se mueve; esto significa que la fuerza ejercida por el gradiente de concentracin que lo empuja en una direccin es exactamente igual que la fuerza electromotora que lo empuja en la direccin contraria. En un ejemplo como ste, el potencial de equilibrio para un in se puede calcular con la ecuacin de Nernst, si conocemos sus concentraciones iniciales (o finales) a ambos lados de la membrana semipermeable [2]: RT EK = ZF ln [K]i [K]e
Se puede aplicar este modelo a una membrana neuronal tpica de mamfero; en este caso, la [K]e sera 3 mM y la [K]i 135 mM (Tabla I); el potencial de equilibrio para el potasio sera: EK = 101,54 mV. Obviamente, este valor es ms negativo que la diferencia de potencial que existe entre el interior y el exterior de la mayor parte de las neuronas. La razn para esta discrepancia es que las membranas celulares son permeables a ms de un in y existe un potencial de equilibrio para cada uno de ellos. Las neuronas de mamfero tienen, en general, potenciales de equilibrio para el sodio que rondan los +50 mV y potenciales de equilibrio para potasio que rondan los 100 mV; estos valores varan poco en funcin del tipo celular (Fig. 2a). Algo bastante diferente ocurre con el in cloro; en algunas neuronas el potencial de equilibrio para este in es ms positivo y en otras ms negativo que el potencial de reposo. Ms an, el potencial de equilibrio para este in puede cambiar sustancialmente segn el estado de desarrollo de la neurona. En un buen nmero de tipos neuronales, el ECl es ms positivo que el Vr en la etapa embrionaria y posnatal temprana, pero finalmente es ms negativo que el Vr en la etapa adulta del animal. Esto se debe probablemente a cambios en la expresin de los transportadores del in cloro a lo largo del desarrollo [4]. Para complicarlo todava ms, en otras neuronas no existen aparentemente tales transportadores, de modo que el ECl ser, en estos casos, igual al potencial de membrana, y cambiar al mismo tiempo que lo haga ste. Esto genera una dificultad aadida, que algunos investigadores hemos sufrido con paciencia, cuando se investiga una corriente en la que interviene este in. POTENCIAL DE REPOSO. ECUACIN DE GOLDMAN-HODGKIN-KATZ Cuando el potencial de membrana de una neurona permanece estable durante un tiempo ms o menos largo, se suele decir que la membrana est en reposo; a esa diferencia de potencial estable entre el interior y el exterior de la neurona se le llama entonces potencial de reposo de la membrana. El mecanismo de transmisin de informacin en el sistema nervioso (SN) se basa en cambios ms o menos bruscos del potencial de membrana, cambios que llamamos potenciales de accin, potenciales sinpticos, etc. Por tanto, es imprescindible conocer el mecanismo que da origen al potencial de reposo para comprender cmo funciona el sistema. Si las membranas celulares fuesen permeables a un solo in (p. ej., al potasio), bastara saber la concentracin de ese in dentro y fuera de la membrana y aplicar la ecuacin de Nernst para saber cul es su potencial de reposo. En este caso el poten-
REV NEUROL 2005; 41 (9): 538-549
539
J.A. LAMAS
cial de membrana en reposo coincidira exactamente con el potencial de equilibrio para el in permeable ya calculado en el ejemplo del apartado anterior. Aunque la mayor parte de las neuronas en reposo son mucho ms permeables al potasio que a otros iones, en realidad el potencial de reposo de las neuronas suele ser sustancialmente ms positivo que el potencial de equilibrio para el potasio. Esto se explica porque las membranas neuronales en reposo tambin son permeables al sodio, al cloro y algunas probablemente tambin al calcio. Por ejemplo, la relacin entre permeabilidades en las membranas del axn gigante de calamar es: PK : PNa : PCl = 1: 0,04: 0,45 [5], tomando como 1 la permeabilidad al potasio por ser la mayor y las dems en relacin con sta; probablemente en el SN de mamferos sera difcil encontrar dos tipos neuronales con permeabilidades iguales. Esto significa que, en general, el potencial de reposo de una neurona, aunque cercano, casi nunca alcanza el potencial que predicen las concentraciones de potasio. Solamente en algunas clulas de la glia la permeabilidad al potasio es tan alta, en relacin con las dems, que la ecuacin de Nernst s sera una estima vlida del potencial de reposo. Queda claro que en una membrana permeable a varios iones, la ecuacin de Nernst no predice bien el valor del potencial de reposo [6-8]. Se puede entonces calcular el potencial de reposo a partir de concentraciones inicas? La solucin a este problema pasa por tener en cuenta todos los iones para los que la membrana es permeable en situacin de reposo; esto es lo que hicieron, a finales de los aos cuarenta, Goldman [9] y Hodgkin y Katz [10]. Fruto de su trabajo surgi la ecuacin de Goldman-Hodgkin-Katz (GHK): RT Vr = F ln
Figura 2. Potenciales de equilibrio, canales inicos y potencial de membrana en reposo. Los iones para los que la membrana es permeable, tiran del potencial de membrana hacia su potencial de equilibrio; para ello, atraviesan la membrana a travs de los canales abiertos y generan, por lo tanto, corrientes inicas. a) La hiptesis clsica explica el potencial de reposo con dos corrientes de fuga independientes de voltaje, una de potasio (K,f) y una de sodio (Na,f), y asume un comportamiento pasivo para el cloro (Cl,f). b) En el modelo de neuronas simpticas se deben aadir tres corrientes dependientes de voltaje, la de sodio persistente (Na,p), la de potasio tipo M (K,m) y la catinica mixta (Na/K) activada por la hiperpolarizacin (H). En estas neuronas el cloro no se distribuye pasivamente, de modo que se debe aadir la corriente de fuga de cloro (Cl,f). Finalmente, el componente electrognico de la bomba de Na/K tambin tiene una pequea contribucin hiperpolarizante (B). Todos estos componentes, y tal vez alguno ms, determinan un potencial de reposo de alrededor de 60 mV.
PK [K]e + PNa [Na]e + PCl [Cl]i PK [K]i + PNa [Na]i + PCl [Cl]e
donde Vr es el potencial de reposo (en voltios), P es la permeabilidad para cada in, [X]e es la concentracin extracelular para cada in y [X]i es la concentracin intracelular para cada in. Esta ecuacin asigna un parmetro nuevo a cada in, su coeficiente de permeabilidad (en cm/s). El resultado de esta ecuacin, en realidad, es una media de los potenciales de equilibrio de todos los iones que pueden atravesar la membrana; es decir, de las ecuaciones de Nernst para dichos iones ponderadas en funcin de la permeabilidad. Es fcil darse cuenta de que si una membrana fuese exclusivamente permeable al potasio, por ejemplo, la ecuacin de GHK dara el mismo resultado que la ecuacin de Nernst para el potasio (Vr = EK). Sealar que las concentraciones del in cloro se sitan al contrario que las dems, por tener carga negativa. Intuitivamente, la ecuacin de GHK dice que cada in que pueda atravesar la membrana tratar de llevar el potencial de
membrana a su potencial de equilibrio; para ello slo tiene que moverse en la direccin adecuada. Pero, si esto es una especie de competicin, qu in ganar? En realidad, normalmente ninguno tiene la fuerza suficiente para que el potencial de reposo acabe siendo exactamente igual que su potencial de equilibrio; sin embargo, el in con ms fuerza asumiendo que las concentraciones son similares para todos ellos ser aquel para el cual la membrana sea ms permeable. Esta es la razn por la que las neuronas suelen tener potenciales de reposo cercanos al potencial de equilibrio del potasio. Tambin nos explica porqu los potenciales de reposo suelen ser ligeramente ms positivos que el EK; la razn es que el ENa es muy positivo. Asumiendo que nuestra membrana no tiene transportadores de cloro, el Vr se situar en algn lugar entre los potenciales de equilibrio del sodio y del potasio. En nuestro ejemplo de neurona de mamfero el valor sera aproximadamente 73 mV (Fig. 2a). Conviene tener claro que el sentido en que se mueve un in a travs de la membrana depende de la relacin entre el potencial de membrana y su potencial de equilibrio; es decir, de la fuerza electroqumica y no exclusivamente del gradiente de concentracin; al fin y al cabo, los iones tienen carga. Esto significa que en ciertas circunstancias p. ej., en muchos experi-
540
REV NEUROL 2005; 41 (9): 538-549
POTENCIAL DE MEMBRANA
mentos de laboratorio, los iones se mueven en contra de su gradiente de concentracin. En reposo, el sodio trata de llevar la membrana a un valor ms positivo (hacia su potencial de equilibrio) y, por ello, entra continuamente en la neurona (tiene carga positiva), mientras que el potasio sale para intentar llevar el Vm a un valor ms negativo. Estas corrientes continuadas de sodio y potasio se contrarrestan por la bomba de Na/K, que tambin de forma continuada saca sodio al exterior e introduce potasio en el interior. De este modo, se mantiene una concentracin constante. Con la informacin que tenemos hasta este momento, podramos decir que el potencial de membrana en reposo est permanentemente en un equilibrio dinmico estable. PERMEABILIDAD Y CONDUCTANCIA. DOS CARAS DE LA MISMA MONEDA? Hemos observado que las membranas son permeables a varios iones en reposo y que en este equilibrio dinmico algunos iones atraviesan continuamente la membrana. Como los iones tienen carga, al atravesar la membrana generan corrientes inicas que obedecen leyes similares a las que rigen el flujo de electrones en un circuito elctrico. En un circuito elctrico sencillo (una resistencia y una pila), la intensidad de corriente (I, amperios) es directamente proporcional a la diferencia de potencial (V, voltios) e indirectamente proporcional a la resistencia (R, ohmios). Esta relacin (I = V/R), conocida como ley de Ohm, tambin se aplica a las corrientes inicas. Teniendo en cuenta que la conductancia (g, siemens) no es ms que la inversa de la resistencia (g = 1/R), en reposo la relacin sera: Iin = gin (Vr Ein) donde Vr Ein representa la fuerza electroqumica para el in en reposo. Con este modelo elctrico podemos obtener una ecuacin que estima el potencial de reposo; esta ecuacin es el equivalente elctrico de la ecuacin de GHK y, por lo tanto, debe tener en cuenta la conductancia de todos los iones que pueden atravesar la membrana [11]: (EK gK) + (ENa gNa) + (ECl gCl) Vr = gK + gNa + gCl El valor del potencial de reposo depende de la facilidad con que los iones atraviesan la membrana plasmtica. Dicha facilidad se representa en el modelo de difusin (ecuacin de GHK) por las permeabilidades y en el modelo elctrico que acabamos de representar por las conductancias. Tambin aqu es claro que, si slo existiese conductancia para uno de los iones, el potencial de reposo coincidira con el potencial de equilibrio de dicho in. En el modelo elctrico la entrada de iones positivos en la clula o la salida de iones negativos se considera una corriente de entrada y, por convencin en las curvas corriente-voltaje, se representa hacia abajo (valor negativo; Fig. 5a). Lo contrario sucede con la salida de iones positivos o entrada de iones negativos; se le llama corriente de salida y se representa por encima del 0 (Fig. 3c). Conviene saber tambin que una corriente de entrada produce una desviacin del potencial de membrana hacia valores ms positivos, es decir, despolariza la membrana, mientras que una corriente de salida ejerce el efecto contrario sobre el potencial de membrana y se dice que la hiperpolariza.
Aunque se relacionan y en muchas ocasiones se utilizan para referirse a lo mismo incluso en esta revisin!, los trminos permeabilidad y conductancia no son sinnimos [12]. La permeabilidad constituye una medida de la facilidad con que un in o cualquier otra sustancia pasa a travs de una membrana; en el caso de los iones depende del nmero y tipo de canales inicos abiertos que posea dicha membrana. Calcular el coeficiente de permeabilidad de una membrana a un in (Pin) es una tarea compleja, porque hay que conocer la movilidad del in en la membrana (interior del canal) (), el coeficiente de particin entre la membrana (boca del canal) y la solucin acuosa () y el grosor de la membrana (longitud del canal) (a) [8]: RT Pin (cm/s) = aF La conductancia (ver ms arriba), por otra parte, mide la facilidad de la membrana para transportar corriente elctrica y como sta la transportan los iones, depende adems de su concentracin. Por eso suele decirse que para que exista conductancia en una membrana se necesita que sta sea permeable, pero tambin que el in est presente. Aunque una permeabilidad elevada suele significar una conductancia elevada, la relacin no siempre es lineal. EL REPOSO Y LAS CORRIENTES DE FUGA (LEAK) La idea clsica asume que la conductancia de la membrana en reposo (ecuacin del apartado anterior) se debe a la presencia de los llamados canales de fuga (leakage channels). Estos canales estaran siempre abiertos y no se veran afectados por el potencial de la membrana, ni por otros factores que modulan la apertura y cierre de otros tipos de canales conocidos [13]. La corriente generada por estos canales tendra entonces un comportamiento hmico, es decir, la relacin entre la amplitud de la corriente y el potencial de la membrana se ajustara a una lnea recta cuya pendiente representara la conductancia de la membrana (inversa de la resistencia). Si esta corriente fuese la nica responsable del reposo, el punto de cruce de esa recta con el eje X nos dara el valor del potencial de reposo (Fig. 3a). Las membranas son permeables en reposo al menos a sodio, potasio y cloro, pero la teora clsica no deja claro si existen en la membrana canales de fuga diferentes para cada uno de ellos o si esta permeabilidad/conductancia se debe a la presencia de un solo tipo de canal mixto, canal que dejara pasar ms fcilmente el potasio, pero tambin a los dems iones. Esto es lgico, ya que cuando se enunci dicha teora, la existencia de canales inicos era todava una hiptesis controvertida. En cualquier caso, en reposo, la suma de las corrientes transportadas por estos iones (corriente neta) debera ser igual a 0, ya que se asume que el sistema est en equilibrio. Los intentos de identificar los canales de fuga han resultado, en la mayora de los casos, infructuosos. Incluso se ha llegado a sugerir que la apertura ocasional de algunos de los mltiples tipos de canales inicos, que s se han identificado en la mayor parte de las membranas neuronales (dependientes del voltaje, dependientes del calcio, etc.), sera suficiente para justificar la conductancia de la membrana en reposo y que, por lo tanto, no se necesitaran canales de fuga propiamente dichos. De hecho, como observaremos ms adelante, conocemos ya un buen nmero de canales
REV NEUROL 2005; 41 (9): 538-549
541
J.A. LAMAS
cuya dependencia de voltaje les permite abrirse parcialmente a potenciales de reposo [14]. A pesar de todo, existen al menos dos argumentos a favor de la existencia de canales de fuga al estilo clsico. Por un lado, algunos neurotransmisores afectan a una corriente que parece generada por canales cuya apertura no depende del voltaje. Por otro lado, en algunas neuronas es posible, aunque no fcil, inhibir todas las corrientes dependientes del voltaje conocidas hasta que queda una pequea corriente cuya relacin con el voltaje es aparentemente lineal y que podra corresponderse con la corriente de fuga clsica [15] (Figs. 3b y 3c). Resaltar que cuando hablamos de corrientes dependientes del voltaje nos referimos a corrientes inicas que pasan a travs de canales cuya apertura y cierre depende del voltaje. A los dos argumentos anteriores se une el reciente descubrimiento de una familia de canales con dos dominios de poro (twin-pore o two-pore domain potassium channels; 2PK), que parecen buenos candidatos para explicar la corriente de fuga de potasio. Los canales 2PK estn constituidos por dos protenas, cada una de las cuales tiene cuatro dominios transmembrana y dos dominios formadores de poro esto ltimo es lo que le da el nombre a la familia, en realidad el canal funcional no tiene dos poros. La probabilidad de apertura de uno de los 14 miembros conocidos de esta familia, llamado TASK1, es independiente del voltaje. Al expresarlo en oocitos genera una corriente de potasio hiperpolarizante, pero se ha identificado tambin en varios tipos de neuronas de mamfero. Es importante resaltar que las protenas de esta familia de canales no tienen el tpico dominio S4 caracterstico de los canales dependientes del voltaje y, por lo tanto, carecen de un sensor de voltaje. Incluso este muy probable candidato se aparta del concepto clsico de canal de fuga, ya que se modula por neurotransmisores a travs de receptores acoplados a protenas G y tambin por protones (pH) a concentraciones fisiolgicas [16-19]. Es muy posible que la regulacin de estas conductancias de reposo sea un mecanismo primordial para el control de la excitabilidad celular [20]. EL REPOSO Y LOS CANALES DEPENDIENTES DE VOLTAJE Desde que la electrofisiologa empez a dar sus primeros pasos se asumi una conductancia constante, a la que se llam de reposo (o de fuga), para explicar la presencia del potencial de reposo. No olvidemos que el potencial de reposo es el potencial del que emerge el potencial de accin y al cual este ltimo regresa cuando la neurona est disparando. Si se asume que la corriente de fuga determina por s sola el potencial de reposo, ste debera tener un valor igual al potencial de inversin (PI) de dicha corriente en la figura 3a, el PI es el punto en que la lnea cruza el eje X. En realidad, el potencial de reposo casi nunca coincide con el PI de la denominada corriente de fuga, lo que indica que en prcticamente todas las neuronas las corrientes a travs de canales dependientes del voltaje influyen en el valor final del potencial de reposo. Se utiliza aqu el trmino PI, porque se supone que la corriente de fuga es la suma de las corrientes transportadas por varios iones. El PI es el potencial al cual la corriente es 0; es decir, el potencial al cual la corriente pasara de ser de entrada, a ser de salida, o viceversa. La diferencia con el potencial de equilibrio radica en que el PI de una corriente se mide experimentalmente, mientras que el potencial de equilibrio de un in se calcula matemticamente a partir de sus concentraciones, como ya se ha explicado. De esta
Figura 3. Relacin corriente-voltaje, corrientes M y H. a) En un modelo clsico, la intensidad de la corriente de fuga (independiente del voltaje) variara de forma lineal con el voltaje y sera 0 al potencial de reposo. Este comportamiento se ajusta a la ley de Ohm (I = V/R). b y c) En el modelo real de neuronas del GCS, la corriente no tiene un comportamiento lineal alrededor del potencial de reposo debido a la presencia de canales inicos que se abren o cierran segn el voltaje. A valores negativos, se abre la corriente catinica tipo H que puede inhibirse con cesio (1 mM) (b). A valores menos negativos, se abre la corriente de potasio tipo M que se bloquea por bario (1 mM) y oxotremorina M (10 M; agonista muscarnico) (c). Una vez inhibidas estas dos corrientes, permanece una corriente casi lineal que podra representar la corriente de fuga clsica (c); b y c presentan registros reales realizados en una neurona del GCS de rata en cultivo con el empleo de la tcnica de sello perforado; el protocolo consiste en una rampa continua de voltaje de 30 a 100 mV a una tasa de 10 mV/s.
forma, si se mide el PI de una corriente de potasio, ste debera en teora tener un valor exactamente igual que el potencial de equilibrio para el in potasio; en la prctica estos dos valores suelen diferir unos milivoltios. La medida del PI es especial-
542
REV NEUROL 2005; 41 (9): 538-549
POTENCIAL DE MEMBRANA
mente til cuando se trabaja con canales no selectivos, es decir, canales que dejan pasar ms de un tipo de in. En este caso, calcular el potencial de equilibrio no tendra sentido, ya que ste es por definicin de un solo in; sin embargo, el PI de la corriente que pasa a travs de l indica a qu potencial no habr corriente neta a travs de ese canal y permite saber cmo afecta al potencial de membrana (Fig. 2b). Se debe tener en mente que el PI de una corriente mixta no es necesariamente la media aritmtica de los potenciales de equilibrio de los iones que la componen; esto se debe a que los canales mixtos no suelen tener la misma permeabilidad para todos los iones que los atraviesan. Para que un tipo de canal dependiente del voltaje ejerza su influencia sobre el potencial de reposo, debe cumplir al menos dos preceptos: 1. Su curva de activacin debe abarcar el potencial de reposo, de modo que un porcentaje de los canales est abierto en reposo. La curva de activacin nos da una idea del porcentaje de canales que se abren a cada voltaje. 2. Debe carecer de inactivacin; es decir, una vez abierto, debe permanecer as para proporcionar una corriente ininterrumpida mientras se mantenga el voltaje adecuado. Un buen nmero de canales dependientes del voltaje inmediatamente despus de abrirse pasan a un estado inactivado; este estado se parece al estado cerrado (el canal no conduce), pero se diferencia del estado cerrado en que hay que eliminar la inactivacin para que el canal pueda conducir de nuevo esto se consigue normalmente al repolarizar la membrana durante un tiempo. Este ltimo precepto podra no necesitarse si las curvas de activacin e inactivacin de la corriente se solapan alrededor del potencial de reposo; en este caso se generara una corriente persistente denominada corriente de ventana que simulara la ausencia de inactivacin. En la actualidad conocemos un buen nmero de canales inicos dependientes del voltaje que estn parcialmente abiertos en reposo y, adems, algunos de ellos se modulan por neurotransmisores. El nmero de canales dependientes del voltaje que estn abiertos en reposo representa normalmente una pequea proporcin del total que hay en la membrana. Aunque la corriente que generan en reposo suele ser pequea, no es en absoluto despreciable, ya que la resistencia total de la membrana suele ser muy alta en estas condiciones (pocos canales abiertos), de modo que una corriente pequea (unas decenas de pA) puede representar un cambio de voltaje importante. De forma general, una corriente de potasio activa en reposo tiende a hiperpolarizar la membrana, mientras que una corriente de sodio tiende a despolarizarla. El papel de las corrientes dependientes del voltaje sobre el potencial de reposo es como la pescadilla que se muerde la cola; estas corrientes influyen sobre el valor del potencial de membrana y, a su vez, el valor del potencial de membrana influye sobre la fuerza que estas corrientes pueden ejercer. Si estudiamos dos neuronas que expresen uno de estos canales, podemos encontrarnos que en una de ellas es clave para determinar el valor del potencial de reposo y en la otra no influye en absoluto sobre l; todo depende del valor final del potencial de reposo, del potencial de equilibrio/inversin de la corriente que lo atraviesa y del rango de activacin del canal. El hecho de que existan canales dependientes del voltaje abiertos en reposo no quita validez a la ecuacin de GHK; tan solo implica que el valor de permeabilidad que se utiliza en esta ecuacin no se determina nicamente por los supuestos canales
de fuga, sino que es la suma de la permeabilidad a travs de todos los canales que estn abiertos en ese momento y, por lo tanto, un factor bastante ms complejo que el clsico. De hecho, la permeabilidad pasa a ser un factor muy dinmico que cambia de un momento a otro en funcin del propio potencial de membrana la cantidad de canales dependientes del voltaje abiertos cambia, como es obvio, con el voltaje. De forma similar pierde cierta fuerza la idea de que la resistencia de la membrana en reposo es una propiedad pasiva de sta y, por lo tanto, invariable. Se debe considerar que muchos de estos canales dependientes del voltaje se modulan por neurotransmisores, que de esta forma pueden modificar el potencial de reposo. Es importante decir que los experimentos realizados en neuronas cultivadas, con una fijacin de voltaje casi perfecta (clulas esfricas) y con la utilizacin de la modalidad de sello perforado de la tcnica de patch-clamp [21], que evita la dilisis intracelular, arrojan una resistencia de membrana en reposo cercana a los gigaohmios. Esto quiere decir que cualquier corriente dependiente del voltaje, que est parcialmente abierta, por pequea que sea, puede tener tanta influencia sobre el potencial de reposo como la indeterminada corriente de fuga. Corrientes de potasio Corrientes de potasio tipo M (KCNQ) El ejemplo ya clsico y que podramos considerar la punta del iceberg en este tipo de corrientes es la corriente M (IK(M) o IM). Esta corriente de potasio, que empieza a activarse entre 70 y 60 mV y carece de inactivacin, se describi por primera vez en neuronas simpticas de rana [22] y se llama M por modularse por la acetilcolina a travs de receptores muscarnicos. Posteriormente, se ha encontrado en un buen nmero de tipos neuronales en el sistema nervioso central (SNC) de mamferos, donde desempea un papel importante en el mantenimiento del potencial de reposo y en la adaptacin [15,23,24]. La presencia de esta corriente suele aportar un componente hiperpolarizante al potencial de reposo, adems de ser un factor clave en la adaptacin de muchos tipos neuronales. Encontrar el sustrato molecular fue complicado, a pesar del gran inters que suscit esta corriente desde su descubrimiento. Actualmente se acepta que la corriente M es el resultado de la unin heteromrica de dos subunidades de la familia KCNQ, la KCNQ2 y la KCNQ3 [25], aunque tambin la subunidad KCNQ5 podra formar parte del canal en algunas neuronas [26-29]. Corrientes de potasio tipo EAG Otro grupo de canales de potasio dependientes del voltaje con un importante papel en el reposo es la familia de canales de potasio llamada ether-a-go-go (EAG). Esta familia se compone de tres subfamilias llamadas eag, erg (eag-related) y elk (eaglike), cada una de ellas con varias subunidades ya conocidas y secuenciadas [30]. Las tres subfamilias tienen algn miembro con caractersticas de activacin e inactivacin que les permite estar abiertos en reposo. Un caso interesante es el subtipo eag2, que no inactiva y comienza a abrirse a voltajes de 90 mV. Esta subunidad parece tener una distribucin bastante selectiva, y se expresa principalmente en neuronas corticales de la capa IV, donde podra tener gran influencia sobre el potencial de reposo [31,32]. Algunos de estos canales generan corrientes tan parecidas a la corriente M, que la posibilidad de que fuesen su sustrato molecular gener una notable controversia en el ao 1997 [33-36], controversia que parece haberse zanjado con el descubrimiento de los KCNQ (vase el apartado anterior).
REV NEUROL 2005; 41 (9): 538-549
543
J.A. LAMAS
Corrientes catinicas tipo H (HCN) Es interesante que en algunos tipos neuronales, la corriente M de salida se coexpresa con la corriente H. Esta ltima se describi por primera vez en clulas del nodo senoauricular [37,38] y se llam If (por funny); posteriormente se encontr en neuronas [39], donde se llam IQ (por queer) y actualmente se suele llamar Ih (por hyperpolarization-activated) [40]. Es una corriente catinica mixta el canal es permeable a sodio y potasio modulada por AMPc. Su comportamiento es un tanto inusual, en el sentido en que se activa por la hiperpolarizacin y se cierra con la despolarizacin. Estas y otras caractersticas la convierten en una corriente clave para la generacin y regulacin de la actividad marcapasos del corazn y de otras neuronas espontneas. Los canales HCN, tambin llamados rectificadores anmalos, tienen un umbral de activacin alrededor de los 30 o 40 mV; este factor, unido a la carencia de inactivacin y a su PI (alrededor de 30 mV), les permite generar una pequea corriente de entrada (despolarizante) en reposo [14]. En algunas neuronas en las que coinciden las corrientes M y H, por ejemplo, neuronas del hipocampo y del ganglio cervical superior (GCS), se ha demostrado que colaboran de forma compleja para estabilizar el potencial de reposo [15,39]. Modelo de las neuronas simpticas del ganglio cervical superior La naturaleza de las corrientes inicas presentes en reposo se ha estudiado en muy pocas neuronas. En general, se asume que la membrana es pasiva alrededor del potencial de reposo, pero rara vez esto se ha comprobado. Un ejemplo claro de colaboracin entre las corrientes M y H, ambas dependientes del voltaje, para determinar el potencial de reposo se da en las neuronas del GCS de rata y ratn [15,24]. Estas neuronas muestran un potencial de reposo de unos 60 mV (Fig. 2b), claramente ms positivo que el potencial de equilibrio del potasio. Si se hace una curva corriente-voltaje, se observa una doble rectificacin desviacin de la lnea recta que debera aparecer si slo hubiese corriente de fuga a ambos lados del potencial de reposo (Fig. 3b). En electricidad se habla de rectificacin cuando la conductancia cambia con el voltaje [3]. A valores positivos con respecto al potencial de reposo, aparece una corriente de salida debida a la apertura de los canales de potasio tipo M (Fig. 3b), mientras que a valores negativos al potencial de reposo se observa una rectificacin de entrada debida a la apertura de los canales catinicos de tipo H [15,24] (Fig. 3c). Se puede demostrar que ambos tipos de canales estn parcialmente abiertos en reposo, porque al inhibir la corriente M la neurona se despolariza, y al inhibir la corriente H se hiperpolariza aproximadamente 10 mV en cada caso [15] (Figs. 4a y 4b). Estos dos canales ejercen un poderoso efecto estabilizador sobre el potencial de reposo porque tienen efectos opuestos sobre el Vm, como puede observarse en el esquema de la figura 2b (uno despolarizante y el otro hiperpolarizante). Adems, son dependientes del voltaje, de modo que en reposo (a 60 mV) slo un pequeo porcentaje de ellos est abierto; sin embargo, si se intentase despolarizar la membrana, se abriran ms canales de tipo M que tenderan a hiperpolarizarla, al mismo tiempo que se cerraran los de tipo H y dejaran de ejercer su efecto despolarizante (Fig. 3). Por el contrario, si se intenta hiperpolarizar la membrana, se abriran ms canales H que se opondran a la hiperpolarizacin y se cerraran los M, que, de ese modo, dejaran de empujar el potencial de membrana hacia valores ms negativos.
Figura 4. Influencia de las corrientes voltajedependientes y la bomba de Na/K en el potencial de reposo. a) La corriente M ejerce un efecto hiperpolarizante sobre el potencial de reposo; al inhibir dicha corriente con bario la membrana se despolariza. b) La corriente H ejerce el efecto contrario, de modo que al inhibirla con cesio la membrana se hiperpolariza. c) La inhibicin de la bomba de Na/K provoca una despolarizacin. Registros reales obtenidos de tres clulas del GCS de rata en cultivo con la utilizacin de la tcnica de sello perforado.
Adems del efecto estabilizador que ejercen las corrientes M y H, existen otros factores que influyen en el potencial de reposo de estas clulas. Tal vez el ms importante sea la corriente de fuga que, aunque no se ha identificado molecularmente, es una corriente mixta en la que participan los iones potasio (componente principal), sodio y cloro [15] (Fig. 2b). En estas clulas el cloro es importante, porque su potencial de equilibrio es ms positivo que el Vr (alrededor de 30 mV). Un factor adicional, aunque a menudo olvidado cuando se habla del potencial de reposo, es la bomba de Na/K; su mecanismo electrognico expulsa tres iones sodio por cada dos iones potasio que introduce en el interior celular hace que las membranas tengan un potencial ligeramente ms negativo del esperado al resolver la ecuacin de GHK [41]. Fruto de esta observacin han surgido varias modificaciones de la ecuacin de GHK en las que se aade la contribucin de dicha bomba; por ejemplo, la desarrollada recientemente por Armstrong [42], que tiene en cuenta la corriente generada por la bomba (Ip): RT Vm = F ln PK [K]i + PNa [Na]i + PCl [Cl]e + Ip/F PK [K]e + PNa [Na]e + PCl [Cl]i
544
REV NEUROL 2005; 41 (9): 538-549
POTENCIAL DE MEMBRANA
Corrientes de sodio Los canales de sodio presentan una menor variabilidad que los de potasio; actualmente se conocen nueve subunidades (Nav1.1 a Nav1.9), que se incluyen dentro de la familia de canales de sodio dependientes del voltaje, y una serie de protenas parecidas llamadas Nax que podran constituir una subfamilia adicional [44]. Generalmente, las corrientes de sodio son breves y transitorias debido a la rpida activacin e inactivacin de los canales dependientes del voltaje. Sin embargo, algunos de estos canales son capaces de generar corrientes de sodio persistentes y se implican en el mantenimiento del potencial de reposo.
Corrientes de sodio persistentes insensibles a TTX Un ejemplo de este comportamiento es el canal Nav1.9 (tambin llamado NaN), que produce una corriente persistente e insensible a la tetrodotoxina (TTX, bloqueador clsico de canales de sodio). Esta corriente se activa de forma lenta alrededor de 70 mV Figura 5. Corriente de sodio persistente. a) Corriente de entrada en respuesta a una rampa de y su inactivacin es ultralenta. Lo ms intevoltaje lenta que evita la activacin de la corriente de sodio transitoria (70 a +20 mV; 10 mV/s). La corriente de sodio persistente activa a 60 mV y se bloquea completamente con TTX. b) La resante es que sus curvas de activacin e corriente de entrada en respuesta a un salto de voltaje muestra tres componentes: un compoinactivacin tienen un gran solapamiento nente transitorio de inactivacin rpida (truncado), un componente de inactivacin lenta y un componente persistente (INa,p) que permanece al final del pulso. Todos ellos se bloquean comalrededor del potencial de reposo; esto signipletamente por TTX. c) Registro de un canal de sodio persistente individual con la utilizacin de fica que en reposo un porcentaje relativala modalidad cell-attached (electrodo pegado a la membrana) de la tcnica de patch-clamp. Se mente grande de canales no se inactiva y un observa la ausencia de inactivacin en respuesta a un salto de voltaje. Los registros mostrados proceden de tres clulas de los ncleos de las columnas dorsales en cultivo y se realizaron en porcentaje de stos puede adems activarse, presencia de bloqueadores especficos de canales de potasio, calcio y catinicos. Los registros y generar de esta forma una corriente persisen a y b se realizaron con la tcnica de sello perforado en la modalidad de clula entera. tente llamada corriente de ventana (window current). Esta corriente persistente de enLa importancia de este factor vara bastante y depende de la propia trada contribuye con un efecto despolarizante al valor del actividad de la bomba, pero tambin de la resistencia de la mem- potencial de reposo [45,46]. La localizacin ms o menos brana en reposo. En las neuronas del GCS, la inhibicin de esta selectiva de estos canales en las neuronas ms pequeas de los bomba con ouabana provoca una despolarizacin rpida de la ganglios de las races dorsales (tipo C), los ha hecho especialmembrana de unos 3 mV (Fig. 4c), y la bomba se comporta como mente interesantes en el estudio de la nocicepcin y en la bsuna corriente hiperpolarizante sin una aparente dependencia del queda de nuevos tratamientos contra el dolor. voltaje [13,15]. Es importante no confundir este efecto electrognico de la bomba de Na/K con su importante papel en el manteni- Corrientes de sodio persistentes sensibles a TTX miento de la asimetra en las concentraciones de Na y K, que a la La funcin ms llamativa de las corrientes de sodio dependienpostre es lo que genera el potencial de reposo. Recientemente, tes del voltaje es la generacin del potencial de accin, llevada a nuestro grupo ha detectado, adems, la presencia de una corriente cabo por la llamada corriente de sodio transitoria. Sin embargo, de sodio persistente (INaP), que parece contribuir con unos pocos en un buen nmero de clulas excitables, la corriente sensible a milivoltios al valor del potencial de reposo en las neuronas del TTX presenta adems un componente dependiente del voltaje GCS de rata y ratn [43]; se hablar de ella ms adelante. A modo que no inactiva (INaP) [47-53]. La INaP es una corriente de amplia distribucin en el SN de resumen, el valor del potencial de reposo de estas neuronas viene determinado por una corriente de fuga con tres componentes (hipocampo, cerebelo, estriado, tlamo, hipotlamo, corteza, (potasio, sodio y cloro), tres corrientes dependientes del voltaje mdula, bulbo, etc.), e incluye el axn gigante del calamar. A (potasio: IK(M), catinica: IH y de sodio persistente: INaP) y la con- pesar de que existen ciertas diferencias relacionadas con el tipo tribucin electrognica de la bomba de Na/K. Por supuesto, no se celular, las caractersticas esenciales de la INaP parecen bastante conservadas y su aspecto es siempre similar al mostrado en la descarta que en un futuro se puedan aadir otros componentes. Un modelo de complejidad similar se observa en las neuro- figura 5. Es una corriente que se activa a valores de potencial nas piramidales CA1 del hipocampo. Estas neuronas expresan bastante negativos (70 a 60 mV) e inactiva parcialmente o no varias subunidades de canales de potasio dependientes del volta- inactiva. Estas caractersticas le permiten ejercer un efecto desje con posibilidad de influir en el potencial de reposo, segn polarizante sobre el potencial de reposo y, por lo tanto, contriSaganich [32]: KCNQ2, KCNQ3, eag1, erg1, erg3, elk2 y elk3. buir a decidir su valor [54]. Se puede poner de manifiesto con la Esto nos da idea de la complejidad que puede alcanzar el poten- utilizacin de rampas lentas de voltaje para inactivar la corriente transitoria (Fig. 5a), saltos de voltaje (Fig. 5b) o regiscial de membrana en reposo.
REV NEUROL 2005; 41 (9): 538-549
545
J.A. LAMAS
Tabla II. Oscilaciones subumbrales. Mecanismos de generacin. Tipo celular Corteza frontal [57] Hipocampo CA1 [58] Corteza entorrinal [59] Corteza somatosensorial [60] Corteza frontal [61] Preparacin Cobaya, rodajas Rata, rodajas Rata, rodajas Rata, rodajas Cobaya, rodajas Mecanismo propuesto Sodio persistente Rectificador tardo Sodio Rectificador tardo Sodio persistente Rectificador tardo Sodio persistente Rectificador tardo Sodio persistente Corriente M Corriente de fuga
c Septo medial [62] Ncleo tegmental peduculopontino [63] Ncleo lateral amgdala [64] Complejo amigdaloide basolateral [65] Ncleo facial [66] Corteza entorrinal [67] Ncleo supraptico hipotalmico [68] Ganglio raz dorsal [69] Ncleo columnas dorsales [52] Rata, rodajas Rata, rodajas Gato, in vivo Gato, rodajas Cobaya, rodajas Rata, rodajas Rata, rodajas Rata, rodajas Sensible a TTX IKs Sodio persistente Sensible a TTX Sodio persistente Corriente M Sensible a TTX Sodio persistente Corriente H Sensible a TTX Sensible a TEA Figura 6. Oscilaciones de bajo umbral. a) Actividad espontnea de una neurona de los ncleos de las columnas dorsales de rata en cultivo. El registro muestra las tpicas oscilaciones subumbrales acompaadas de un patrn de disparo en grupos de potenciales de accin (clusters). b) Tanto las oscilaciones subumbrales como los clusters desaparecen al aplicar TTX. c) El efecto de la TTX es reversible. Registros obtenidos con la tcnica de sello perforado; los potenciales de accin se han truncado.
Rata, in vivo Rata, ganglio in vitro Rata, cultivo celular Sodio persistente Potasio tipo M
trando canales individuales (Fig. 5c), y se bloquea totalmente por TTX (Figs. 5a y 5b). Se ha sugerido que la presencia de esta corriente en las dendritas puede funcionar como un mecanismo de amplificacin de los potenciales postsinpticos excitadores [55], pero la funcin ms llamativa de esta corriente es la de participar en la generacin de oscilaciones subumbrales, como se ver a continuacin. El sustrato molecular de la corriente de sodio persistente permanece sin determinar; sin embargo, se barajan tres hiptesis acerca de su origen [53]: 1. Que sea el resultado de un cambio en la cintica de inactivacin de los canales que generan la corriente transitoria (modal gating). 2. Que sea la corriente de ventana de dichos canales. 3. Que sea fruto de un nuevo tipo de canal de sodio y, por lo tanto, todava desconocido. OSCILACIONES SUBUMBRALES La presencia de canales dependientes del voltaje abiertos en reposo tiene gran importancia en la excitabilidad de las neuronas; al fin y al cabo acercan o alejan dicho reposo del potencial umbral para la generacin de potenciales de accin. En muchos casos estos canales son imprescindibles para generar los comportamientos oscilatorios de disparo que llamamos marcapasos. Algunas de
estas oscilaciones supraumbrales se han estudiado profundamente, y se ha constatado la gran importancia de algunas de las corrientes dependientes del voltaje ya descritas, como, por ejemplo, la corriente H. Tal vez las mejor conocidas son las encontradas en neuronas del tlamo [56] o del nodo senoauricular [37]. Por el contrario, las oscilaciones subumbrales sin disparo de potenciales de accin han recibido poca atencin hasta hace unos aos; sin embargo, son un buen ejemplo de que no se necesita la participacin de corrientes de calcio y de potasio dependientes del calcio para obtener comportamientos oscilatorios y rtmicos. No fue fcil aceptar, y probablemente todava no lo es, que muchas neuronas no tienen potenciales de membrana estables en ausencia de informacin externa. Esta resistencia se deriva seguramente de la palabra reposo, que transmite la idea de que las membranas deben tener un potencial de membrana en reposo nico y fcilmente mensurable. En los ltimos aos se han descrito oscilaciones de bajo umbral en un gran nmero de tipos neuronales (low threshold oscillations, LTO). Las LTO no son ms que variaciones rtmicas del potencial de membrana en condiciones en las que la neurona debera tener un potencial estable, es decir, estar en reposo. Esto nos lleva a entender el potencial de reposo podemos mantener la nomenclatura clsica como un equilibrio dinmico inestable. Se han observado LTO en neuronas cultivadas [52], neuronas en rodajas e incluso en neuronas registradas in vivo; la tabla II muestra algunas de las muchas oscilaciones subumbrales descritas en la literatura y el mecanismo de funcionamiento propuesto [52,57-69]. Este tipo de oscilaciones no tienen nada de azaroso, sino que se provocan por la actividad de canales inicos y, por lo
546
REV NEUROL 2005; 41 (9): 538-549
POTENCIAL DE MEMBRANA
tanto, son sensibles a bloqueadores especficos. Aunque la frecuencia y la amplitud de las oscilaciones vara ligeramente segn el tipo de neurona, la mayora de las LTO estudiadas hasta el momento se asocian directamente con la presencia de una corriente de sodio persistente (INaP) y, por lo tanto, son sensibles a TTX (Fig. 6) y otros bloqueadores de esta corriente. Aunque ms controvertido, se acepta en general que debe existir una corriente adicional que contrabalancee el efecto de la INaP para que el sistema pueda oscilar. En varios tipos celulares la corriente M parece la candidata a realizar este trabajo; debemos resaltar que ambas corrientes son persistentes, dependientes de voltaje y se abren alrededor de los 70 a 60 mV; adems, una de ellas es de salida y la otra de entrada, con lo que ejerceran efectos opuestos sobre el potencial de membrana. En otros tipos celulares la corriente M parece sustituirse por la corriente H, la corriente de fuga u otras corrientes de potasio. Es muy probable que este factor dependa en realidad del tipo celular estudiado y explique as esta controversia (Tabla II). En el caso particular de las neuronas de los ncleos de las columnas dorsales de rata en cultivo, estudiado recientemente en nuestro laboratorio [52], las oscilaciones subumbrales rtmicas (10 Hz) se acompaan, adems, de un patrn de disparo en grupos de 2-5 potenciales de accin (llamados clusters) tambin rtmico (1 Hz) (Fig. 6). Es habitual que las neuronas con oscilaciones de bajo umbral disparen clusters, y sugieran un mecanismo compartido para ambos fenmenos. Aunque este patrn de comportamiento es intrnseco la clula en cultivo se asla completamente y espontneo, la frecuencia de la oscilacin subumbral depende del voltaje, e indica que en condiciones fisiolgicas la informacin procedente de otras neuronas es capaz de modular dicho patrn. Existe adems una correlacin muy alta entre la frecuencia de las oscilaciones subumbrales y la frecuencia de potenciales de accin dentro de los clusters, lo que sugiere que dichas oscilaciones de bajo umbral determinan la frecuencia de disparo de la neurona. Si esto es as, las oscilaciones podran ejercer tambin un efecto de filtrado, es decir, cada neurona tendra una frecuencia preferente y tendera a filtrar toda la informacin externa que le llegue a otras frecuencias [54]. Tambin se le ha asignado a este fenmeno un papel importante en la sincronizacin de poblaciones neuronales y se ha asociado con la generacin del ritmo theta [70]. Si un grupo de neuronas muestra oscilaciones subumbrales rtmicas de una frecuencia similar, una pequea despolarizacin les hara disparar potenciales de accin de forma sincronizada y rtmica. Esto significa que no se necesita una entrada sinptica rtmica y sincrnica para que un grupo de neuronas oscile a una determinada frecuencia. En realidad, ni siquiera se necesita que las neuronas de una red disparen potenciales de accin rtmicamente para que la red tenga una salida rtmica; basta conque las neuronas de la red presenten oscilaciones subumbrales a la misma frecuencia y estn en fase. ASPECTOS CLNICOS RELACIONADOS CON LOS CANALES DE REPOSO Las mutaciones que se producen en genes que codifican canales inicos generan varios tipos de enfermedades llamadas canalopatas. Este tipo de enfermedades no se asocian nicamente con el SN, sino que se han encontrado, entre otros, en el msculo, sistema endocrino o rin, y seguramente podran afectar a cualquier sistema, ya que todas las clulas tienen canales inicos en sus membranas. La relacin de enfermedades humanas asocia-
das a canalopatas ha crecido considerablemente en los ltimos aos y parece que lo har todava en los prximos. Los tipos de canales susceptibles de generar canalopatas han crecido de forma paralela, de modo que existen enfermedades asociadas con mutaciones en canales de sodio, potasio, cloro, calcio, catinicos e incluso con canales de las uniones hendidas, entre otros [71-73]. Dentro de las canalopatas relacionadas con el potencial de reposo, la corriente M tambin ha atrado gran inters. Durante mucho tiempo se sospech que exista una relacin entre los canales de potasio y la epilepsia; pero la demostracin inequvoca tuvo que esperar hasta el ao 1998, en que se observ que las mutaciones en las subunidades KCNQ2 y KCNQ3 tienen una relacin directa con la epilepsia neonatal benigna [27,74]. La reduccin de la corriente de potasio a travs de estos canales produce un incremento de excitabilidad en las neuronas que los expresan. El incremento de excitabilidad en este caso, probablemente se deba a dos factores: la despolarizacin del potencial de membrana y la reduccin de la adaptacin que suelen mostrar las neuronas que expresan estos canales cuando se inhibe la corriente M. Este ejemplo demuestra que pequeos cambios en las propiedades electrofisiolgicas de un tipo de canal pueden producir efectos importantes sobre el comportamiento. Tambin es de inters el hecho de que los bloqueadores de la corriente M mejoren el aprendizaje en modelos animales [75], de modo que se ha hecho un gran esfuerzo para desarrollar inhibidores especficos de dicha corriente (linopirdina o XE991) con la intencin de utilizarlos como posible tratamiento del Alzheimer [24,76-78]. Aunque los ensayos clnicos no han dado los resultados esperados, estos inhibidores han contribuido mucho a la identificacin del correlato molecular de la corriente M, los KCNQ [25]. Otros tipos de epilepsias, como la epilepsia generalizada con ataques febriles, se han relacionado con mutaciones en los canales de sodio dependientes del voltaje Nav1.1 y en las subunidades que regulan estos canales [79]. De forma similar, las mutaciones en la subunidad Nav1.2 del msculo esqueltico pueden dar origen a algunos tipos de parlisis peridica y la mutacin de la subunidad Nav1.5 del msculo cardaco da origen al sndrome QT largo [72]. En los tres casos, la mutacin afecta al proceso de inactivacin del canal de sodio transitorio que se traduce en la aparicin de una corriente de sodio persistente patolgica. En este caso, la mutacin no afecta a una corriente de sodio de reposo, sino que genera una que no exista; esta corriente tiene un efecto despolarizante e incrementa la excitabilidad. Es posible que no exista una relacin directa entre la corriente de sodio persistente fisiolgica (INa,P) y las epilepsias, pero algunos de los frmacos utilizados en el tratamiento de algunas epilepsias, como el valproato, bloquean dicha corriente con mayor potencia que la transitoria [43]. Esto sugiere que la corriente persistente patolgica y fisiolgica comparten caractersticas comunes y abre una nueva lnea de investigacin en este campo. Tambin el agente neuroprotector riluzol, utilizado en el tratamiento de la esclerosis lateral amiotrfica, inhibe la corriente de sodio persistente [52,80]. CONCLUSIONES Los datos que se han revisado en este trabajo nos llevan a una conclusin que tiene lo mismo de simple que de importante: las neuronas, o al menos un buen nmero de ellas, no reposan en sentido estricto. Esto significa que, si se quiere comprender el funcionamiento de una neurona, no basta con estudiar la informacin que recibe de otras neuronas. Es incluso posible que en
REV NEUROL 2005; 41 (9): 538-549
547
J.A. LAMAS
algunas ocasiones las propiedades intrnsecas sean ms importantes que la informacin externa a la hora de determinar la respuesta final de una neurona, aunque obviamente estos dos factores interaccionan continuamente de una manera compleja. Aunque las oscilaciones subumbrales del potencial de membrana son en general de baja amplitud, pueden ser crticas en el control de la excitabilidad celular. Estas neuronas tenderan a disparar a la frecuencia de la oscilacin y responderan mejor a las entradas sinpticas codificadas en dicha frecuencia. Este comportamiento debe servir, adems, para facilitar el dis-
paro de una poblacin neuronal a una determinada frecuencia, lo que podra relacionarlas con algunos ritmos electroencefalogrficos. Si se quiere comprender el funcionamiento del SN y el origen de las patologas que lo afectan, se debe hacer un esfuerzo para conocer el mecanismo que utilizan las neuronas para mantener el potencial de reposo, y entender que ste no es necesariamente estable. Las corrientes dependientes del voltaje de bajo umbral y que no inactivan son probablemente las principales dianas a tener en cuenta.
BIBLIOGRAFA 1. Buo W. Propiedades elctricas de las membranas de las clulas excitables. In Delgado JM, Ferrs A, Mora F, Rubia JR, eds. Manual de neurociencia. Madrid: Sntesis; 1998. p. 121-37. 2. Nernst WH. Zur kinetik der in lsung befindlichen krper: theorie der diffusion. Z Phys Chem 1888; 2: 613-37. 3. Hille B. Ion channels of excitable membranes. Sunderland: Sinauer Associates; 2001. 4. Ben-Ari Y. Excitatory actions of GABA during development: the nature of the nurture. Nat Rev Neurosci 2002; 3: 728-39. 5. McCormick DA. Membrane potential and action potential. In Zigmond MJ, Bloom FE, Landis SC, Roberts JL, Squire LR, eds. Fundamental neuroscience. San Diego: Academic Press; 1999. p. 129-54. 6. Curtis HJ, Cole KS. Membrane resting and action potentials in giant fibres of squid nerve. J Cell Comp Physiol 1942; 19: 135-44. 7. Hodgkin AL. The ionic basis of electrical activity in nerve and muscle. Biol Rev 1951; 26: 339-409. 8. Aidley DJ. The physiology of excitable cells. Cambridge: Cambridge University Press; 1989. 9. Goldman DE. Potential, impedance and rectification in membranes. J Gen Physiol 1943; 27: 37-60. 10. Hodgkin AL, Katz B. The effect of sodium ions on the electrical activity of the giant axon of the squid. J Physiol 1949; 108: 37-77. 11. Johnston D, Wu SMS. Foundations of cellular neurophysiology. Cambridge, Mass: MIT Press; 1995. 12. Koester J, Siegelbaum SA. Potencial de membrana. In Kandel ER, Schwartz JH, Jessell TM, eds. Principios de neurociencia. Madrid: McGraw-Hill, Interamericana; 2001. p. 125-39. 13. Jones SW. On the resting potential of isolated frog sympathetic neurons. Neuron 1989; 3: 153-61. 14. Lamas JA. A hyperpolarization-activated cation current (Ih) contributes to resting membrane potential in rat superior cervical sympathetic neurones. Pflgers Arch 1998; 436: 429-35. 15. Lamas JA, Reboreda A, Codesido V. Ionic basis of the resting membrane potential in cultured rat sympathetic neurons. Neuroreport 2002; 13: 585-91. 16. Talley EM, Lei Q, Sirois JE, Bayliss DA. TASK-1, a two-pore domain K+ channel, is modulated by multiple neurotransmitters in motoneurons. Neuron 2000; 25: 399-410. 17. Millar JA, Barratt L, Southan AP, Page KM, Fyffe RE, Robertson B, Mathie A. A functional role for the two-pore domain potassium channel TASK-1 in cerebellar granule neurons. Proc Natl Acad Sci USA 2000; 97: 3614-8. 18. Mathie A, Clarke CE, Ranatunga KM, Veale EL. What are the roles of many different types of potassium channel expressed in cerebellar granule cells? Cerebellum 2003; 2: 11-25. 19. Brown DA. The acid test for resting potassium channels. Curr Biol 2000; 10: 456-9. 20. Talley EM, Sirois JE, Lei Q, Bayliss DA. Two-pore-domain (KCNK) potassium channels: dynamic roles in neuronal function. Neuroscientist 2003; 9: 46-56. 21. Sakmann B, Neher E. Single-channel recording. New York: Plenum Press; 1995. 22. Brown DA, Adams PR. Muscarinic suppression of a novel voltage-sensitive K+ current in a vertebrate neurone. Nature 1980; 283: 673-6. 23. Brown DA. M-currents: an update. Trends Neurosci 1988; 11: 294-9. 24. Romero M, Reboreda A, Snchez E, Lamas JA. Newly developed blockers of the M-current do not reduce spike frequency adaptation in cultured mouse sympathetic neurones. Eur J Neurosci 2004; 19: 2693-702. 25. Wang HS, Pan Z, Shi W, Brown BS, Wymore RS, Cohen IS, et al. KCNQ2 and KCNQ3 potassium channel subunits: molecular correlates of the M-channel. Science 1998; 282: 1890-3. 26. Schroeder BC, Hechenberger M, Weinreich F, Kubisch C, Jentsch TJ. KCNQ5, a novel potassium channel broadly expressed in brain, mediates M-type currents. J Biol Chem 2000; 275: 24089-95. 27. Jentsch TJ. Neuronal KCNQ potassium channels: physiology and role in disease. Nat Rev Neurosci 2000; 1: 21-30. 28. Brown BS, Yu SP. Modulation and genetic identification of the M channel. Prog Biophys Mol Biol 2000; 73: 135-66. 29. Robbins J. KCNQ potassium channels: physiology, pathophysiology, and pharmacology. Pharmacol Ther 2001; 90: 1-19. 30. Warmke JW, Ganetzky B. A family of potassium channel genes related to eag in Drosophila and mammals. Proc Natl Acad Sci USA 1994; 91: 3438-42. 31. Saganich MJ, Vega S, Nadal MS, Baker H, Coetzee WA, Rudy B. Cloning of components of a novel subthreshold-activating K(+) channel with a unique pattern of expression in the cerebral cortex. J Neurosci 1999; 19: 10789-802. 32. Saganich MJ, Machado E, Rudy B. Differential expression of genes encoding subthreshold-operating voltage-gated K+ channels in brain. J Neurosci 2001; 21: 4609-24. 33. Stansfeld C, Ludwig J, Roeper J, Weseloh R, Brown DA, Pongs O. A physiological role for ether--go-go K+ channels? Trends Neurosci 1997; 20: 13-4. 34. Mathie A, Watkins CS. Is EAG the answer to the M-current? Trends Neurosci 1997; 20: 14. 35. Marrion NV. Does r-EAG contribute to the M-current? Trends Neurosci 1997; 20: 243. 36. Stansfeld C, Ludwig J, Roeper J, Weseloh R, Brown DA, Pongs O. Reply to: Does r-EAG contribute to the M-current? by Marrion NV. Trends Neurosci 1997; 20: 243-4. 37. Brown HF, DiFrancesco D. Voltage-clamp investigations of currents underlying pacemaker activity in rabbit sino-atrial node. J Physiol (Lond) 1980; 308: 331-51. 38. Yanagihara K, Irisawa H. Inward current activated during hyperpolarization in the rabbit sinoatrial node cell. Pflugers Arch 1980; 385: 11-9. 39. Halliwell JV, Adams PR. Voltage-clamp analysis of muscarinic excitation in hippocampal neurons. Brain Res 1982; 250: 71-92. 40. Pape HC. Queer current and pacemaker: the hyperpolarization-activated cation current in neurons. Annu Rev Physiol 1996; 58: 299-327. 41. Thomas RC. Electrogenic sodium pump in nerve and muscle cells. Physiol Rev 1972; 52: 563-94. 42. Armstrong CM. The Na/K pump, Cl ion, and osmotic stabilization of cells. Proc Natl Acad Sci USA 2003; 100: 6257-62. 43. Romero M, Reboreda A, Snchez E, Lamas JA. Properties of a newly identified persistent Na+ current in cultured mouse sympathetic neurones [abstract]. Lisboa: IV Forum of European Neuroscience; 2004. 44. Goldin AL, Barchi RL, Caldwell JH, Hofman F, Howe JR, Hunter JC, et al. Nomenclature of voltage-gated sodium channels. Neuron 2000; 28: 365-8. 45. Dib-Hajj SD, Black JA, Cummins TR, Waxman SG. NaN/Nav1.9: a sodium channel with unique properties. Trends Neurosci 2002; 25: 253-9. 46. Rugiero F, Mistry M, Sage D, Black JA, Waxman SG, Crest M, et al. Selective expression of a persistent tetrodotoxin-resistant Na+ current and Nav1.9 subunit in myenteric sensory neurons. J Neurosci 2003; 23: 2715-25. 47. Hoston JR, Prince DA. Anomalous inward rectification in hippocampal neurons. J Neurophysiol 1979; 42: 889-95. 48. Llins RR, Sugimori M. Electrophysiological properties of in vitro Purkinje cell somata in mammalian cerebellar slices. J Physiol (Lond) 1980; 305: 171-95. 49. Patlak JB, Ortiz M. Two modes of gating during Late Na+ channel currents in frog sartorius muscle. J Gen Physiol 1986; 87: 305-26. 50. Alonso A, Llins RR. Subthreshold Na+-dependent theta-like rhythmicity in stellate cells of entorhinal cortex layer II. Nature 1989; 342: 175-7.
548
REV NEUROL 2005; 41 (9): 538-549
POTENCIAL DE MEMBRANA
51. French CR, Sah P, Buckett KJ, Gage PW. A voltage-dependent persistent sodium current in mammalian hippocampal neurons. J Gen Physiol 1990; 95: 1139-57. 52. Reboreda A, Snchez E, Romero M, Lamas JA. Intrinsic spontaneous activity and subthreshold oscillations in neurones of the rat dorsal column nuclei in culture. J Physiol (Lond) 2003; 551: 191-205. 53. Crill WE. Persistent sodium current in mammalian central neurons. Annu Rev Physiol 1996; 58: 349-62. 54. Wu N, Hsiao C-F, Chandler SH. Membrane resonance and subthreshold membrane oscillations in mesencephalic V neurons: participants in burst generation. J Neurosci 2001; 21: 3729-39. 55. Schwindt PC, Crill WE. Amplification of synaptic current by persistent sodium conductance in apical dendrite of neocortical neurons. J Neurophysiol 1995; 74: 2220-4. 56. McCormick DA, Pape HC. Properties of a hyperpolarization-acivated cation current and its role in rhythmic oscillation in thalamic relay neurones. J Physiol (Lond) 1990; 431: 291-318. 57. Llins RR, Grace AA, Yarom Y. In vitro neurons in mammalian cortical layer 4 exhibit intrinsic oscillatory activity in the 10- to 50-Hz frequency range. Proc Natl Acad Sci USA 1991; 88: 897-901. 58. Leung LW, Yim CY. Intrinsic membrane potential oscillations in hippocampal neurons in vitro. Brain Res 1991; 553: 261-74. 59. Klink R, Alonso A. Ionic mechanisms for the subthreshold oscillations and differential electroresponsiveness of medial entorhinal cortex layer II neurons. J Neurophysiol 1993; 70: 144-57. 60. Amitai Y. Membrane potential oscillations underlying firing patterns in neocortical neurons. Neuroscience 1994; 63: 151-61. 61. Gutfreund Y, Yarom Y, Segev I. Subthreshold oscillations and resonant frequency in guinea-pig cortical neurons: physiology and modelling. J Physiol 1995; 483: 621-40. 62. Serafin M, Williams S, Khateb A, Fort P, Muhlethaler M. Rhythmic firing of medial septum non-cholinergic neurons. Neuroscience 1996; 75: 671-5. 63. Takakusaki K, Kitai ST. Ionic mechanisms involved in the spontaneous firing of tegmental pedunculopontine nucleus neurons of the rat. Neuroscience 1997; 78: 771-94. 64. Pape HC, Pare D, Driesang RB. Two types of intrinsic oscillations in neurons of the lateral and basolateral nuclei of the amygdala. J Neurophysiol 1998; 79: 205-16. 65. Pape HC, Driesang RB. Ionic mechanisms of intrinsic oscillations in neurons of the basolateral amygdaloid complex. J Neurophysiol 1998; 79: 217-26.
66. Magarios-Ascone C, Nez A, Delgado JM. Different discharge properties of rat facial nucleus motoneurons. Neuroscience 1999; 94: 879-86. 67. Dickson CT, Magistretti J, Shalinsky MH, Fransen E, Hasselmo ME, Alonso A. Properties and role of I(h) in the pacing of subthreshold oscillations in entorhinal cortex layer II neurons. J Neurophysiol 2000; 83: 2562-79. 68. Boehmer G, Greffrath W, Martin E, Hermann S. Subthreshold oscillation of the membrane potential in magnocellular neurones of the rat supraoptic nucleus. J Physiol 2000; 526: 115-28. 69. Amir R, Michaelis M, Devor M. Burst discharge in primary sensory neurons: triggered by subthreshold oscillations, maintained by depolarizing after potentials. J Neurosci 2002; 22: 1187-98. 70. Lampl I, Yarom Y. Subthreshold oscillations of the membrane potential: a functional synchronizing and timing device. J Neurophysiol 1993; 70: 2181-6. 71. Cooper EC, Jan LY. Ion channel genes and human neurological disease: recent progress, prospects, and challenges. Proc Natl Acad Sci USA 1999; 96: 4759-66. 72. Ashcroft FM. Ion channels and disease. S. Diego: Academic Press; 2000. 73. Hubner CA, Jentsch TJ. Ion channel diseases. Hum Mol Genet 2002; 11: 2435-45. 74. Biervert C, Schroeder BC, Kubisch C, Berkovic SF, Propping P, Jentsch TJ, et al. A potassium channel mutation in neonatal human epilepsy. Science 1998; 279: 403-6. 75. Zaczek R, Saydoff J. Depolarization activated releasers of transmitters as therapeutics for dementia: Preclinical characterization of linopirdine (DuP 996). Curr Opin Invest Drugs 1993; 2: 1097-104. 76. Aiken SP, Lampe BJ, Murphy PA, Brown BS. Reduction of spike frequency adaptation and blockade of M-current in rat CA1 pyramidal neurones by linopirdine (DuP 996), a neurotransmitter release enhancer. Br J Pharmacol 1995; 115: 1163-8. 77. Aiken SP, Zaczek R, Brown BS. Pharmacology of the neurotransmitter release enhancer linopirdine (DuP 996), and insights into its mechanism of action. Adv Pharmacol 1996; 35: 349-84. 78. Lamas JA, Selyanko AA, Brown DA. Effects of a cognition-enhancer, linopirdine (DuP 996), on M-type potassium currents (IK(M)) and some other voltage- and ligand-gated membrane currents in rat sympathetic neurons. Eur J Neurosci 1997; 9: 605-16. 79. Lossin C, Wang DW, Rhodes TH, Vanoye C, George AL Jr. Molecular basis of an inherited epilepsy. Neuron 2002; 34: 877-84. 80. Urbani A, Belluzzi O. Riluzole inhibits the persistent sodium current in mammalian CNS neurons. Eur J Neurosci 2000; 12: 3567-74.
EVOLUCIN DEL CONCEPTO DE POTENCIAL DE REPOSO NEURONAL. ASPECTOS BSICOS Y CLNICOS Resumen. Introduccin y objetivo. Desde los trabajos clsicos en el axn gigante del calamar, el estudio del potencial de membrana en reposo ha recibido mucha menor atencin que el estudio de los cambios de potencial (potenciales de accin, potenciales sinpticos, etc.). Se asume con frecuencia que el potencial de reposo depende de una corriente independiente del voltaje llamada corriente de fuga, aunque, salvo muy raras excepciones, no se ha podido caracterizar farmacolgica o molecularmente dicha corriente. En este trabajo se pretende revisar y actualizar el concepto de potencial de reposo. Desarrollo. El panorama actual nos dibuja una situacin compleja en la que varios factores, adems de las corrientes de fuga, contribuyen al mantenimiento del potencial de reposo. Entre estos factores destacan las corrientes inicas a travs de canales dependientes de voltaje que no inactivan, la bomba de sodio/potasio y algunas corrientes con caractersticas similares a la de fuga clsica. La interaccin de todos estos componentes provoca en las neuronas comportamientos subumbrales complejos, como las oscilaciones rtmicas intrnsecas, que nos alejan del concepto pasivo del potencial de reposo. Conclusiones. Las descripciones de actividad intrnseca subumbral y rtmica son cada vez ms numerosas, lo que podra sugerir que son fenmenos generalizados en el sistema nervioso. Se debe profundizar en los complejos mecanismos que determinan el potencial de reposo para comprender los fenmenos de excitabilidad neuronal y desentraar algunas de las muchas patologas que afectan al sistema nervioso. [REV NEUROL 2005; 41: 538-49] Palabras clave. Canales dependientes de voltaje. Canalopatas. Corrientes de fuga. Oscilaciones de bajo umbral. Potencial de reposo.
EVOLUO DO CONCEITO DE POTENCIAL DE REPOUSO NEURONAL. ASPECTOS BSICOS E CLNICOS Resumo. Introduo e objectivo. Desde os trabalhos clssicos no eixo da lula gigante, o estudo do potencial da membrana em repouso recebeu muito menos ateno que os estudos das alteraes de potencial (potenciais de aco, potenciais sinpticos, etc.). Assume-se com frequncia que o potencial de repouso depende de uma corrente independente da voltagem chamada corrente de fuga, ainda que, salvo muitas raras excepes, no se tenha podido caracterizar farmacolgica ou molecularmente a referida corrente. Neste trabalho pretende-se rever e actualizar o conceito de potencial de repouso. Desenvolvimento. O panorama actual desenha uma situao complexa na qual vrios factores, alm das correntes de fuga, contribuem para manter o potencial de repouso. Entre estes factores destacam-se as correntes inicas atravs de canais dependentes da voltagem que no inactivam, a bomba de sdio/potssio e algumas correntes com caractersticas similares da fuga clssica. A interaco de todos estes componentes provoca nos neurnios comportamentos subliminares complexos, como as oscilaes rtmicas intrnsecas, que nos afastam do conceito passivo do potencial de repouso. Concluses. As descries da actividade intrnseca subliminar e rtmica so cada vez mais numerosas, o que poderia sugerir que so fenmenos generalizados no sistema nervoso. Deve-se aprofundar os mecanismos complexos que determinam o potencial de repouso para compreender os fenmenos de excitabilidade neuronal e descobrir algumas das muitas patologias que afectam o sistema nervoso. [REV NEUROL 2005; 41: 538-49] Palavras chave. Canais dependentes de voltagem. Canalopatias. Correntes de fuga. Oscilaes de baixo limiar. Potencial de repouso.
REV NEUROL 2005; 41 (9): 538-549
549
Вам также может понравиться
- Junction Transistors: The Commonwealth and International Library: Applied Electricity and ElectronicsОт EverandJunction Transistors: The Commonwealth and International Library: Applied Electricity and ElectronicsОценок пока нет
- A-Level Chemistry Revision: Cheeky Revision ShortcutsОт EverandA-Level Chemistry Revision: Cheeky Revision ShortcutsРейтинг: 4 из 5 звезд4/5 (5)
- Lamas JA, 2005. Evolución Del Concepto de Potencial de Reposo NeuronalДокумент12 страницLamas JA, 2005. Evolución Del Concepto de Potencial de Reposo NeuronalFranklin MorenoОценок пока нет
- Electrical Properties of BiomembranesДокумент52 страницыElectrical Properties of Biomembranesc3rberussОценок пока нет
- Membrane PotentialsДокумент7 страницMembrane PotentialsJessica Leika MatibagОценок пока нет
- Excitable Tissue PhysiologyДокумент13 страницExcitable Tissue PhysiologyAlbert Che33% (3)
- Introduction To RMP ND APДокумент78 страницIntroduction To RMP ND APHariharanОценок пока нет
- 3 The Electrochemical Basis of Nerve FunctionДокумент33 страницы3 The Electrochemical Basis of Nerve FunctionEvets JarusОценок пока нет
- BMS1052 - Resting Membrane Potential RevisionДокумент5 страницBMS1052 - Resting Membrane Potential RevisionshaОценок пока нет
- Questions ExplanationДокумент17 страницQuestions ExplanationnomintmОценок пока нет
- Membrane Potential and Action PotentialДокумент30 страницMembrane Potential and Action Potentialironik kimiaОценок пока нет
- Fundamentals of BiophysicsДокумент26 страницFundamentals of Biophysicshoneytrap99Оценок пока нет
- الوحدة الأولىДокумент16 страницالوحدة الأولىHUAWEI HUAWEIОценок пока нет
- Key Points RevisionДокумент124 страницыKey Points RevisionSumeyyah KemalОценок пока нет
- Unit 1 Bio Potential Generation and Electrode TypesДокумент13 страницUnit 1 Bio Potential Generation and Electrode TypesAleeshaОценок пока нет
- Chapter 2 - Membrane PhysiologyДокумент11 страницChapter 2 - Membrane Physiologytahira UroojОценок пока нет
- Measurement of Cellular Excitability by Whole Cell Patch Clamp TechniqueДокумент7 страницMeasurement of Cellular Excitability by Whole Cell Patch Clamp TechniqueWai GeorgОценок пока нет
- Basics of Biomedical Instrumentation: Measuring Bioelectric PotentialsДокумент24 страницыBasics of Biomedical Instrumentation: Measuring Bioelectric PotentialsSteni GОценок пока нет
- Membrane Potentials and Action PotentialsДокумент24 страницыMembrane Potentials and Action PotentialsDenniel Dela Cuadra GasmenОценок пока нет
- Channelopathies: Ion Channel Defects Linked To Heritable Clinical DisordersДокумент12 страницChannelopathies: Ion Channel Defects Linked To Heritable Clinical Disorderscote_cote6951Оценок пока нет
- Hodgkin 1952Документ45 страницHodgkin 1952Thalia JuarezОценок пока нет
- Biology 4822: Resting Membrane Potential Reviewed and ContinuedДокумент30 страницBiology 4822: Resting Membrane Potential Reviewed and ContinuedKimberly Parton BolinОценок пока нет
- Mechanisms of Neuromuscular Block: A Review Article C. MДокумент22 страницыMechanisms of Neuromuscular Block: A Review Article C. Mbisweswar ojhaОценок пока нет
- Membrane Potentials.. Hassan ElalafДокумент11 страницMembrane Potentials.. Hassan Elalafislam rashadОценок пока нет
- Physiology of Excitable Tissues LectureДокумент71 страницаPhysiology of Excitable Tissues LectureVikiОценок пока нет
- What Is Resting Membrane Potential?: Mechanism of An Action PotentialДокумент5 страницWhat Is Resting Membrane Potential?: Mechanism of An Action PotentialAli InamОценок пока нет
- Neurophysiology: Biological membranes, synapses, neurotransmittersДокумент117 страницNeurophysiology: Biological membranes, synapses, neurotransmittersRachel CajilesОценок пока нет
- Stomatal Openings Lab 3 Bio 316Документ9 страницStomatal Openings Lab 3 Bio 316Koketso MogweОценок пока нет
- Hypokalemia and Anesthetic Implications ReviewДокумент23 страницыHypokalemia and Anesthetic Implications ReviewRidski D. MiruОценок пока нет
- (Methods in Molecular Biology) Jac A. Nickoloff - Animal Cell Electroporation and Electrofusion Protocols-Humana Press (1995)Документ358 страниц(Methods in Molecular Biology) Jac A. Nickoloff - Animal Cell Electroporation and Electrofusion Protocols-Humana Press (1995)Strange LoveОценок пока нет
- Quantum States in Proteins and Protein Assemblies: The Essence of Life?Документ11 страницQuantum States in Proteins and Protein Assemblies: The Essence of Life?GjosmОценок пока нет
- NROSCI 1012 - Lecture 13Документ4 страницыNROSCI 1012 - Lecture 13HonzaОценок пока нет
- Resting PotentialДокумент16 страницResting PotentialLuciana R LarregainОценок пока нет
- Action Potential: Ion Channel Opening Triggers Rapid DepolarizationДокумент31 страницаAction Potential: Ion Channel Opening Triggers Rapid DepolarizationJennie KimОценок пока нет
- 03.resting Potential & Action PotentialДокумент122 страницы03.resting Potential & Action Potentialapi-19916399Оценок пока нет
- Biophysics-Lectures-2012-3 (Physiology) PDFДокумент107 страницBiophysics-Lectures-2012-3 (Physiology) PDFNedelcuGeorgeОценок пока нет
- Action Potential - The Resting Membrane Potential - Generation of Action Potentials - TeachMePhysiologAyДокумент4 страницыAction Potential - The Resting Membrane Potential - Generation of Action Potentials - TeachMePhysiologAymohammed awolОценок пока нет
- Cholesterol islands on waterДокумент14 страницCholesterol islands on waterLuzyaneJaimesOrtizОценок пока нет
- Topical Review: Membrane BiologyДокумент20 страницTopical Review: Membrane BiologyHei MistoireОценок пока нет
- Encyc Human Brain 00Документ31 страницаEncyc Human Brain 00humsuplohОценок пока нет
- The Morphological Aspects of Sodium TransportДокумент14 страницThe Morphological Aspects of Sodium TransportDeeptha SivadhasanОценок пока нет
- Mechanisms of Proton Conductance in Polymer Electrolyte MembranesДокумент17 страницMechanisms of Proton Conductance in Polymer Electrolyte MembranesDeva RajОценок пока нет
- Wrihtg, 2000 Generation - of - Resting - Membrane - PotentialДокумент5 страницWrihtg, 2000 Generation - of - Resting - Membrane - PotentialNathalia ReyesОценок пока нет
- 1.0 The Origin of Biopotentials (New)Документ62 страницы1.0 The Origin of Biopotentials (New)Hanif HussinОценок пока нет
- Channels and PumpsДокумент10 страницChannels and Pumpsazazel666Оценок пока нет
- Production and Role of Inner Ear FluidДокумент26 страницProduction and Role of Inner Ear FluidGirish SubashОценок пока нет
- Modeling of Cesium-137 and Strontium-90 Accumulation in The Freshwater Algae CellsДокумент6 страницModeling of Cesium-137 and Strontium-90 Accumulation in The Freshwater Algae CellsfemalefaustОценок пока нет
- Membrane Potentials in Living Systems, Tools To Measure: Biological BackgroundДокумент10 страницMembrane Potentials in Living Systems, Tools To Measure: Biological BackgroundazzaassОценок пока нет
- Surgical PhsyiologyДокумент170 страницSurgical PhsyiologyTamjid Khan100% (2)
- Resting Membrane PotentialДокумент8 страницResting Membrane PotentialAhmad Atiq MalikiОценок пока нет
- A M I E: Dvanced Ethods N LectrophysiologyДокумент43 страницыA M I E: Dvanced Ethods N LectrophysiologyArtur LiberatoОценок пока нет
- Surgical Physiology for MRCS Part 3Документ170 страницSurgical Physiology for MRCS Part 3Steve FerisОценок пока нет
- Describe How An Action Potential Is Propagated Along A Nerve FibreДокумент4 страницыDescribe How An Action Potential Is Propagated Along A Nerve FibreDhruvalОценок пока нет
- RestingMembranePotential JeffLindoДокумент8 страницRestingMembranePotential JeffLindoAbraham AberaОценок пока нет
- RMP Calculation Using Nernst & Goldman-Hodgkin-Katz EquationsДокумент30 страницRMP Calculation Using Nernst & Goldman-Hodgkin-Katz EquationsMuhammad AhmedОценок пока нет
- Voltage-Gated Ion Channels Plasma Membrane Resting Potential SodiumДокумент34 страницыVoltage-Gated Ion Channels Plasma Membrane Resting Potential SodiumnvbondОценок пока нет
- The Hodgkin-Huxley ModelДокумент7 страницThe Hodgkin-Huxley ModelLike Hell I'm Telling YouОценок пока нет
- UNIT I Electro-Physiology and BiopotentiДокумент45 страницUNIT I Electro-Physiology and BiopotentiAshok KumarОценок пока нет
- Bioelectrochemistry of Biomembranes and Biomimetic MembranesОт EverandBioelectrochemistry of Biomembranes and Biomimetic MembranesОценок пока нет
- GSE CertificatesДокумент1 страницаGSE CertificatesOkan KalendarОценок пока нет
- STA002 - FAEO and RelatedДокумент6 страницSTA002 - FAEO and RelatedpierrebkkОценок пока нет
- The Effect of Different Fertilizers On Plant GrowthДокумент2 страницыThe Effect of Different Fertilizers On Plant GrowthVeerath தமிழன்0% (2)
- KENDRIYA VIDYALAYA SANGATHAN SAMPLE PAPER FOR PERIODIC TEST II EXAMДокумент4 страницыKENDRIYA VIDYALAYA SANGATHAN SAMPLE PAPER FOR PERIODIC TEST II EXAMhweta173Оценок пока нет
- TMP0025U Products Accessories GuideДокумент40 страницTMP0025U Products Accessories GuideMajdi BelguithОценок пока нет
- Ketoprofen Suppository Dosage Forms: in Vitro Release and in Vivo Absorption Studies in RabbitsДокумент6 страницKetoprofen Suppository Dosage Forms: in Vitro Release and in Vivo Absorption Studies in RabbitsTommyОценок пока нет
- Cooling Gel Safety ReportДокумент15 страницCooling Gel Safety ReportJacek Stanislawski100% (1)
- Section 5 - Concrete PavementДокумент18 страницSection 5 - Concrete PavementLipSingCheong100% (2)
- LWAASHJSPLANGULДокумент5 страницLWAASHJSPLANGULAmiy SrivastavaОценок пока нет
- TT 2023 Sem 1 Odd - Class 4e (Updated 311222)Документ1 страницаTT 2023 Sem 1 Odd - Class 4e (Updated 311222)Lim Zhe Xian (Bukitviewss)Оценок пока нет
- Anodic Dissolution of Pure Aluminum During Electrocoagulation Process - Influence of Supporting Electrolyte, Initial PH, and Current Density PDFДокумент12 страницAnodic Dissolution of Pure Aluminum During Electrocoagulation Process - Influence of Supporting Electrolyte, Initial PH, and Current Density PDFMicke Sandoval100% (1)
- FDA Approval and Regulation of Pharmaceuticals, 1983-2018: JAMA - Special CommunicationДокумент13 страницFDA Approval and Regulation of Pharmaceuticals, 1983-2018: JAMA - Special CommunicationArturo ZumaetaОценок пока нет
- Viruses & Bacteria: Biology 11Документ28 страницViruses & Bacteria: Biology 11Adnan Bhisma RizaldyОценок пока нет
- Quiz-Alcohol Ether & Phenols-Rsk - RGVДокумент6 страницQuiz-Alcohol Ether & Phenols-Rsk - RGVAtharva GanjuОценок пока нет
- Gene Sequencing Methods (Word Document)Документ14 страницGene Sequencing Methods (Word Document)pavaniОценок пока нет
- IrelДокумент29 страницIrelvarghis_k_thomasОценок пока нет
- MANUAL DE COMPRESORES BRISTOL. Refrigeración.Документ47 страницMANUAL DE COMPRESORES BRISTOL. Refrigeración.Arnulfo Rafael Álvarez Oliveros100% (1)
- Research Proposal 1 PDFДокумент5 страницResearch Proposal 1 PDFMunem BushraОценок пока нет
- QE341 Operations Manual 01 07 15 English PDFДокумент226 страницQE341 Operations Manual 01 07 15 English PDFghita60% (5)
- Data Sheet For Nutraceuticals.Документ13 страницData Sheet For Nutraceuticals.ddeeppaakОценок пока нет
- Diffuser AugmentedДокумент8 страницDiffuser Augmentedanthony100% (1)
- 23.end Sem Question Paper - BMEL-405 2016-17Документ2 страницы23.end Sem Question Paper - BMEL-405 2016-17Manish SharmaОценок пока нет
- Crystal Appearance/Characteristics Clinical SignificanceДокумент4 страницыCrystal Appearance/Characteristics Clinical SignificanceAngela LaglivaОценок пока нет
- BIO130 Sec2 - Lec1and2 - 1pptДокумент38 страницBIO130 Sec2 - Lec1and2 - 1pptlemonpartymanОценок пока нет
- Kerasiev Ceramic Membrane Techinical Brochure 2018 (0.5MB)Документ4 страницыKerasiev Ceramic Membrane Techinical Brochure 2018 (0.5MB)Suresh DОценок пока нет
- Investigating Oxygen and Carbon Dioxide Levels in Inhaled and Exhaled AirДокумент2 страницыInvestigating Oxygen and Carbon Dioxide Levels in Inhaled and Exhaled AirAdy Phanterz100% (1)
- Mass SpectrometryДокумент15 страницMass SpectrometryMeghan Norico Cristuta100% (1)
- SU14 - Agenda 16 OctДокумент11 страницSU14 - Agenda 16 OctCostas AggelidisОценок пока нет
- ASTM D7777 - Densimetro Digital PortatilДокумент7 страницASTM D7777 - Densimetro Digital PortatilAlvaro Correa100% (2)