Академический Документы
Профессиональный Документы
Культура Документы
Ventajas y Limitaciones Estructuras Proteicas Cristalinas
Загружено:
Edar PechАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Ventajas y Limitaciones Estructuras Proteicas Cristalinas
Загружено:
Edar PechАвторское право:
Доступные форматы
Pech- Santiago Edar Onam
Septiembre 2011
Antecedentes
El primer cristal de protena fue la hemoglobina en 1864 por
Hoppe-Seyler. Y fue reconocido con un descubrimiento
excepcional y valioso.
Todava se argumenta que la cristalografa es una verdadera
ciencia, cuyos productos afecta en los campos de la
biotecnologa, la biologa molecular y la medicina.
Y se resuelve a una nica conformacin, lo que lleva una
descripcin incompleta de los datos cristalogrficos y a un alto
grado de imprecisin derivada de la incapacidad para adaptarse
a esa conformacin.
Continua
La cristalizacin es un proceso en el que se realiza
un cambio de fase, pasando el sistema de un estado
de no equilibrio al estado de equilibrio.
Existen dos faces la nucleacin
y el crecimiento.
Purificacin de
la protena
Cristalizar
Difraccin
Resolucin de
Faces
Afinamiento
Modelo
Validacin y
anlisis Isomorfa
Remplazo molecular
Anmala
Patrones de
Difraccin
Mapa de densidad
Electrnica
Introduccin
La cristalografa de rayos-X, es usada comnmente
para determinar la estructura tridimensional de las
biomolculas.
Consecuentemente, todos los modelos estructurales
de protena tienen asociado con ellos un error
significativo.
Los grandes errores son a menudo un resultado de
interpretaciones diferentes de regiones con alta
movilidad o conformaciones mltiples, donde
adquieren interpretaciones no fiables.
La resolucin de la estructura es importante porque
se pueden generar errores como resultado de una
mala interpretacin de mapas de densidad
electrnica.
Continua
Alta
Media
Baja
Continua
La magnitud de la variacin observada en el mapa de
densidad electrnica, implica que muchos de los
anlisis estructurales y las comparaciones pueden ser
defectuosos.
Haciendo hincapi en el carcter dinmico de las
protenas.
Calidad de los Datos
Usualmente los cristales de protenas contienen un
montn de solvente (30-70%) y esto significa que los
cristales son susceptibles a daos por rayos-X,
aumento de desorden dentro de la red cristalina.
Asignar correctamente la simetra del grupo espacial
del cristal durante la difraccin es importante.
Continua
En general, vale la pena colectar tantos datos como
sea posible.
Una medida estadstica de la calidad de los datos es
el factor Rmerge de confiabilidad.
Modelado y afinamiento
Un modelo contiene las coordenadas atmicas, el
valor de ocupacin y factor trmico de vibracin
(factor-B).
Esta determinado por la relacin de seal/ruido
(I/sI), la integridad y la redundancia.
Continua
Propensos a contener errores experimentales por una
mala interpretacin del mapa de densidad
electrnica.
Modernos procedimientos cristalogrficos utilizan
rutinas automticas para aadir molculas de agua a
la estructura.
Continua
El refinamiento de modelos estructurales con los
datos de difraccin de rayos-x se mide por una
fiabilidad de los Factores (R-Factor).
Rfree: Juzgar el exceso de ajuste.
Rcryst: Juzgar el modelo estable.
El ajuste parece ser mejor de lo que pudiera ser
Conclusiones
La cristalografa de rayos-X es una poderosa
herramienta para comprender la funcin biolgica.
Muchas de los objetivos de las drogas son las
protenas de membrana, que pueden ser difcil de
cristalizar.
La estructura de la protena en el cristal puede tener
conformaciones muy diferentes en solucin.
Una validacin adecuada y la deposicin de la
estructura, los datos y los archivos de origen son
esenciales para su calidad del modelo estructural.
Anlisis de geometra
Plegamiento de la cadena principal
Cadena de interacciones lateral por puentes de
hidrogeno
Continua
Es importante tener en cuenta que cada modelo
estructural de protena es en hecho una familia de
estructuras.
Continua
Вам также может понравиться
- Espectrometría de masas. Interpretación de espectrosОт EverandEspectrometría de masas. Interpretación de espectrosОценок пока нет
- CriomicroscopíaДокумент7 страницCriomicroscopíaedisonpampaОценок пока нет
- Rayos X en Cristalografia 1Документ21 страницаRayos X en Cristalografia 1García Martínez VictorОценок пока нет
- 04 Documento Sol Estudio ProteinasДокумент2 страницы04 Documento Sol Estudio Proteinasalejandrosantorcaz97Оценок пока нет
- Articulo Sobre RMN Interesante para EstudiarДокумент8 страницArticulo Sobre RMN Interesante para EstudiarMiriam LópezОценок пока нет
- Todos Los Temas CTДокумент546 страницTodos Los Temas CTandreximo0% (1)
- Cristalización de ProteínasДокумент40 страницCristalización de ProteínasEdi OssmarОценок пока нет
- Guía de Trabajos Prácticos Y de Ejercicios Curso de Bioquímica para PEMQBДокумент29 страницGuía de Trabajos Prácticos Y de Ejercicios Curso de Bioquímica para PEMQBMarcelo Campos PalmaОценок пока нет
- Seminario 2Документ19 страницSeminario 2Bryan TandazoОценок пока нет
- Uso de Técnicas Cromatográficas para La Purificación de ProteínasДокумент4 страницыUso de Técnicas Cromatográficas para La Purificación de ProteínasAlexander SanchezОценок пока нет
- Electroforesis en Gel y Mapeo de La Estructura Con Enzimas de RestricciónДокумент17 страницElectroforesis en Gel y Mapeo de La Estructura Con Enzimas de RestricciónJhon Marcoss :vОценок пока нет
- PDF 20221011 192327 0000Документ31 страницаPDF 20221011 192327 0000jesuscoronadoОценок пока нет
- La Cristalografía de Rayos XДокумент3 страницыLa Cristalografía de Rayos XMaria Jose Gonzalez SarangoОценок пока нет
- Electroforesis CapilarДокумент4 страницыElectroforesis CapilargabrielОценок пока нет
- Rayos XДокумент21 страницаRayos XAntonio Zapata SolisОценок пока нет
- Polimerizacin HB Sempleando RPEДокумент66 страницPolimerizacin HB Sempleando RPECinthia Yarabeth Velázquez LópezОценок пока нет
- Obtención de Metafase en Muestras de Sangre PeriféricaДокумент8 страницObtención de Metafase en Muestras de Sangre PeriféricaMarjorie Lizeth Tineo DíazОценок пока нет
- Ensayo NanotecnologíaДокумент5 страницEnsayo NanotecnologíaNathaly Porras RodríguezОценок пока нет
- Análisis de Adn Por Medio de La Técnica de Electroforesis en Gel de AgarosaДокумент6 страницAnálisis de Adn Por Medio de La Técnica de Electroforesis en Gel de AgarosaPerdomoJorgeОценок пока нет
- CristalografiaДокумент15 страницCristalografiaMtro Ivan MartínezОценок пока нет
- Analisis de MaterialesДокумент9 страницAnalisis de Materialesdiego duranОценок пока нет
- Algunas Consideraciones Sobre El Cálculo UrinarioДокумент7 страницAlgunas Consideraciones Sobre El Cálculo UrinarioNANCY VALENCIAОценок пока нет
- Formato para Práctica 07Документ3 страницыFormato para Práctica 07AlexaArmentaОценок пока нет
- Guia Practicos Computacion Proteinas 1 y 2Документ14 страницGuia Practicos Computacion Proteinas 1 y 2E-f-f-yОценок пока нет
- ELECTROFORESISДокумент10 страницELECTROFORESISBetsabe Corpa AlegriaОценок пока нет
- Electro For Es IsДокумент16 страницElectro For Es IsLuis Alejandro Peña MozombiteОценок пока нет
- Microscopio Electronico de TransmisionДокумент5 страницMicroscopio Electronico de Transmisionnoe100% (1)
- Tecnicas de Biologia MolecularДокумент39 страницTecnicas de Biologia MolecularDaniel Alonso100% (1)
- ENSAYOДокумент3 страницыENSAYOESTHER ISABEL CEBALLOS PORTILLOОценок пока нет
- 3 Practica ElectroforesisДокумент23 страницы3 Practica ElectroforesisA.G.Оценок пока нет
- YruelaI Cap-b-Lib 2014Документ15 страницYruelaI Cap-b-Lib 2014Valeria BermudezОценок пока нет
- La ElectroforesisДокумент7 страницLa ElectroforesisvanessaОценок пока нет
- Clase 1.generalidades de La Automatización.Документ18 страницClase 1.generalidades de La Automatización.JORGEОценок пока нет
- Organización Cromosómica Mitótica - Las Reglas Generales Cumplen Con La Variabilidad Específica de La Especie - PMCДокумент21 страницаOrganización Cromosómica Mitótica - Las Reglas Generales Cumplen Con La Variabilidad Específica de La Especie - PMCLeslie OrtizОценок пока нет
- Informe 2 - Grupo 6 MEJORADOДокумент19 страницInforme 2 - Grupo 6 MEJORADOAnais Santisteban rodriguezОценок пока нет
- Cristalografía y Espectropolarimetría.Документ5 страницCristalografía y Espectropolarimetría.Karenn MarianaОценок пока нет
- HistoriaДокумент16 страницHistoriaelsaОценок пока нет
- Daño CromosomicoДокумент8 страницDaño CromosomicoJoel Eduardo Leon HernandezОценок пока нет
- Parte 2 Trabajo 4Документ8 страницParte 2 Trabajo 4NATALY NICOLE ORTIZ ZEVALLOSОценок пока нет
- 1 s2.0 S000398610700447X MainДокумент9 страниц1 s2.0 S000398610700447X MainDiego CarreonОценок пока нет
- Microscopia ElectronicaДокумент16 страницMicroscopia ElectronicaBraulio Avila SОценок пока нет
- Expo BioquimicaДокумент17 страницExpo BioquimicaLIN JAIDER ARAUJOОценок пока нет
- Material de Apoyo TP 2 - 3a Parte.-ProteínasДокумент6 страницMaterial de Apoyo TP 2 - 3a Parte.-Proteínasotavionov9Оценок пока нет
- InformeДокумент6 страницInformeRey Clinton Rosas CarbajalОценок пока нет
- Reflectancia Total AtenuadaДокумент6 страницReflectancia Total AtenuadaJulio Cesar ParedesОценок пока нет
- N°03 Informe EXTRACCIÓN Y PURIFICACIÓN DE ADN PLASMIDICOДокумент8 страницN°03 Informe EXTRACCIÓN Y PURIFICACIÓN DE ADN PLASMIDICOCarlos Daniel Quispe ChuraОценок пока нет
- Tecnica Cristalografia Rayos XДокумент5 страницTecnica Cristalografia Rayos XAriana LópezОценок пока нет
- OMICASДокумент9 страницOMICASJoseLuisHuamanОценок пока нет
- Procaina Un CristalДокумент42 страницыProcaina Un Cristalgeofarma100% (1)
- Mohammed2017 en EsДокумент8 страницMohammed2017 en Esarazeli VivОценок пока нет
- 5 ElectroforesisДокумент84 страницы5 ElectroforesisDiana RiosОценок пока нет
- Conclusiones 2Документ3 страницыConclusiones 2Fabiana CastilloОценок пока нет
- Técnicas de Difracción para El Análisis de Estructuras CristalinasДокумент3 страницыTécnicas de Difracción para El Análisis de Estructuras CristalinasMADhouse31100% (1)
- J Crad 2017 02 016 en EsДокумент5 страницJ Crad 2017 02 016 en EsAydee SichaОценок пока нет
- Tarea 3. Cienci de Los MaterialesДокумент6 страницTarea 3. Cienci de Los MaterialesMarcelo VillarrealОценок пока нет
- AnalisisxxДокумент2 страницыAnalisisxxMilade CantilloОценок пока нет
- Actividad 2 - Paola OlmosДокумент9 страницActividad 2 - Paola OlmosPaola Graciela Olmos RendónОценок пока нет
- ReplicacionДокумент35 страницReplicacionDevi Sweet100% (1)
- Reporte 7Документ6 страницReporte 7María José Rosales RealОценок пока нет
- LSP Angel VelascoДокумент42 страницыLSP Angel VelascoANGEL MANUEL VELASCO REYESОценок пока нет
- ENDOFITOSДокумент9 страницENDOFITOSEdar PechОценок пока нет
- Calendario RommiesДокумент2 страницыCalendario RommiesEdar PechОценок пока нет
- EMG 2016 CMO y JHSДокумент6 страницEMG 2016 CMO y JHSEdar PechОценок пока нет
- Practica de Campo, Montaje de La Radula-MolluscaДокумент14 страницPractica de Campo, Montaje de La Radula-MolluscaEdar PechОценок пока нет
- Fotosíntesis Cam: Flores Tamayo Eder Melchor Ortega Mayra Pech Santiago Edar OnamДокумент9 страницFotosíntesis Cam: Flores Tamayo Eder Melchor Ortega Mayra Pech Santiago Edar OnamEdar PechОценок пока нет
- Sistema Urogenital de MurciélagosДокумент8 страницSistema Urogenital de MurciélagosEdar Pech0% (3)
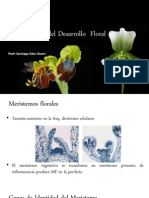
- Organización Del Desarrollo FloralДокумент7 страницOrganización Del Desarrollo FloralEdar PechОценок пока нет
- Estratificación de Ambientes Marinos y DulceacuícolasДокумент5 страницEstratificación de Ambientes Marinos y DulceacuícolasEdar PechОценок пока нет
- Biobalística y ElectroporaciónДокумент11 страницBiobalística y ElectroporaciónEdar Pech100% (1)
- Nemertinos y GnatostomúlidosДокумент24 страницыNemertinos y GnatostomúlidosEdar PechОценок пока нет
- Sistema ComplementoДокумент13 страницSistema ComplementoEdar PechОценок пока нет
- EMCVДокумент36 страницEMCVEdgar RegaladoОценок пока нет
- 2do Examen de HistologíaДокумент5 страниц2do Examen de HistologíaLuis Emiliano MorenoОценок пока нет
- Microanalisis de EvidenciasДокумент8 страницMicroanalisis de EvidenciasyanelisОценок пока нет
- Diagnostico Fitopatologico de Enfermedades Del Cultivo de La Vid en La Provincia Aviles de TarijaДокумент31 страницаDiagnostico Fitopatologico de Enfermedades Del Cultivo de La Vid en La Provincia Aviles de TarijaVictor Enrique Zenteno LopezОценок пока нет
- Banco de Actividades Biologia Grado DecimoДокумент2 страницыBanco de Actividades Biologia Grado DecimoNatalia Camacho GomezОценок пока нет
- Genoma y Epigenetica (Volumen 3)Документ175 страницGenoma y Epigenetica (Volumen 3)Alex VasquezОценок пока нет
- Proteinas de La LecheДокумент5 страницProteinas de La LecheMajo ArguelloОценок пока нет
- Capacidad de CargaДокумент5 страницCapacidad de CargalucasОценок пока нет
- El Método CientíficoДокумент8 страницEl Método CientíficoHector Raul Arias ForeroОценок пока нет
- Notebook Biology1Документ163 страницыNotebook Biology1Karen Tatiana Hernandez GonzalezОценок пока нет
- Estructura de La Bacteria y Sus FuncionesДокумент2 страницыEstructura de La Bacteria y Sus FuncionesIsaacMendezMéndez100% (1)
- Schistosomiasis (7) - PRSTДокумент2 страницыSchistosomiasis (7) - PRSTYuliett ZabalaОценок пока нет
- Vargas, A - Glosario de Cladística PDFДокумент27 страницVargas, A - Glosario de Cladística PDFJavier MartínОценок пока нет
- PEROXISOMASДокумент15 страницPEROXISOMASEstefani KarenОценок пока нет
- Español Klinefelter Syndrome in Clinical Practice - En.esДокумент13 страницEspañol Klinefelter Syndrome in Clinical Practice - En.esAdry de la MercedОценок пока нет
- PracticaДокумент13 страницPracticaMichel ÑañaqueОценок пока нет
- Control Salud 0 6a 2018 PreliminarДокумент174 страницыControl Salud 0 6a 2018 Preliminarelena lombardoОценок пока нет
- Historia Del Coeficiente de CorrelacionДокумент3 страницыHistoria Del Coeficiente de CorrelacionFer GonzalesОценок пока нет
- Actividad FilogeniaДокумент6 страницActividad FilogeniaMonica Santos AbarcaОценок пока нет
- Fotofosforilación AcíclicaДокумент2 страницыFotofosforilación AcíclicaJose LunaОценок пока нет
- El Mundo Vegetal para Pequenos BotanicosДокумент16 страницEl Mundo Vegetal para Pequenos BotanicosNeshoneliasОценок пока нет
- Exposición GatosДокумент15 страницExposición GatospaulibranОценок пока нет
- Sistema Digestivo DIPTICOДокумент3 страницыSistema Digestivo DIPTICOYenny Salazar RojasОценок пока нет
- Josefina Fernandez - Los Cuerpos Del Feminismo 0Документ17 страницJosefina Fernandez - Los Cuerpos Del Feminismo 0chongobingoОценок пока нет
- GlucolisisДокумент5 страницGlucolisisCintya Mabel Pinaya CruzОценок пока нет
- Célula Displásica y NeoplásicaДокумент10 страницCélula Displásica y NeoplásicaBrenon Alvarez RodríguezОценок пока нет
- Wuolah-Free-Test Bloque I Biotecnología Microbiana ImprimirДокумент6 страницWuolah-Free-Test Bloque I Biotecnología Microbiana ImprimirPablo Castellanos ArtigaОценок пока нет
- Cuestionario de Parasitología Oficial.Документ9 страницCuestionario de Parasitología Oficial.Damian Correa MenendezОценок пока нет
- Apertura de BultosДокумент8 страницApertura de BultosAldOo Mapz0% (1)
- La Transcripción y TraducciónДокумент8 страницLa Transcripción y TraducciónNahuel La ValleОценок пока нет
- Actividad Tres Estudio de CasosДокумент4 страницыActividad Tres Estudio de CasosDanna Julieth VELASQUEZ BAQUEROОценок пока нет