Академический Документы
Профессиональный Документы
Культура Документы
La Tabla Peric3b3dica y Propiedades Quimicas
Загружено:
Marco A. Lara CarocaАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
La Tabla Peric3b3dica y Propiedades Quimicas
Загружено:
Marco A. Lara CarocaАвторское право:
Доступные форматы
LA TABLA PERIDICA Y
PROPIEDADES QUIMICAS.
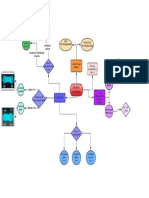
HISTORIA DE LA TABLA PERIDODICA
OCTAVAS
TRIADAS
MENDELEIEV
T.P.A.
CLASIFICACIN 63 ELEMENTOS
HENRY MOSELEY
FILOSOFO - INGLES
ORGANIZA
NEWLANDS
ORDENA
DOBEREINER
NUEVA PROPUSO
ELEMENTOS
PROPIEDADES
DEMUESTRA
ORGANIZ
ELEMENTOS QUMICOS
PROPIEDADES
MASAS ATOMICAS
RELACIN
OBSERVO
GRUPOS
PRIMERO OCTAVO
OBSERVO
7
MASAS ATOMICAS
ORDEN CRECIENTE
ACUERDO ORDEN CRECIENTE
MASAS AT
AGRUPO
PERIODO
HORIZONTAL
GRUPOS VERTICAL
PRESENTAN
PROPIEDADES QUIMICAS
PARECIDAS
DEPENDE
N ATOMICOS
PROPUSO
ORDENARLOS
CONOCER
LEY PERIODICA
Z
TABLA PERIODICA ACTUAL
Los qumicos siempre han sentido la
necesidad de clasificar los elementos
para facilitar su estudio y el de los
compuestos.
Se intentaron varias clasificaciones, casi
todas con defectos.
En 1914 HENRY MOSELEY propone una
clasificacin sin los defectos de las
anteriores.
Plante la siguiente Ley Peridica: Las
propiedades fsicas y qumicas de los elementos son
funcin peridica de la configuracin electrnica y
varan con el incremento de los nmeros
atmicos.
Para poner de manifiesto la reaparicin de las
propiedades se acostumbra a colocar a los
elementos en la disposicin llamada TABLA O
SISTEMA PERIDICO.
El SISTEMA PERIDICO est representado de la
siguiente forma:
1. GRUPOS O FAMILIAS: ordenaciones verticales de
elementos.
a) Grupos Principales:1-2-13-14-15-16-17-18.
b) Grupos Secundarios:3-4-5-6-7-8-9-10-11-12-13.
Los Grupos en la Tabla Peridica
Los grupos con mayor nmero de elementos (1,
2, 13, 14, 15, 16, 17 y 18), se conocen como
grupos principales,
IA
Grupos
IIA IIIA IVA VA VIA VIIA
VIIIA
IIIB IVB VB VIB VIIB VIIIB VIIIB VIIIB IB IIB
ubican su ultimo electrn en el ultimo nivel
(orbital s u orbital p).
s
p
s
GRUPOS
Grupo Representativo A
IA ns
1
ALCALINOS E
IIA ns
2
ALCALINOS TERREOS E
IIIA ns
2
np
1
BOROIDES E
IVA ns
2
np
2
CARBONOIDES E
VA ns
2
np
3
NITROGENOIDES E
VIA ns
2
np
4
CALCOGENOS Anfigenos
E
VIIA ns
2
np
5
HALOGENOS E
VIIIA ns
2
np
6
GASES NOBLES E
Grupo de Transicin B
IIIB (n-1)d
1
ns
2
Fam . Scanio
IVB
(n-1)d
2
ns
2
Fam. Titanio
VB (n-1)d
3
ns
2
Fam. Vanadio
VIB (n-1)d
4
ns
2
Fam. Cromo
VIIB (n-1)d
5
ns
2
Fam. Manganeso
VIIIB (n-1)d
6
ns
2
Fam. del Hierro
VIIIB (n-1)d
7
ns
2
Fam. del Cobalto
VIIIB (n-1)d
8
ns
2
Fam. del Niquel
IB (n-1)d
10
ns
1
Fam. del cobre
IIB (n-1)d
10
ns
2
Fam. del Zinc
Anlisis de la Tabla Peridica Actual
Los grupos constan de 18 columnas verticales. Se nombran desde
la izquierda a la derecha por nmeros romanos y una letra A o B.
Tambin se designan con los nmeros del 1 al 18.
G
R
U
P
O
S
IA VIIIA
PERIODOS
1
7
Periodos: Consta de 7 filas horizontales. Se numeran de arriba hacia abajo.
PERIODOS
Son siete filas horizontales sealadas con
nmeros arbigos ( 1; 2; 3, 4 ; 5; 6; 7) . Los
tres primeros son peridos cortos y los
siguientes son largos.
Los Grupos en la Tabla Peridica
Los elementos de la primera fila de elementos de
transicin interna se denominan lantnidos .
Los de la segunda fila son actnidos.
IA
IIA IIIA IVA VA VIA VIIA
VIIIA
IIIB IVB VB VIB VIIB VIIIB VIIIB VIIIB IB IIB
actnidos
lantnidos
Capas de Valencia
En las interacciones entre los distintos tomos
slo intervienen los electrones situados en la
capa ms externa.
Los denominados electrones
de valencia situados en la
llamada capa de valencia, ya
que al ser los electrones que
se encuentran ms lejanos
del ncleo y ms apantallados
por los restantes electrones,
son los que estn retenidos
ms dbilmente y los que con
ms facilidad se pierden.
Todos los tomos tienden a tener en su capa de
valencia nicamente ocho electrones. As que el
nmero real de electrones de su capa de
valencia influir tambin en sus propiedades.
El orden de los elementos en la tabla peridica, y la
forma de sta, con periodos de distintos tamaos, se
debe a su configuracin electrnica
Una configuracin especialmente estable es aquella en la
que el elemento tiene en su ltima capa, la capa de
valencia, 8 electrones, 2 en el orbital s y seis en los
orbitales p, de forma que los orbitales s y p estn
completos.
En un grupo, los elementos tienen la misma configuracin
electrnica en su capa de valencia.
As, conocida la configuracin electrnica de un
elemento sabemos su situacin en la tabla y, a la inversa,
conociendo su situacin en la tabla sabemos su
configuracin electrnica.
Acomodo de orbitales en la Tabla Peridica
Los primeros dos grupos estn completando orbitales s, el
correspondiente a la capa que indica el periodo.
As, el rubidio, en el quinto periodo, tendr es su capa de
valencia la configuracin 5s
1
, mientras que el bario, en el
periodo sexto, tendr la configuracin 6s
2
.
Acomodo de orbitales en la Tabla Peridica
IIA
1
2
3
4
5
6
7
s
IA
A
l
c
a
l
i
n
o
s
A
l
c
a
l
i
n
o
t
r
r
e
o
s
Los grupos 3 a 12 completan los orbitales d de la capa
anterior a la capa de valencia, de forma que hierro y
cobalto, en el periodo cuarto, tendrn las configuraciones
3d
6
4s
2
y 3d
7
4s
2
, en la que la capa de valencia no se
modifica pero s la capa anterior.
Acomodo de orbitales en la Tabla Peridica
d
IIIB IVB VB VIB VIIB VIIIB IB IIB
Elementos de transicin
4
5
7
6
Los Grupos en la Tabla Peridica
Los grupos del 3 al 12 (identificados con letra B),
estn formados por los llamados elementos de
transicin
IA
IIA IIIA IVA VA VIA VIIA
VIIIA
IIIB IVB VB VIB VIIB VIIIB VIIIB VIIIB IB IIB
Estos grupos (B),
contienen los
elementos que al
desarrollar su
configuracin
electrnica ubican su
ultimo electrn en un
nivel que no es el
ultimo.
Son elementos de transicin externa si ubican
su ultimo electrn en el penltimo nivel (orbital
d). Son elementos de transicin interna los
que ubican el ultimo electrn en el
antepenltimo nivel (orbital f).
d
f
Acomodo de orbitales en la Tabla Peridica
Finalmente, en los elementos de transicin
interna, los elementos completan los orbitales f
de su antepenltima capa.
f
6
7
IIA
1
2
3
4
5
6
7
6
7
s
d
p
f
IA
IIIB IVB VB VIB VIIB VIIIB IB IIB
Elementos de transicin
A
l
c
a
l
i
n
o
s
A
l
c
a
l
i
n
o
t
r
r
e
o
s
T
r
r
e
o
s
IIIA
C
a
r
b
o
n
o
i
d
e
o
s
IVA
N
i
t
r
o
g
e
n
o
i
d
e
o
s
VA
A
n
f
i
g
e
n
o
s
VIA
H
a
l
o
g
e
n
o
s
VIIA
G
a
s
e
s
n
o
b
l
e
s
VIIIA
Tierras raras
Tabla Peridica por Bloques de Orbitales
Acomodo de orbitales en la Tabla Peridica
Ejercicio...
De acuerdo a los criterios entregados
anteriormente, clasifique los siguientes elementos:
Cl, Cu, Sc, Ar, Zn, He, Po.
La configuracin electrnica segn su distribucin
electrnica (D.E) empleando la T.P
Para determinar la celda de cada elemento, en la cual se asigna su
smbolo, hay que definir la columna (vertical) y la fila (horizontal),
conocidas como Grupo y Periodo, basados en su distribucin
electrnica (DE)
Celda
La columna (grupo)est dada
por
la terminacin de la DE
La fila (perodo),est dada por el
mximo coeficiente del subnivel s
Como las columnas estn dadas por la terminacin de la DE, en la tabla
peridica actual existen cuatro zonas:
Zona s con dos columnas: s
1
y s
2
Zona p con seis columnas: desde p
1
hasta p
6
Zona d con diez columnas: desde d
1
hasta d
10
Zona f con catorce columnas: desde f
1
hasta f
14
Fila (Periodo): Es el nivel mas alto en el que termina la DE y esta
determinado por el subnivel s (el nmero mas alto que acompaa a s)
Columna (Grupo), si la DE termina en:
s se encuentra en la zona s, grupo A, columna I o II, depende de los
electrones
que estn en el subnivel. (en s solo puede haber 1 o 2).
p se encuentra en la zona p, grupo A, columna desde III a VIII (6
columnas), ste
nmero resulta de sumar los electrones del subnivel s y p del mismo
nivel.
d se encuentra en la zona d, grupo B, columna desde III a II (10
columnas), se relacionan de acuerdo a los electrones presentes en este
subnivel.
d
1
d
3
d
2
d
4
d
6
d
5
d
10
d
9
d
7
d
8
I II III IV V VI VII VIII VIII VIII
p, est en la zona p, grupo A, la columna ser la suma de los
electrones presentes en s y p del mismo nivel.
1s
2
2s
2
2p
6
3s
2
3p
6
Grupo VIII A
Periodo
3
s, est en la zona s grupo A la columna depende de los
electrones que estn en el subnivel y como el subnivel s solo
puede alojar 1 o 2 electrones (e-) estar en la columna I o II.
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
Periodo
4
Grupo II
A
Si termina en:
d, est en la zona d, grupo B, la columna depende de los
electrones que estn presentes en el subnivel, (orbital), si es 1e- (d
1
), est en la columna III y as sucesivamente como se indico en
diapositiva anterior.
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
5
Periodo
4
Grupo VII
B
d
1
d
3
d
2
d
4
d
6
d
5
d
10
d
9
d
7
d
8
I II III IV V VI VII VIII VIII VIII
es el actinio (Ac)
Fila o
perodo
s
1
s
2
Zona
s
Zona
p
p
1
p
3
p
2
p
4
p
6
p
5
Zona
d
z
o
n
a
f
21 22 23 24 25 26 27 28 29 30
39 40 41 42 43 44 45 46 47 48
71 72 73 74 75 76 77 78 79 80
103 104 105 106 107 108 109 110 111 112
89 90 91 92 93 94 95 96 97 98 99 100 101 102
2
1
4
3
6
5
7
6
7
57 58 59 60 61 62 63 64 65 66 67 68 69 70 Lantnidos
Actnidos
Tierras
raras
f
1
f
14
f
7
f
2
f
3
f
4
f
5
f
6
f
8
f
13
f
12
f
9
f
10
f
11
d
1
d
3
d
2
d
4
d
6
d
5
d
10
d
9
d
7
d
8
3
11
19
37
55
87
9
17
35
53
85
4
12
20
38
56
88
10
18
36
54
86
8
16
34
52
84
7
15
33
51
83
6
14
32
50
82
5
13
31
49
81
1 2
Porque el elemento Z = 57
Los tipgrafos no saben qumica o no saben contar, al recortar la Zona f:
algunos cortan del 58 al 71 y del 90 al 103,
Observe que tipo de error posee su tabla peridica
otros cortan del 57 al 71 y del 89 al 103
es el lantano (La)
Porque el elemento Z = 89
Uno de los pocos
textos que tiene
bien el corte de
la zona f es el la
American
Chemical
Society:
Qumica un
Proyecto de la
ACS. Editorial
REVERT. Espaa
2005
Fila o
perodo
s
1
s
2
Zona
s
Zona
p
p
1
p
3
p
2
p
4
p
6
p
5
Zona
d
d
1
d
3
d
2
d
4
d
6
d
5
d
10
d
9
d
7
d
8
z
o
n
a
f
2
1
4
3
6
5
7
grupos I II III IV V VI VII VIII
H
He
H
He
3
11
19
37
55
87
9
17
35
53
85
Ne
Ar
Kr
Xe
Rn
Li
Na
K
Rb
Cs
Fr
Be
Mg
Ca
Sr
Ba
Ra
4
12
20
38
56
88
2
10
18
36
54
86
B
A
Ga
In
T
F
C
Br
I
At
8
16
34
52
84
O
S
Se
Te
Po
7
15
33
51
83
N
P
As
Sb
Bi
6
14
32
50
82
C
Si
Ge
Sn
Pb
5
13
31
49
81
21 22 23 24 25 26 27 28 29 30
39 40 41 42 43 44 45 46 47 48
71 72 73 74 75 76 77 78 79 80
103 104 105 106 107 108 109 110 111 112
Gases nobles
halgenos
Alcalino trreos
alcalinos
1 2
1
notas
s y p Los elementos de las zonas forman los grupos A de la tabla peridica y son ocho, se conocen como
El helio (He), Z=2 exige estar a la derecha del perodo 1
El hidrgeno (H), Z=1 puede estar a la izquierda del helio o a la izquierda del perodo 1
(como volando)
H
1
elementos representativos, el nmero del grupo coincide con el nmero de electrones de valencia
Los elementos de la zona d se llaman
elementos de transicin y forman los
subgrupos
Se llaman de transicin porque algunos de ellos
auto modifican su DE haciendo una transicin de
uno o dos electrones desde el ltimo subnivel s
hasta el ltimo subnivel d, generando una DE
excitada.
d
1
d
3
d
2
d
4
d
6
d
5
d
10
d
9
d
7
d
8
21 22 23 24 25 26 27 28 29 30
39 40 41 42 43 44 45 46 47 48
71 72 73 74 75 76 77 78 79 80
103 104 105 106 107 108 109 110 111 112
Fila o
perodo
4
6
5
7
Z D.E. normal D.E. excitada Fila
# de e
-
transferidos.
24 Cr 1s . . .4s
2
/ 3d
4
1s . . .4s
1
/ 3d
5
4 1
29 Cu 1s . . .4s
2
/ 3d
9
1s . . .4s
1
/ 3d
10
4 1
41 Nb 1s . . .5s
2
/ 4d
3
1s . . .5s
1
/ 4d
4
5 1
42 Mo 1s . . .5s
2
/ 4d
4
1s . . .5s
1
/ 4d
5
5 1
43 Tc 1s . . .5s
2
/ 4d
5
1s . . .5s
1
/ 4d
6
5 1
44 Ru 1s . . .5s
2
/ 4d
6
1s . . .5s
1
/ 4d
7
5 1
45 Rh 1s . . .5s
2
/ 4d
7
1s . . .5s
1
/ 4d
8
5 1
46 Pd 1s . . .5s
2
/ 4d
8
1s . . .5s
0
/ 4d
10
5 2
47 Ag 1s . . .5s
2
/ 4d
9
1s . . .5s
1
/ 4d
10
5 1
77 Ir 1s . . .6s
2
/ 4f
14
5d
7
1s . . .6s
0
/ 4f
14
5d
9
6 2
78 Pt 1s . . .6s
2
/ 4f
14
5d
8
1s . . .6s
1
/ 4f
14
5d
9
6 1
79 Au 1s . . .6s
2
/ 4f
14
5d
9
1s . . .6s
1
/ 4f
14
5d
10
6 1
Estos son los
elementos
que presentan
modificacin
de la DE
Clasificacin peridica de los
elementos
1.Elementos representativos: Se distribuyen a
lo largo de casi todos los grupos. Se
excluyen los elementos del grupo 3 al
12 y el grupo 18.Tienen todos sus
niveles completos a excepcin del
ltimo.La configuracin electrnica
ms externa comprende aquellas que
van desde:
ns
1
hasta ns
2
np
5
2.Elementos de transicin: Son los
correspondientes a los grupos 3 al 12 y se
caracterizan por presentar el penltimo
subnivel d y /o el ltimo niveles incompleto. La
configuracin electrnica externa de estos
elementos, en general se puede representar
como:
(n-1)d
1-----9
ns
2
3. Elementos de transicin interna: Tienen un
subnivel incompleto, el f. Estos elementos
corresponden a los perodos 6 y 7y no se
clasifican en grupos.
4.Elementos Inertes o gases nobles: Se ubican en el
grupo 18 y se caracteriza por tener todos sus niveles
energticos completos. Su configuracin externa se
representa por ns
2
np
6
a excepcin del He que
tiene una configuracin del tipo 1s
2
.
Otra clasificacin: metales, no metales y
metaloides.
Metales Metaloides No metales
Buenos
conductores del
calor y la
electricidad
Conducen la
electricidad en
ciertas condiciones
Malos conductores
del calor y la
electricidad
Son maleables y
dctiles
La mayora no son
maleables ni
dctiles
No son maleables
ni dctiles
Sus puntos de
fusin y ebullicin
son altos
Sus puntos de
fusin y ebullicin
son medios
Sus puntos de
fusin y ebullicin
son bajos
Al reaccionar cede
sus electrones
Al reaccionar se
puede comportar
como metal o como
no metal
Al reaccionar
comparte o acepta
electrones
RADIO ATOMICO
ENERGIA DE IONIZACION
ELECTRONEGATIVIDAD
CARCTER METALICO
Variacin en la Tabla Peridica
Es la mitad de la distancia entre los centros de dos tomos vecinos
o es la distancia promedio entre el ltimo electrn del nivel ms
externo y el ncleo.
LOS RADIOS ATOMICOS AUMENTAN EN TERMINOS
GENERALES HACIA ABAJO EN UN GRUPO Y
DISMINUYEN A LO LARGO DE UN PERIODO
Radio Atmico en la Tabla Peridica
El radio atmico, es decir, el tamao exacto de
un tomo, es muy difcil de determinar, ya que
depende del estado de agregacin del elemento
y de la especie qumica que forma.
El radio atmico depender de la distancia al
ncleo de los electrones de la capa de valencia
IIA
1
2
3
4
5
6
7
6
7
IA
IIIB IVB VB VIB VIIB VIIIB IB IIB
Elementos de transicin
A
l
c
a
l
i
n
o
s
A
l
c
a
l
i
n
o
t
r
r
e
o
s
T
r
r
e
o
s
IIIA
C
a
r
b
o
n
o
i
d
e
o
s
IVA
N
i
t
r
o
g
e
n
o
i
d
e
o
s
VA
A
n
f
i
g
e
n
o
s
VIA
H
a
l
o
g
e
n
o
s
VIIA
G
a
s
e
s
n
o
b
l
e
s
VIIIA
Tierras raras
Radio Atmico
A
u
m
e
n
t
a
Radio atmico: Distancia promedio que existe entre el
ncleo de un tomo y la capa electrnica ms externa.
Grupo VII-A radio atmico ()
9
F
17
Cl
35
Br
53
I
0.72
0.99
1.14
1.33
Angstrom (): Unidad de medida de longitud siendo equivalente a 1 x 10
-10 m,
no se
utiliza en el Sistema Internacional de Unidades ( SI).
Perodo 2 /
Elemento
3
Li
4
Be
5
B
6
C
7
N
8
O
9
F
10
Ne
radio atmico () 1.34 0.90 0.82 0.77 0.75 0.73 0.72 1.31
Potencial o energa de
ionizacin (PI)
Es la cantidad de energa mnima
necesaria para sacar al electrn ms
externo de un tomo neutro en su estado
fundamental. Es decir, el tomo se
convierte en un in positivo (catin).
M + E M
+
+ e- M =
metal
Se define como la energa que se requiere para sacar al
electrn ms externo de un tomo neutro.
La energa de ionizacin de un tomo mide que tan
fuerte este retiene a sus electrones
La energa de ionizacin es la energa mnima requerida
para quitar un electrn de un tomo aislado gaseoso en
su estado basal
Ojo esto no se refiere a la energa requerida para quitar
un electrn de las capas internas, acurdate que esos
estn mas agarrados al tomo, porque estn ms cerca y
porque les toca ms carga del ncleo.
Aqu nos referimos al estado basal del tomo completo,
entonces el electrn que saldr ser el que tiene menos
energa es decir el ms lejano al ncleo.
Para quitar los electrones restantes se requiere cada
vez ms energa (es decir la energa de ionizacin es
mayor para cada electrn subsiguiente)
Variacin en la TP
En un periodo, el PI aumenta de izquierda
a derecha.
En un grupo, el PI aumenta de abajo
hacia arriba.
A
u
m
e
n
t
a
Potencial de Ionizacin
Energa de ionizacion: Energa mnima necesaria
para separar el electrn menos fuertemente atrado por un tomo
aislado con la formacin correspondiente de un in (catin)
monopositivo, tambin aislado.
Se expresa en kcal / mol, kJ. Mol
-1
o en eV. mol
-1
Grupo I-A energa de ionizacin (kcal / mol)
3
Li
11
Na
19
K
37
Rb
55
Cs
124
119
100
96
90
Perodo 2 /
Elemento
3
Li
4
Be
5
B
6
C
7
N
8
O
9
F
10
Ne
energa de
ionizacin
(kcal / mol)
124 215 191 260 336 314 402 497
Afinidad electrnica o
electroafinidad (AE):
Es la energa liberada cuando un tomo en
estado neutro gana un electrn, para
convertirse en un in negativo (anin).
X + e- X
-
X = no metal
Variacin en la TP
En un periodo, la AE aumenta de
izquierda a derecha al aumentar el Z.
En un grupo, la AE disminuye de arriba
hacia abajo al aumentar el Z.
D
i
s
m
i
n
u
y
e
Electroafinidad: Cantidad de energa liberada cuando un
tomo gana un electrn .
Grupo VII-A electroafinidad (eV)
9
F
17
Cl
35
Br
53
I
3.6
3.75
3.53
3.2
Electrn - volt : La energa en los procesos elementales se mide en electrn-volt.
Un electrn - volt (eV) es la energa de un electrn acelerado a travs de una
diferencia de potencial de un volt .
Perodo 2 / Elemento O / O
- 2
F / F
- 1
electroafinidad
(kJ / mol)
- 15 919.0 8 685.0
IIA
1
2
3
4
5
6
7
6
7
IA
IIIB IVB VB VIB VIIB VIIIB IB IIB
Elementos de transicin
A
l
c
a
l
i
n
o
s
A
l
c
a
l
i
n
o
t
r
r
e
o
s
T
r
r
e
o
s
IIIA
C
a
r
b
o
n
o
i
d
e
o
s
IVA
N
i
t
r
o
g
e
n
o
i
d
e
o
s
VA
A
n
f
i
g
e
n
o
s
VIA
H
a
l
o
g
e
n
o
s
VIIA
G
a
s
e
s
n
o
b
l
e
s
VIIIA
Tierras raras
La Afinidad Electrnica
Aumenta
D
i
s
m
i
n
u
y
e
Afinidad Electrnica en la Tabla Peridica
La afinidad electrnica se define como la energa
que liberar un tomo (elemento no metal), en
estado gaseoso, cuando captura un electrn y se
convierte en un in negativo o anin.
Como el potencial de ionizacin, la afinidad
electrnica depender de la atraccin del ncleo
por el electrn que debe capturar, de la repulsin
de los electrones existentes y del acercamiento
o alejamiento a completar la capa de valencia
con ocho electrones.
Mientras que el potencial de ionizacin se puede
medir directamente y con relativa facilidad, la
medicin de la afinidad electrnica es
complicada y slo en muy pocos casos puede
realizarse de forma directa y los datos que se
tienen no son fiables.
Electronegatividad (EN):
Es la capacidad que tiene
un tomo para ganar
electrones de otro tomo.
Los tomos que poseen
altos valores de EI y AE
sern altamente
electronegativos y
viceversa.
Linus Pauling determin
escalas de EN que varan
del 0,7 al 4,0.
Para los gases nobles la EN
es 0 por ser estables.
Variacin en la TP
En un periodo aumenta hacia la
derecha.
En un grupo aumenta hacia arriba.
Aumenta
A
u
m
e
n
t
a
Electronegatividad: Poder de atraccin que ejerce
una especie sobre el par de electrones compartidos.
Grupo
VII-A
electronegatividad (Escala de Pauling)
9
F
17
Cl
35
Br
53
I
4
3
2.8
2.5
Perodo 2 /
Elemento
3
Li
4
Be
5
B
6
C
7
N
8
O
9
F
electronegativid
ad
(Escala de
Pauling)
1.0 1.5 2.0 2.5 3.0
3.5 4.0
VARIACIN DE LAS PROPIEDADES PERIDICAS EN EL
SISTEMA PERIDICO
Propiedades
peridicas
Variacin en un
Grupo
Variacin en un
perodo
Radio atmico
Carcter metlico
Energa de
ionizacin
Electroafinidad
Electronegatividad
Aumenta
Aumenta
Disminuye
Disminuye
Disminuye
Disminuye
Disminuye
Aumenta
Aumenta
Aumenta
Вам также может понравиться
- Indice de RefraccionДокумент6 страницIndice de Refracciongiovana.Оценок пока нет
- Curso Perforacion Tronadura Labores Mineras Subterraneas PDFДокумент66 страницCurso Perforacion Tronadura Labores Mineras Subterraneas PDFFabian Andres CelyОценок пока нет
- Family Monthly Budget Planner1Документ1 страницаFamily Monthly Budget Planner1Marco A. Lara CarocaОценок пока нет
- El Futuro Gramática InglesДокумент4 страницыEl Futuro Gramática InglesMarco A. Lara CarocaОценок пока нет
- Creando Un CorreoДокумент3 страницыCreando Un CorreoMarco A. Lara CarocaОценок пока нет
- Comunicación DialogicaДокумент2 страницыComunicación DialogicaMarco A. Lara CarocaОценок пока нет
- Arnold SommerfeldДокумент2 страницыArnold SommerfeldNor rodОценок пока нет
- Informe (Lab 10) Espectroscopía ÓpticaДокумент8 страницInforme (Lab 10) Espectroscopía ÓpticaAndres Fernando Silvestre SuarezОценок пока нет
- OrbitalesДокумент13 страницOrbitalesBárbara LettoОценок пока нет
- Laser Tema 4Документ72 страницыLaser Tema 4Edgar AponteОценок пока нет
- Práctica 1 EspectroДокумент18 страницPráctica 1 EspectroLaLo MaldonadoОценок пока нет
- Enlaces QuimicosДокумент76 страницEnlaces QuimicosGrc MrthОценок пока нет
- Actividad A5. Mapa Conceptual Sobre Momentos DipolaresДокумент1 страницаActividad A5. Mapa Conceptual Sobre Momentos DipolaresNAHOMY GARDEAОценок пока нет
- SERIE 2 Aula VirtualДокумент13 страницSERIE 2 Aula VirtualGiuliana PerezОценок пока нет
- Teorias, Modelos Atomicos y Cálculo de SubparДокумент3 страницыTeorias, Modelos Atomicos y Cálculo de SubparAngie CarolinaОценок пока нет
- Etiquetado Odf 1Документ96 страницEtiquetado Odf 1DianaОценок пока нет
- T3-Propiedades Tabla PeriodicaДокумент9 страницT3-Propiedades Tabla PeriodicaManuel SilveraОценок пока нет
- Optica I.Документ2 страницыOptica I.cfisicasterОценок пока нет
- Ejercicios Del Capítulo 11Документ2 страницыEjercicios Del Capítulo 11AdrianaОценок пока нет
- RefraccionДокумент5 страницRefraccionMisael HernandezОценок пока нет
- Introduccion Al Electron y Sus InterДокумент50 страницIntroduccion Al Electron y Sus InterNora Colegz LezzyОценок пока нет
- Espectroscopia de Absorción AtómicaДокумент7 страницEspectroscopia de Absorción AtómicaRuberney CarrilloОценок пока нет
- Formacion Imagenes Espejos PDFДокумент7 страницFormacion Imagenes Espejos PDFNICOLAS PAIPILLA SALAMANCAОценок пока нет
- Modelos Atómicos EspДокумент2 страницыModelos Atómicos Espmartasantosegea2Оценок пока нет
- Que Es Un Atomo y Su ClasificaciónДокумент4 страницыQue Es Un Atomo y Su ClasificaciónAlejandra VargasОценок пока нет
- Informe de Organica 2Документ23 страницыInforme de Organica 2Joel Quisuruco CasasОценок пока нет
- Antecedentes Tabla PeríodicaДокумент2 страницыAntecedentes Tabla PeríodicaKEYLI YERENОценок пока нет
- Espectrofotometría Ultravioleta VisibleДокумент12 страницEspectrofotometría Ultravioleta VisibleMaría Del A. VargasОценок пока нет
- Taller Quimica 2 PDFДокумент4 страницыTaller Quimica 2 PDFRonaldo P BacaОценок пока нет
- QUÍMICA - MODELOS ATÓMICOS - : Cad Logr Comie Co L Decisió D IntentarlДокумент3 страницыQUÍMICA - MODELOS ATÓMICOS - : Cad Logr Comie Co L Decisió D IntentarlLa Kpoper ShippeadoraОценок пока нет
- Guia de Actividades y Rúbrica de Evaluación - Unidad 2 - Tarea 3 - Enlace Químico y Estructura MolecularДокумент14 страницGuia de Actividades y Rúbrica de Evaluación - Unidad 2 - Tarea 3 - Enlace Químico y Estructura MolecularJavier LosadaОценок пока нет
- Configuracion Electronica GraficaДокумент13 страницConfiguracion Electronica GraficaMarbel HdezОценок пока нет
- Historia Del MicroscópioДокумент4 страницыHistoria Del MicroscópioGiovaniOlveraОценок пока нет
- Historia Del MicroscopioДокумент5 страницHistoria Del MicroscopioOmarys AvilaОценок пока нет