Академический Документы
Профессиональный Документы
Культура Документы
Tabla Periodica
Загружено:
pepe espinosa0%(2)0% нашли этот документ полезным (2 голоса)
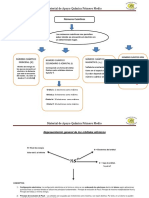
2K просмотров16 страницLa tabla periódica organiza los elementos químicos en función de sus números atómicos y propiedades periódicas. Surge de la necesidad de sistematizar la información sobre las propiedades físicas y químicas de los elementos. Científicos como Döbereiner, Newlands y Mendeleiev contribuyeron al desarrollo de la tabla periódica al reconocer patrones periódicos entre los elementos. La versión moderna de la tabla periódica está organizada en 7 períodos y 18 grupos.
Исходное описание:
quimica
Авторское право
© Attribution Non-Commercial (BY-NC)
Доступные форматы
PPT, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документLa tabla periódica organiza los elementos químicos en función de sus números atómicos y propiedades periódicas. Surge de la necesidad de sistematizar la información sobre las propiedades físicas y químicas de los elementos. Científicos como Döbereiner, Newlands y Mendeleiev contribuyeron al desarrollo de la tabla periódica al reconocer patrones periódicos entre los elementos. La versión moderna de la tabla periódica está organizada en 7 períodos y 18 grupos.
Авторское право:
Attribution Non-Commercial (BY-NC)
Доступные форматы
Скачайте в формате PPT, PDF, TXT или читайте онлайн в Scribd
0%(2)0% нашли этот документ полезным (2 голоса)
2K просмотров16 страницTabla Periodica
Загружено:
pepe espinosaLa tabla periódica organiza los elementos químicos en función de sus números atómicos y propiedades periódicas. Surge de la necesidad de sistematizar la información sobre las propiedades físicas y químicas de los elementos. Científicos como Döbereiner, Newlands y Mendeleiev contribuyeron al desarrollo de la tabla periódica al reconocer patrones periódicos entre los elementos. La versión moderna de la tabla periódica está organizada en 7 períodos y 18 grupos.
Авторское право:
Attribution Non-Commercial (BY-NC)
Доступные форматы
Скачайте в формате PPT, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 16
Tabla periódica
La tabla periódica es quizás las
palabras con las que se asocie
más
comúnmente la química
Tabla periódica
• ¿De dónde surge la tabla periódica?
• La tabla periódica surge de la
necesidad de organizar y sistematizar
la información de las propiedades de
los elementos.
• Propiedades de diversa naturaleza,
tanto físicas como químicas.
• Masa atómica
• Número atomico
Tabla periódica
Un poco de historia
• Se conocen algunos elementos de
origen nativo, Fe, Au, Ag, C,
….
• En el siglo XVIII, N, H, O y Cl. También
Co, Pt, Ni, Mn, W, Mo, U, Ti, Cr.
• En la primera década del siglo XIX al
menos catorce nuevos elementos.
• 1830 se conocían ya 55 elementos.
• Johann Wolfang Döbereiner (1780-1849)
• Reconoció que el bromo tenía propiedades que
parecían estar justo a la mitad entre el Cloro y
yodo. Reactividad, Peso, etc.
• Estaban e a la mitad. Siguió buscando y encontró
Ca, Sr. Y Ba. Además S, Se, Te.
• Llamó a esto triadas, los pesos encajaban
• muy bien, pero no impactó ya que en esa
• época no se le deba mucha importancia al
• peso atómico.
• OCTAVAS DE NEWLANDS (1837-1898)
• Ordenó los elementos por pesos y
observó tendencias, parecía que
cada 8 se repetían las tendencias y
las triadas de Döbereiner estaban
dentro de esas “8” a las que llamó
• octavas.
• Dimitri Mendeleiev También ordenó por pesos a
los elementos pero hizo contribuciones muy
importantes:
• Observó las variaciones de valencia. A
diferencia de Newlands, no se empeñó en
periodos de 8.
• Propuso un orden en una tabla y no un gráfico.
• Era necesario dejar huecos e hizo predicciones
de propiedades de elementos no descubiertos
• En 1927 Henry Moseley descubre un modo
práctico de hallar los números atómicos, se utiliza
un criterio para ordenar a los elementos químicos.
Se enunció: “Las propiedades físicas y químicas de
los elementos son funciones periódicas de los
números atómicos”.
• Es decir los elementos están ordenados en
función creciente de sus números atómicos.
• La tabla periódica actual (forma larga) fue
diseñada por Werner y es una modificación de
la tabla de Mendeleiev.
• Los elementos se hallan distribuidos:
• En 7 filas denominadas (periodos).
• En 18 columnas o familias, las cuales
se ordenan en grupos; 8 grupos A y
8 grupos B.
• PERIODOS: Son las filas horizontales, nos
indican el último nivel de energía del
elemento. Existen 7 periodos o niveles.
• Periodo 1, 2 y 3, formados por 2, 8 y 8 elementos
respectivamente, son denominados Periodos
cortos.
• Periodos 4, 5 y 6 son los Periodos largos, el 7º
periodo se halla incompleto.
• Los elementos cuyos números atómicos se hallan
comprendidos entre el La (Z= 57) y el Lu (Z= 71)
se llaman Lantánidos.
• Los elementos con número atómico
superior al Ac (Z= 89) se denominan
Actínidos. Ellos se encuentran
separados en 2 filas de la tabla
periódica, con el objeto de no
extender demasiado la figura. Los
elementos después del Uranio (Z=
92) se han obtenido en forma
artificial del uranio, denominándose a
éstos Trans uránicos.
• GRUPOS O FAMILIAS: Son
agrupaciones verticales, que nos
indican que poseen propiedades
químicas semejantes, debido a que
poseen los mismos electrones de
valencia.
En la tabla periódica están ordenados
en grupos A y B.
• Clasificación de los elementos químicos
• Los elementos químicos se pueden clasificar en:
Metales, no metales, metaloides y gases
nobles.
• Metales:
• Son buenos conductores del calor y la electricidad.
• Se oxidan (pierden electrones).
• Se les denomina también reductores.
• Son electropositivos.
• Son sólidos a excepción del mercurio
• No metales:
• Son malos conductores del calor y la
electricidad.
• Se reducen (ganan electrones).
• Se les denomina también oxidantes.
• Son electronegativos.
• La mayoría a temperatura ambiente se
encuentran en estado sólido. Como gases
están N, O, F, Cl, H y en estado líquido el
Br.
• Metaloides :
• Son elementos que tienen propiedades
metálicas y no metálicas. Ocupan una
región diagonal que se observa en la tabla
periódica (transición entre metal y no
metal); entre ellos podemos encontrar al B,
Si, Ge, As, Sb, Te, Po.
• Gases nobles:
• Son elementos químicamente
estables por tener su última capa 8
e- a excepción del He que tiene 2
• No se combinan con ningún otro
elemento.
Вам также может понравиться
- Evaluación de Química Tabla Periódica MudaДокумент1 страницаEvaluación de Química Tabla Periódica Mudasiliana pallaresОценок пока нет
- Que Son Las CélulasДокумент3 страницыQue Son Las Célulasjoana gisel schallerОценок пока нет
- Ciclos de Potencia de Vapor y CombinadosДокумент40 страницCiclos de Potencia de Vapor y CombinadosRoque RendonОценок пока нет
- Informe de Tensión SuperficialДокумент7 страницInforme de Tensión SuperficialRonny Alexander Peralta100% (1)
- Cuestionario de Tabla PeriodicaДокумент7 страницCuestionario de Tabla PeriodicaGENESIS KARISMA LIZARRAGA DIAZОценок пока нет
- ÁtomoДокумент29 страницÁtomoJhonatan Alejandro Hernandez LedesmaОценок пока нет
- Microorganismos y Virus 7°Документ11 страницMicroorganismos y Virus 7°Oscar Waldo Vega Farías100% (1)
- Teoría Atómica 8° CLAS. N°2Документ24 страницыTeoría Atómica 8° CLAS. N°2daniela100% (1)
- Presentación 1Документ17 страницPresentación 1Nia NiaОценок пока нет
- 7mo Comportamiento de Los GasesДокумент7 страниц7mo Comportamiento de Los GasessorsirelОценок пока нет
- Química IДокумент10 страницQuímica ICesaro LoquendoОценок пока нет
- ELECTROESTATICAДокумент13 страницELECTROESTATICAJhon RamírezОценок пока нет
- Presentación Septimo BasicoДокумент19 страницPresentación Septimo BasicoCintia MaciasОценок пока нет
- 8basico - Evaluacion Ciencias CelulaДокумент8 страниц8basico - Evaluacion Ciencias CelulaGerith MuñozОценок пока нет
- Examen Adicion y Sustraccion de EnterosДокумент1 страницаExamen Adicion y Sustraccion de EnterosMargarita Cárdenas RuizОценок пока нет
- Guia Contenido Rep Liberal Sexto Basico 2015Документ5 страницGuia Contenido Rep Liberal Sexto Basico 2015Marina NovaОценок пока нет
- Prueba de Potencias y Raices 8°básico - EDR 21Документ4 страницыPrueba de Potencias y Raices 8°básico - EDR 21Luis Alberto Castro CuriqueoОценок пока нет
- Evaluación Formativa Biología Primero MedioДокумент4 страницыEvaluación Formativa Biología Primero MedioMachita PerezОценок пока нет
- Guia Tabla PeriódicaДокумент12 страницGuia Tabla PeriódicaFelipe Alejandro JaraОценок пока нет
- Guia 4 Clasificación de Los Seres Vivosgrado Sexto Sin TerminarДокумент10 страницGuia 4 Clasificación de Los Seres Vivosgrado Sexto Sin TerminaralfonsoОценок пока нет
- Unidad1-Teorías y Modelos AtómicosДокумент27 страницUnidad1-Teorías y Modelos AtómicosVictoria GraciaОценок пока нет
- Segundo Periodo Grado 7° SocialesДокумент13 страницSegundo Periodo Grado 7° Socialesdaiidi100% (1)
- Noveno Curso RemedialДокумент8 страницNoveno Curso Remedialアレハンド ロカバジェロ アコスタОценок пока нет
- Potencias 2Документ3 страницыPotencias 2Valeria JimenezОценок пока нет
- Compuestos TernariosДокумент7 страницCompuestos TernariosRito Eduardo Escobar EscobedoОценок пока нет
- Clasificacion de La MateriaДокумент37 страницClasificacion de La MateriaJosecmanОценок пока нет
- Guia 1° Medio BiologiaДокумент9 страницGuia 1° Medio BiologiagenoОценок пока нет
- Evaluación 2do MedioДокумент3 страницыEvaluación 2do MedioHumberto C. BustosОценок пока нет
- Ejercicios de SolucionesДокумент4 страницыEjercicios de SolucionesHades DHОценок пока нет
- Evaluación Diagnóstica Octavo PautaДокумент7 страницEvaluación Diagnóstica Octavo PautaMaria Ines Astudillo ParraОценок пока нет
- Adicion y Sustraccion EnterosДокумент5 страницAdicion y Sustraccion EnterosMayra Muñoz ContrerasОценок пока нет
- Guía de Cargas Electricas 8º BasicoДокумент5 страницGuía de Cargas Electricas 8º BasicoJavieraОценок пока нет
- Taller Modelos AtomicosДокумент3 страницыTaller Modelos Atomicosmanuel amaranthОценок пока нет
- Taller de Taxonomia Grado 8Документ3 страницыTaller de Taxonomia Grado 8Alejandra Ocampo RinconОценок пока нет
- Ciencias NaturalesДокумент69 страницCiencias NaturalesRoyalty Workers PreuniversitarioОценок пока нет
- Trabajo Práctico N3atomoytpqca2Документ2 страницыTrabajo Práctico N3atomoytpqca2ManuelaPerovichОценок пока нет
- Guia de Estudio 2 Modelos AtomicosДокумент5 страницGuia de Estudio 2 Modelos AtomicosGeraldine Cárdenas RiveraОценок пока нет
- Guia de Laboratorio # 6 Cn105Документ3 страницыGuia de Laboratorio # 6 Cn105Isma Molina DíazОценок пока нет
- Prueba Sistema Excretor Octavo 2022 Fila BДокумент4 страницыPrueba Sistema Excretor Octavo 2022 Fila BMaria Fernanda Escudero BenenzianoОценок пока нет
- Modelos Atomicos 8 BasicoДокумент17 страницModelos Atomicos 8 BasicoPao Veliz GonzalezОценок пока нет
- Tabla PeriodicaДокумент3 страницыTabla PeriodicaLuis CastilloОценок пока нет
- Prueba de Ecuaciones Septimo AñoДокумент3 страницыPrueba de Ecuaciones Septimo AñoVictor Alejandro Cuevas EncaladaОценок пока нет
- Prueba 7° FuerzaДокумент2 страницыPrueba 7° FuerzaMaria GracielaОценок пока нет
- FISICA 8AVO Fenómenos Eléctricos de La MateriaДокумент16 страницFISICA 8AVO Fenómenos Eléctricos de La MateriaAndrea Paola Olguin AravenaОценок пока нет
- Actividades Tabla Periodica 2017Документ4 страницыActividades Tabla Periodica 2017Miriam ArriagadaОценок пока нет
- Crucigrama El Sistema DigestivoДокумент1 страницаCrucigrama El Sistema DigestivoJohanaОценок пока нет
- Prueba Nivelacion 8vo CienciasДокумент4 страницыPrueba Nivelacion 8vo CienciasGabi Reyes CampanoОценок пока нет
- Clase 6 Sexto Básico Ciencias Naturales Tipos de SueloДокумент6 страницClase 6 Sexto Básico Ciencias Naturales Tipos de SueloJorge HerreraОценок пока нет
- Guia de Ejercicios Nº1 - Electroestática - Octavo Básico (Física) - para El NivelДокумент4 страницыGuia de Ejercicios Nº1 - Electroestática - Octavo Básico (Física) - para El NivelVale Jiménez GallardoОценок пока нет
- Numeros Cuanticos Primero MedioДокумент4 страницыNumeros Cuanticos Primero MedioTía Marité Lagos100% (1)
- Guia #2 La Evolucion y Sus Evidencias Grado NovenoДокумент5 страницGuia #2 La Evolucion y Sus Evidencias Grado Novenorocio menaОценок пока нет
- CARÁCTERÍSTICAS Eucariontes y ProcariontesДокумент2 страницыCARÁCTERÍSTICAS Eucariontes y ProcariontesBere ZarateОценок пока нет
- @ 2da Prueba Sumativa Quimica Basica 10 EgbДокумент3 страницы@ 2da Prueba Sumativa Quimica Basica 10 EgbsancuniОценок пока нет
- Guía Unidad Cero 1ro Medio QuímicaДокумент11 страницGuía Unidad Cero 1ro Medio QuímicaGuillermo Paniagua ValdebenitoОценок пока нет
- Acidos NucleicosДокумент2 страницыAcidos NucleicosGLENDY ARACELY TUBAC TUNОценок пока нет
- Evaluacion Teorias AtomicasДокумент3 страницыEvaluacion Teorias AtomicasIsolina Patricia Salas VegaОценок пока нет
- LA Célula OCTavo 2022Документ68 страницLA Célula OCTavo 2022OlivSanMariaОценок пока нет
- Evaluación Química El AtomoДокумент4 страницыEvaluación Química El AtomoMargarita Isabel Figueroa SilvaОценок пока нет
- Guía 6 Recursos Energeticos Renovables y No RenovablesДокумент6 страницGuía 6 Recursos Energeticos Renovables y No RenovablesSandra Rivera100% (1)
- Tabla Periódica SecundariaДокумент28 страницTabla Periódica SecundariaDiana MurilloОценок пока нет
- Tabla Periodica PDFДокумент6 страницTabla Periodica PDFKariLu LittleFaceОценок пока нет
- La Tabla Periódica WordДокумент7 страницLa Tabla Periódica Wordluana ayalaОценок пока нет
- Crucigrama Acidos y BasesДокумент1 страницаCrucigrama Acidos y Basespepe espinosa33% (3)
- Crucigrama Acidos y BasesДокумент1 страницаCrucigrama Acidos y Basespepe espinosa33% (3)
- Reseña de Las Naciones UnidasДокумент2 страницыReseña de Las Naciones Unidaspepe espinosaОценок пока нет
- Industrializacion Carne de Cerdo PDFДокумент32 страницыIndustrializacion Carne de Cerdo PDFcaimancilloОценок пока нет
- Hepatitis Por FármacosДокумент33 страницыHepatitis Por FármacosXochitl Reyes100% (1)
- Deacon ProcesoДокумент2 страницыDeacon ProcesoBryan Piguave100% (2)
- Broca Análisis Estático 2-1Документ11 страницBroca Análisis Estático 2-1DiegoОценок пока нет
- Elementos de Eje Curvo y de Sección VariableДокумент11 страницElementos de Eje Curvo y de Sección VariableJosephJaramillodelAguilaОценок пока нет
- Pruebas Bioquimicas SecundariasДокумент4 страницыPruebas Bioquimicas SecundariasAyesha CastilloОценок пока нет
- Informe Caracterización Vertimientos 2017Документ60 страницInforme Caracterización Vertimientos 2017Edwin Vigoya VizcainoОценок пока нет
- ContenidoДокумент47 страницContenidonilsortizОценок пока нет
- Fuerza RequeridaДокумент3 страницыFuerza RequeridaNicolasRRRОценок пока нет
- Sesiones Ciencia y TecnologiaДокумент25 страницSesiones Ciencia y TecnologiaMarisol Monsalve Sanchez100% (3)
- Mecanismos de Desgaste y Tecnicas de ProtecciónДокумент13 страницMecanismos de Desgaste y Tecnicas de ProtecciónRobert Samame MartinezОценок пока нет
- Proyecto Extractor AceitesДокумент5 страницProyecto Extractor AceitesClaudia Miriam RamosОценок пока нет
- 15 SolucionarioДокумент111 страниц15 SolucionarioOrlando AguirreОценок пока нет
- Adriana Hurtado Gomez Tesis DoctoralДокумент319 страницAdriana Hurtado Gomez Tesis DoctoralEstefani Mendoza VeraОценок пока нет
- Taller 3 de Fisica MecanicaДокумент3 страницыTaller 3 de Fisica Mecanicajuan diegoОценок пока нет
- Exposicion Biologo Unidad 5Документ41 страницаExposicion Biologo Unidad 5Carlos BaenaОценок пока нет
- 6 OrganometalurgiaДокумент13 страниц6 OrganometalurgiaJoel Alexander Choque CutimboОценок пока нет
- Cuestionario Instrumentación BiomédicaДокумент3 страницыCuestionario Instrumentación BiomédicamyoshkeuОценок пока нет
- Informe Jugo de PiñasДокумент7 страницInforme Jugo de PiñasVanessa ArguelloОценок пока нет
- 4.1-A - Reaccioness de Oxidacion en Quimica Organica.Документ39 страниц4.1-A - Reaccioness de Oxidacion en Quimica Organica.ALANОценок пока нет
- Exposicion Agrotecnia Clase 1,2 3Документ109 страницExposicion Agrotecnia Clase 1,2 3Mtsc Marco Desarrollo SostenibleОценок пока нет
- F-SGA-10 Tabla de Incompatibilidad Del Almacen General de Sustancias Químicas Rev. 01Документ1 страницаF-SGA-10 Tabla de Incompatibilidad Del Almacen General de Sustancias Químicas Rev. 01Uziel YepezОценок пока нет
- Fuerza de ChorroДокумент6 страницFuerza de Chorrojorlany zapataОценок пока нет
- Rombo de Seguridad y Otros DatosДокумент3 страницыRombo de Seguridad y Otros DatosKaren Chavarro ChauxОценок пока нет
- Informe - QF - Análisis de Procaína ListoДокумент12 страницInforme - QF - Análisis de Procaína ListoJoselyn ArellanoОценок пока нет
- Química - PamerДокумент18 страницQuímica - PamerAMALIA MAMANI ARAZOLAОценок пока нет
- Taller de NeurotransmisoresДокумент4 страницыTaller de NeurotransmisoresCarlos Alberto Gomemz LopezОценок пока нет
- 3M Limpieza Areas EspecificasДокумент20 страниц3M Limpieza Areas EspecificasWalter Patricio Perez-SereñoОценок пока нет
- Practica 4 LabДокумент2 страницыPractica 4 Labvictor emanuelОценок пока нет