Академический Документы
Профессиональный Документы
Культура Документы
Estados de La Materia
Загружено:
ZHARIK CAROLINA FELIZZOLA MORGAN (:-)0 оценок0% нашли этот документ полезным (0 голосов)
20 просмотров18 страницeste pdf es util para conocer los estados y cambios de agregacion de la materia
Оригинальное название
estados de la materia
Авторское право
© © All Rights Reserved
Доступные форматы
PPTX, PDF, TXT или читайте онлайн в Scribd
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документeste pdf es util para conocer los estados y cambios de agregacion de la materia
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PPTX, PDF, TXT или читайте онлайн в Scribd
0 оценок0% нашли этот документ полезным (0 голосов)
20 просмотров18 страницEstados de La Materia
Загружено:
ZHARIK CAROLINA FELIZZOLA MORGAN (:-)este pdf es util para conocer los estados y cambios de agregacion de la materia
Авторское право:
© All Rights Reserved
Доступные форматы
Скачайте в формате PPTX, PDF, TXT или читайте онлайн в Scribd
Вы находитесь на странице: 1из 18
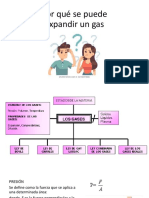
ESTADOS DE AGREGACION DE LA
MATERIA
MAURICIO JOSÉ GONZÁLEZ MORALES
DOCENTE DE QUÍMICA
¿Qué es la materia ?
ESTADOS DE AGREGACION DE LAMATERIA
CAMBIOS DE ESTADO DE LA MATERIA
Estudio de la materia
(Gases)
FACTORES QUE DETERMINAN EL ESTADO GASEOSO
• En el estudio de las interacciones que tienen lugar en los gases , se tienen en
cuenta las variaciones que ocurren con:
El volumen : espacio en el cual se mueven las moléculas.
La temperatura : cantidad de movimiento de las partículas de un sistema. No
es sinónimo de calor.
La presión : se define como la fuerza ejercida sobre un área especifica.
TEORIA CINETICA DE LOS GASES
(ESTUDIA EL COMPORTAMIENTO DE LOS GASES)
Postulados…
Los gases están compuestos por átomos o moléculas muy separadas que se mueven con gran
rapidez y direcciones al azar.
Las partículas que conforman un gas están en un constante movimiento caótico y
experimentan choques elásticos.
Cada una de dichas partículas posee una energía cinética que depende de la temperatura.
La presión de un gas es consecuencia de los choques de las moléculas de dicho gas con las
paredes del recipiente que los contiene.
MODELO CINETICO – PARTICULAR (ESTADO
GASEOSO)
• Analogía con un partido de futbol.
UNIDADES DE PRESIÓN Y EQUIVALENCIA
• 1atm = 101325Pa = 760mmHg = 760 Torr =
29,92 in de Hg = 1013mbar
Dada la información anterior realiza los siguientes
ejercicios
EJERCICIOS
• En un punto de la superficie terrestre la Presión atmosférica resulta ser de
750 mbar. ¿cuál es la presión en atm , Pa , Torr y in de Hg ?.
• La presión de un gas en un recipiente, resulta ser de 76.420 Pa ¿cuál es la
presión en atmósferas?.
• Calcula la PRESIÓN que ejerce sobre el suelo de hielo, una persona de 70
Kg, si la superficie de las suelas de sus zapatos es de 260 cm2. ¿Y si se
coloca unos esquíes de superficie 3000 cm2? (Tómese g=10 N/Kg).
LEYES DE LOS GASES
• Ley de Boyle – Mariotte
• Ley de Charles
• Ley de Gay – Lussac
• Ley combinada de los gases
• Ley de Avogadro
• Ley de Dalton
• Ecuación de estado de los gases ideales
• Ley de Graham
•Ver video
EJERCICIOS (LEY DE BOYLE - MARIOTTE)
• Un gas, a temperatura constante, ocupa un volumen de 50 l a la presión de 2 atm.
¿Qué volumen ocupará si duplicamos la presión?.
• Un gas, a temperatura constante, ocupa un volumen de 20 l a la presión de 3 atm.
¿Qué volumen ocupará si la presión pasa a ser de 5 atm?
• Una determinada cantidad de gas que ocupa un recipiente de 2,5 L y ejerce una
presión sobre las paredes del mismo de 3,2 atm ¿qué presión ejercerá si el volumen
lo reducimos a 1,2 L manteniendo constante la temperatura? ¿y si lo aumentamos a
4,6 L?
• En un recipiente de 4,5 litros de volumen, tenemos hidrógeno a 2,9 atm de presión.
Si mantenemos la temperatura constante y variamos el volumen del recipiente hasta
1,9 litros ¿Cuál será la nueva presión?.
• Experimentando con gas helio a temperatura constante, obtenemos los siguientes
pares de valores V(volumen) y P(presión) : Si V=3,2 L P=2,0 atm ; Si V=6,4 L P=
1,0 atm ; Si V=8,0 L P=0,8 atm. ¿Se cumple la ley de Boyle? ¿Cuál será la presión si
el volumen lo hacemos 4,5 L?
1.- Sí la cumple. P = 1,4 atm.
2.- No la cumple. No se puede calcular .
3.- Sí la cumple. P = 5,9 atm
• Una muestra de oxigeno ocupa 10 L bajo una presión de 790 torr, ¿a que
presión debería ocupar éste un volumen de13.4 L, si la temperatura no
cambia?
• Un globo que contiene 1.50 L de aire a 1.0 atm es colocado bajo el agua a
una profundidad a la cual la presión es 3.0 atm. Calcula el nuevo volumen
del globo. Asume que la temperatura es constante.
EJERCICIOS “LEY DE CHARLES”
• El volumen inicial de una cierta cantidad de gas es de 200 mL a la temperatura de
293,15 K. Calcule el volumen del gas si la temperatura asciende a 363,15 K y la
presión se mantiene constante.
• Una masa de oxígeno ocupa 200 mL a 100°C. Determine su volumen a 0°C, si la
presión se mantiene constante.
• Una cantidad fija de gas a 296,15 K ocupa un volumen de 10,3 Litros, determine la
temperatura final del gas si alcanza un volumen de 23,00 L a presión constante.
• Un gas ocupa un volumen de 3.5 litros a una temperatura de 60K. Si la presión
permanece constante, ¿a qué temperatura en volumen seria de 6.5 litros?.
• Si el volumen del aire de una habitación a 8ºC es de 900 litros. ¿Cuánto aire
escapara de la habitación si se calienta hasta 30ºC?.
• Se encuentran 6 litros de un gas ideal a 24ºC y presión constante. ¿Cuánto
disminuye su temperatura para que su volumen sea de 4 litros?.
Вам также может понравиться
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesОт EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesОценок пока нет
- Gases, Leyes de Los GásesДокумент28 страницGases, Leyes de Los GásesSamara Moscote siosiОценок пока нет
- 3º - Ecuación-de-estado-Ley-de-los-gases-ideales 2Документ22 страницы3º - Ecuación-de-estado-Ley-de-los-gases-ideales 2JAVIERA MUÑOZОценок пока нет
- Leyes de Los GasesДокумент61 страницаLeyes de Los GasesEmily VillaОценок пока нет
- Leyes de Los GasesДокумент13 страницLeyes de Los GasesMangiro SanoОценок пока нет
- Unidad 1 Bio MBR Nov 2023Документ86 страницUnidad 1 Bio MBR Nov 2023meilicristin97Оценок пока нет
- Gases QuímicaДокумент18 страницGases QuímicaDiego Alejandro Ruiz PeñaОценок пока нет
- Leyes de Los Gases PDFДокумент6 страницLeyes de Los Gases PDFJosheloteОценок пока нет
- ESTADO GASEOSO, ResumenДокумент6 страницESTADO GASEOSO, Resumencarlos acaro fajardoОценок пока нет
- GasesДокумент1 страницаGasesClovis Erick Rengel DominguezОценок пока нет
- Ley de Los GasesДокумент51 страницаLey de Los GasesJulio TiradoОценок пока нет
- Ley de Gases4 Par 21Документ45 страницLey de Gases4 Par 21johnny quezadaОценок пока нет
- Gases 11Документ22 страницыGases 11CAMILO GIOVANNY ÑUNGO CRUZОценок пока нет
- Gases IdealesДокумент7 страницGases IdealesEric Bar LamasОценок пока нет
- Ley de Boyle-MariotteДокумент13 страницLey de Boyle-MariotteLAURA SOFIA MALDONADO ZAPATAОценок пока нет
- Taller de Ejercicios de BoyleДокумент1 страницаTaller de Ejercicios de Boylelizney gutierrezОценок пока нет
- Problemas de GasesДокумент2 страницыProblemas de GasesAlondra VegaОценок пока нет
- Ejercicios Ley de BoyleДокумент7 страницEjercicios Ley de BoyleDaisy Alejandra Muñoz SilvaОценок пока нет
- Estado GaseosoДокумент46 страницEstado GaseosoAlejandra MurilloОценок пока нет
- Gases: Docentes de Química Semana: 4Документ43 страницыGases: Docentes de Química Semana: 4ALI EDSON MARTINEZ ZEGARRAОценок пока нет
- Ley de Los Gases 2022Документ2 страницыLey de Los Gases 2022Abdias MancillaОценок пока нет
- Ley de Los Gases FicoДокумент47 страницLey de Los Gases Ficoelver regalado goicocheaОценок пока нет
- Diapositivas 1 Quimica2017Документ168 страницDiapositivas 1 Quimica2017Margot Flores Salgado100% (3)
- Clase Upv Ley GasesДокумент16 страницClase Upv Ley GasesHumberto C. BustosОценок пока нет
- Ley de Los Gases Ejercicos ResueltosДокумент6 страницLey de Los Gases Ejercicos ResueltosCristina Castaño Llamas100% (1)
- Diapositivas Unidad # 4 Leyes de Los GasesДокумент46 страницDiapositivas Unidad # 4 Leyes de Los GasesMellkyo -.-100% (1)
- Estado GaseosoДокумент33 страницыEstado Gaseosojairaguillon059Оценок пока нет
- Ejercicios Leyes Boyle Gay Lussac Gases EtcДокумент4 страницыEjercicios Leyes Boyle Gay Lussac Gases EtcPaola Alexandra LaguadoОценок пока нет
- 3.1 Qué Es El AireДокумент24 страницы3.1 Qué Es El AireCaro ErazoОценок пока нет
- Natalia Herrera - Ley de Gases - Taller - 11°BДокумент9 страницNatalia Herrera - Ley de Gases - Taller - 11°BKeythelОценок пока нет
- Estudio Dirigido QuímicaДокумент2 страницыEstudio Dirigido QuímicaDAPHNE NICOLLE SALAZAR GALÁNОценок пока нет
- Guía de Ejercicios Leyes de Los Gases (05-04)Документ1 страницаGuía de Ejercicios Leyes de Los Gases (05-04)Massiel Vergara50% (2)
- Taller Ley de GasesДокумент1 страницаTaller Ley de GasesCarlos CadenaОценок пока нет
- GasesДокумент16 страницGasesMireya IvannaОценок пока нет
- Leyes de Los GasesДокумент18 страницLeyes de Los GasesMaria Alejandra Munevar Diaz0% (1)
- Gases Ideales y Sustancias Puras Calor EspecificoДокумент36 страницGases Ideales y Sustancias Puras Calor EspecificoAldairOrtegaAguileraОценок пока нет
- Unidad 1Документ34 страницыUnidad 1ej pf0% (1)
- Guia - Leyes de Los Gases AGOSTOДокумент4 страницыGuia - Leyes de Los Gases AGOSTOCaren RojasОценок пока нет
- Tarea 1 - Gases IdealesДокумент7 страницTarea 1 - Gases IdealesNancy Olivia VentoleroОценок пока нет
- Unidad II - GasesДокумент34 страницыUnidad II - Gasessandovalcorp19Оценок пока нет
- Gases IdealesДокумент9 страницGases IdealesJuan Alberto Mondaca FuentesОценок пока нет
- Unidad 6Документ44 страницыUnidad 6William ArayaОценок пока нет
- Informe 3 FisicoquimicaДокумент9 страницInforme 3 FisicoquimicaRodrigo AlcaОценок пока нет
- 2 Guia de Aprendizaje Quimica GasesДокумент11 страниц2 Guia de Aprendizaje Quimica GasesSAMUEL MUÑOZ MONTOYAОценок пока нет
- Dilatacion de Los GasesДокумент8 страницDilatacion de Los GasesNathanael GranadosОценок пока нет
- Rutina de Pensamiento Estado Gaseoso.Документ4 страницыRutina de Pensamiento Estado Gaseoso.Valentina SeguraОценок пока нет
- PJQDNL 23 LEYES DE LOS GASESДокумент4 страницыPJQDNL 23 LEYES DE LOS GASESThe Mr. UwUОценок пока нет
- PDF I - Clase 1 (Gases y Teoría Cinético Molecular)Документ25 страницPDF I - Clase 1 (Gases y Teoría Cinético Molecular)Francisco Reyes AnaluisaОценок пока нет
- Taller JatunДокумент4 страницыTaller JatunCarlos Oswaldo García Paredes0% (1)
- Practica 01 FQ Ambiental - 2021Документ6 страницPractica 01 FQ Ambiental - 2021Juan Carlos LiconaОценок пока нет
- Práctica 3. Estudio de Las Propiedades de Los Sistemas Gaseosos.Документ17 страницPráctica 3. Estudio de Las Propiedades de Los Sistemas Gaseosos.DANIEL ENRIQUE PIÑEROS RODRIGUEZОценок пока нет
- Taller2 CalorДокумент3 страницыTaller2 CalorJohn CastañedaОценок пока нет
- Guias de Ejercicios para Septimos Basicos 2020Документ6 страницGuias de Ejercicios para Septimos Basicos 2020julieta100% (1)
- Ejer - Leyes Gases - Guarda - 21 - 22Документ2 страницыEjer - Leyes Gases - Guarda - 21 - 22ieslesdunesilya iyouyuyotiОценок пока нет
- Tarea GasesДокумент3 страницыTarea GasesJuan100% (1)
- Taller de Gases.... 2Документ3 страницыTaller de Gases.... 2luigocuОценок пока нет
- Problemas de Las Leyes de Los GasesДокумент3 страницыProblemas de Las Leyes de Los GasesCOTOBADAОценок пока нет
- 2154 PDFДокумент14 страниц2154 PDFLuis Alberto Tejada RiveraОценок пока нет
- Catálogo ESENSI Todos Los Productos 2Документ187 страницCatálogo ESENSI Todos Los Productos 2Cj RiveraОценок пока нет
- Presupuesto A Costo Directo (Mano de Obra y Equipo)Документ48 страницPresupuesto A Costo Directo (Mano de Obra y Equipo)Sergio MartinezОценок пока нет
- HidrocarburosДокумент31 страницаHidrocarburosjesusОценок пока нет
- Catalogo Cocinas para Enviar A Los Clientes 2023Документ44 страницыCatalogo Cocinas para Enviar A Los Clientes 2023Danilo AmbrocioОценок пока нет
- Marco Teorico Practica 1 de Tension.Документ8 страницMarco Teorico Practica 1 de Tension.Diego MinguraОценок пока нет
- 3.1 Componentes y Fases Del SueloДокумент9 страниц3.1 Componentes y Fases Del SueloVictor Miguel Vergara LoveraОценок пока нет
- MetalesДокумент4 страницыMetalesAshley Maxim Luciano SuárezОценок пока нет
- Fundentes y Combustibles PDFДокумент10 страницFundentes y Combustibles PDFIsabella AponzaОценок пока нет
- Ladrillo Cerámico Portante y Losa Hueca Presentada 30 CMДокумент29 страницLadrillo Cerámico Portante y Losa Hueca Presentada 30 CMRocio ZampelliОценок пока нет
- LECTURA 1 Seguridad MineraДокумент6 страницLECTURA 1 Seguridad MineraMaria Del Pilar Del Carpio AlemanОценок пока нет
- Anhidrico AceticoДокумент18 страницAnhidrico AceticoJuan JikygОценок пока нет
- Deber de EstequiometriaДокумент2 страницыDeber de EstequiometriaoscarОценок пока нет
- Lectura 4.1-Nomenclatura de Compuestos InorgánicosДокумент14 страницLectura 4.1-Nomenclatura de Compuestos InorgánicosAlanis PonceОценок пока нет
- Ensayo ClauДокумент2 страницыEnsayo ClauClaudia Fabiola Garcia PinzonОценок пока нет
- Alexis Pérez Semana8 Resist - Delos Materiales.Документ5 страницAlexis Pérez Semana8 Resist - Delos Materiales.alexis perez diazОценок пока нет
- CatalogoДокумент8 страницCatalogoSirfrid425Оценок пока нет
- Litotipo de CarbonДокумент14 страницLitotipo de CarbonMajoОценок пока нет
- CUESTIONARIOДокумент4 страницыCUESTIONARIOJESSI MALDONADOОценок пока нет
- Plano y Medidas Como Hacer Una Comoda Con Gavetas de MDF - Web Del Bricolaje Diseño DiyДокумент15 страницPlano y Medidas Como Hacer Una Comoda Con Gavetas de MDF - Web Del Bricolaje Diseño DiyNicolas SalasОценок пока нет
- Composta Escolar: Plantel: Cecytec 18 NopalucanДокумент10 страницComposta Escolar: Plantel: Cecytec 18 NopalucanDaniel OrtegaОценок пока нет
- CristalografiaДокумент228 страницCristalografiaBoris Yeltsin Ramos Bautista100% (1)
- Física II - Teoría de Elasticidad.Документ41 страницаFísica II - Teoría de Elasticidad.Yohan Sanchez cornejoОценок пока нет
- XMXXДокумент23 страницыXMXXRicardo HDZ VQZОценок пока нет
- Capacitación Sistemas Intrinsecamente Seguros 2Документ25 страницCapacitación Sistemas Intrinsecamente Seguros 2Analista CalidadОценок пока нет
- Manipulación Segura Cierre y Apertura de Cilindros de GasДокумент1 страницаManipulación Segura Cierre y Apertura de Cilindros de GasCarolina PereiraОценок пока нет
- Laboratorio de Química Orgánica I QU328DДокумент47 страницLaboratorio de Química Orgánica I QU328DRICHARD YHEMERSON NUÑEZ AVILAОценок пока нет
- Acuarama 1 BreviarioДокумент50 страницAcuarama 1 BreviarioundosoОценок пока нет
- Vulkem 350Документ2 страницыVulkem 350juancarlosblanОценок пока нет
- Guia 4 Octavo GradoДокумент2 страницыGuia 4 Octavo GradojuansarmientoОценок пока нет