Академический Документы
Профессиональный Документы
Культура Документы
Teoría Cuántica
Загружено:
JuanMaNoriegaАвторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Teoría Cuántica
Загружено:
JuanMaNoriegaАвторское право:
Доступные форматы
1
TEORA CUANTCA
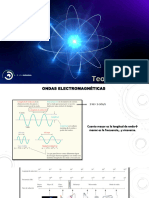
Radiacin electromagntica
Las ondas de radio, R, UV, Luz
visible, rayos X, etc., son tipos
de radiacin electromagntica
Esta radiacin via]a a travs del
espacio con un movimiento
ondulatorio
E8TRUCTURA ELECTRONCA
DE LO8 ATOMO8
Las diferentes clases de
energia radiante parecen muy
diferentes unas de otras pero
todas comparten
caracteristicas fundamentales
Todos los tipos de energia
radiante se llaman tambin
radiacin electromagntica
E8TRUCTURA ELECTRONCA
DE LO8 ATOMO8
Velocidad de la radiacin en el
vacio = X10
8
m/s {vel. de la luz_
La energia radiante tiene
caracteristicas de onda
Distancia entre picos o
depresiones = longitud de onda
Nmero de ondas que pasan por
un punto determinado en un
segundo = frecuencia
VELOCDAD DE LA LUZ {C_
C= 424c/ 2
2 de rayos csmicos son
similares a los diametros de los
ncleos atmicos mientras que
2 de ondas de radio miden
muchos metros
La frecuencia se expresa en
ciclos por segundo { tambin
llamado hertz {Hz_
RADACON
ELECTROMAGNETCA
Rayos X : 10
-10
m = A
0
Ultravioleta - visible: 10
-9
m =
nm
nfrarro]o: 10
-6
m = 3m
nfrarro]o: 10
-
m = mm
Microondas: cm = 10
-
m
Tv radio m
6
Teoria de Planck
Radiacin del cuerpo negro
{ radiacin que emite ob]eto
caliente_
Las leyes de la fisica no podian
explicar el espectro de luz
emitido por un cuerpo negro
TEORA DE PLANCK
Planck: Los cambios de energia
asociados con la radiacin de
un cuerpo negro no son
continuos
Propuso que la energia slo
puede ser liberada en paquetes
de un tamao minimo
8
TEORA DE PLANCK
El incremento de energia
ganado o perdido mas pequeo
posible fue llamado quantum
Los cambios de energia deben
ser mltiplos de nmeros
enteros de una constante
multiplicada por la frecuencia 4
de la energia radiante
9
TEORA DE PLANCK
8i E es la cantidad de energia
ganada o perdida, entonces de
acuerdo con la teoria de Planck
E = h4, h4, h4..
h es conocida como la
constante de Planck
h = 6.6X10
-
]oules - segundo
10
TEORA DE PLANCK
La ganancia o prdida de
energia de un mltiplo
fraccionario de h4esta
prohibida en la teoria de Planck.
Las energias permitidas estan
cuantizadas
El incremento mas pequeo de
energia a una frecuencia dada
h4 se denomina quantum
{cuanto_ de energia
11
TEORA DE PLANCK
Un cuanto de energia h4es muy
pequeo
EFECTO FOTOELECTRCO
La incidencia de luz sobre una
superficie metalica limpia
puede causar que la superficie
emita electrones. Esto es
conocido como efecto
fotoelctrico
1
EFECTO FOTOELECTRCO
Fig.. 6-8 pag. 196
1
EFECTO FOTOELECTRCO
Para cada metal hay una
frecuencia minima de luz, aba]o
de la cual no se emiten
electrones no importando cuan
intenso sea el rayo luminoso.
El efecto fotoelctrico
contradice las predicciones de
los fisicos antes de 1900
1
Einstein {189 -19 _
Utiliz teoria cuantica para
explicar el efecto fotoelctrico
Consider que la energia
radiante que incide sobre la
superficie metalica , es una
corriente de paquetes de
energia - cada paquete llamado
fotn.
1
TEORA DE EN8TEN
Cada fotn es un cuanto de
energia h4
La energia radiante se
considera que esta cuantizada
Los fotones de mayor
frecuencia tienen energias mas
elevadas e inversamente los de
menor frecuencia E
foton
= h4
16
TEORA DE EN8TEN
Cuando un fotn es absorbido
por el metal, su energia se
transfiere al electrn del metal
8e necesita una cantidad de
energia determinada para que el
electrn supere las fuerzas de
atraccin que lo mantienen
dentro del metal
1
TEORA DE EN8TEN
8i los fotones de la radiacin
tienen menos energia que este
umbral energtico, el electrn
no puede escapar de la
superficie del metal aun cuando
el rayo de luz sea intenso. 8i el
fotn tiene energia suficiente el
electrn se emite
18
TEORA DE EN8TEN
8i el fotn tiene mas energia
que la minima requerida para
liberar un electrn, el exceso
aparece como la energia
cintica del electrn emitido
Asi, la energia cintica del
electrn emitido
19
CONTNUACON
E
c
es igual a la energia
suministrada por el fotn h4
menos la energia de unin que
mantiene al electrn en el
metal. E
u
E
c
= h4 -E
u
0
E8PECTRO8 CONTNUO8 Y
LNEALE8
Una fuente de energia radiante,
puede emitir una longitud de
onda nica como en el caso de
la luz de un laser.
8e dice que la radiacin emitida
por una nica longitud de onda
es monocromatica
1
E8PECTRO8
La mayor parte de las fuentes
comunes de radiacin,
producen radiaciones que
contienen muchas longitudes de
onda diferentes. Cuando esta
radiacin se separa en sus
componentes, se produce un
espectro
E8PECTRO8 CONTNUO8
La luz blanca al pasar por un
prisma puede ser dispersada, el
espectro asi producido consiste
en una gama continua de
colores. Esta gama de colores
que contiene luz de todas las
longitudes de onda se llama
E8PECTRO CONTNUO
e].. el Arco iris
E8PECTRO8 CONTNUO8
No todas las fuentes de
radiacin producen espectros
continuos. Por e].. cuando el
hidrgeno se coloca en un tubo
a presin reducida, y se le
aplica un volta]e se emite luz
E8PECTRO8 LNEALE8
Gases diferentes, emiten luz de
colores diferentes
E]. Gas nen, vapor de sodio
Cuando cada una de estas luces
son dispersadas por un prisma
se encuentran solo ciertas
longitudes de onda
E8PECTRO LNEAL
Un espectro que contiene
radiacin de longitudes de onda
especificas se llama espectro
lineal
6
E8PECTRO DE HDROGENO
El espectro de lineas del
hidrgeno es de una gran
simplicidad
En 188 Johann Balmer observ
que la frecuencia de las lineas
mostradas en la fig. 6-1 se
a]ustaban a una frmula
sencilla y misteriosa
E8PECTRO DE HDROGENO
n = C {1/
- 1/n
_ n = ,,,6
C= cte. = .9 X10
1
s
-1
Esta ecuacin sera explicada a
continuacin
8
MODELO DE BOHR PARA EL
HDROGENO
En 191 Bohr utiliz la teoria
cuantica de Planck para
explicar el espectro de lineas
del hidrgeno, introduciendo la
idea fundamental de que las
absorciones y las emisiones de
luz del atomo de hidrgeno,
corresponden a cambios de
energia de los electrones dentro
de los atomos
9
MODELO DE BOHR
El hecho de slo ser emitidas o
absorbidas ciertas frecuencias,
nos dice que slo son posibles
ciertos cambios de energia.
Los cambios de energia estan
cuantizados
0
MODELO DE BOHR
Bohr propuso para el atomo de
hidrgeno: 1_ La teoria
establecida por Rutherford
respecto a la naturaleza nuclear
del atomo, es decir, que la
mayor parte de la masa del
atomo y toda su carga positiva
reside en una regin muy
pequea extremadamente
densa: EL NUCLEO
1
TEORA DE EN8TEN
_ El descubrimiento de Einstein
de que la energia radiante se
podia considerar como una
corriente de con]untos
discretos de energia
denominados fotones
MODELO DE BOHR
El modelo de Bohr fue el
primero en proponer la
cuantizacin de la energia de
los electrones en los atomos
MODELO DE BOHR
Despus de Rutherford los
cientificos estuvieron tentados
a considerar los atomos como
sistemas solares microscpicos
en el cual los electrones orbitan
al ncleo pero en fisica clasica
debia emitirse radiacin
continua y el electrn se
moveria en espiral hacia el
ncleo
MODELO DE BOHR
Bohr resolvi este problema en
forma seme]ante a la de Planck
emple para resolver el
problema de la radiacin del
cuerpo negro, considerando que
la fisica clasica era inadecuada
para describir los atomos
MODELO DE BOHR
El modelo de Bohr consta de los
postulados que se pueden
resumir como sigue:
El electrn de un atomo de
hidrgeno se mueve alrededor
del protn central en una rbita
circular
6
MODELO DE BOHR
8lo estan permitidas las
rbitas de determinados radios
correspondientes a ciertas
energias definidas. 8e dice que
un electrn en una de estas
rbitas se encuentra en un
estado de energia permitido
MODELO DE BOHR
Un electrn en un estado de
energia permitido no caera en
espiral hacia el ncleo
8
MODELO DE BOHR
.- El electrn puede cambiar de
un estado de energia permitido
a otro, absorbiendo o emitiendo
energia radiante. La frecuencia
4de la energia radiante
corresponde exactamente a la
diferencia en energia, E, entre
los estados permitidos de
energia E = h 4
9
MODELO DE BOHR
Bohr fue capaz de calcular un
con]unto de energias permitidas
donde cada una de ellas
corresponde a un diferente
radio de una trayectoria circular
En el modelo de Bohr a cada
rbita se le asign un nmero
entero n
0
MODELO DE BOHR
El nmero entero n es conocido
como nmero cuantico principal
que puede tener valores de 1 al
infinito. El radio de la rbita del
electrn en un estado particular
de energia varia con n
radio = n
{ .0X10
-11
m_
n = 1,, . . .
1
MODELO DE BOHR
Mientras mayor sea el valor de
n, mas le]os estara el electrn
del ncleo
La energia del electrn depende
de las rbitas que ocupa
E
n
= - R
H
{ 1/ n
_
MECANCA ONDULATORA
PRNCPO DE NCERTDUMBRE
Werner Heisenberg
Para diagnosticar la trayectoria
de un cuerpo en movimiento se
debe conocer al mismo tiempo
su posicin y su velocidad
MECANCA ONDULATORA
El principio de incertidumbre de
Heisenberg estableci que es
imposible determinar
simultaneamente la posicin
exacta y el momento exacto de
un cuerpo tan pequeo como
electrn
MECANCA ONDULATORA
Los ob]etos son vistos
iluminandolos. 8e necesitaria
una radiacin con longitud de
onda muy corta para localizar
un electrn. 8i esta radiacin
choca con el electrn, el
impacto hace que la direccin
del movimiento y la velocidad
del electrn cambie
MECANCA ONDULATORA
Parece por tanto que no es
posible una descripcin exacta
de la trayectoria de un electrn
en un atomo de Bohr
6
MECANCA ONDULATORA
Erwin 8chrodinger {mort_
desarroll una ecuacin que
describe al electrn en trmino
de su caracter de onda. Esta
ecuacin es la base de la
mecanica ondulatoria
MECANCA ONDULATORA
Cada funcin de onda
corresponde a un estado de
energia definido para el
electrn, y est relacionado con
la regin en que este puede ser
localizado
La funcin de onda de un
electrn describe lo que se
llama un ORBTAL
8
MECANCA ONDULTORA
ORBTAL
Este se llama asi para
distinguirlo de la rbita de Bohr
Es la regin donde existe la
mayor probabilidad de
encontrar un electrn
Esto es un pronstico de donde
es mas probable encontrar un
electrn
9
MECANCA ONDULATORA
Para un electrn con n = 1 del
atomo de hidrgeno, la nube
con carga que tiene la forma de
una esfera tiene la mayor
densidad de carga cerca del
ncleo y se hace mas tenue a
medida que aumenta la
distancia al ncleo
0
NUMERO8 CUANTCO8
En mecanica cuantica la
distribucin electrnica de un
atomo que contiene una cierta
cantidad de electrones se
divide en niveles
Los niveles a su vez consisten
en uno o mas subniveles
1
NUMERO8 CUANTCO8
8e supone que los subniveles
estan compuestos por uno o
mas orbitales, los que son
ocupados por electrones
NUMERO8 CUANTCO8
Cada electrn de un atomo se
identifica por una combinacin
de nmeros cuanticos que
indican:
nivel
subnivel
orbital
electrn
NUMERO8 CUANTCO8
El nmero cuantico principal n
corresponde en forma muy
aproximada al introducido por
Bohr
Este identifica al nivel al cual
pertenece el electrn
Estos niveles es en donde
probabilidad de hallar un
electrn es alta
NUMERO8 CUANTCO8
El valor de n es un entero
positivo
n = 1,,,.
Cuanto mayor sea el nivel de n,
mas le]ano estara el nivel del
ncleo
NUMERO8 CUANTCO8
Cada nivel consiste de uno o
mas subniveles
El nmero de subniveles en un
nivel es igual al valor de n
Hay un solo subnivel en el nivel
1
Hay en el nivel n = y asi
sucesivamente
6
NUMERO8 CUANTCO8
NUMERO CUANTCO
8UB8DARO
A cada subnivel en un nivel se
le asigna un numero cuantico
subsidiario l
Los valores de l para los
subniveles de un nivel son
determinados por el valor del
nivel n
NUMERO8 CUANTCO8
Existe un valor de l para cada
trmino en la serie
l = 0,1,,,..{n-1_
cuando n =1 el nico valor de l
es 0 y hay un solo subnivel
cuando n = hay subniveles y
los valores de l son 0 y 1
cuando n = l = 0,1 y
8
NUMERO8 CUANTCO8
A veces se usan otros simbolos
para designar los subniveles
8e usa una letra para
representar cada valor de l en la
siguiente forma
l = 0,1,,,,,..
Notacin = s,p,d,f,g,h,..
9
NUMERO8 CUANTCO8
Las primeras notaciones son
las iniciales de los ad]etivos en
ingles usados anteriormente
para identificar las lineas
espectrales:
sharp, principal, diffuse y
fundamental
60
NUMERO8 CUANTCO8
Para valores mayores a , las
letras continan
alfabticamente combinando el
nmero cuantico principal con
una de estas letras se tiene una
forma practica de designar un
subnivel
61
NUMERO8 CUANTCO8
El subnivel con n = y l = 0
se llama subnivel s
El subnivel n= y l=1 se llama
subnivel p
Cada subnivel consiste de uno o
mas orbitales
6
NUMERO8 CUANTCO8
El numero de orbitales en un
subnivel esta dado por la
ecuacin
nmero de orbitales = l + 1
e]. En cualquier subnivel l =0
hay {0_+1 = 1 orbital
si l = hay {_+1 = orbitales
6
NUMERO8 CUANTCO8
Un subnivel s esta formado por
un orbital; un subnivel p esta
formado por orbitales; un
subnivel d esta formado por
orbitales
6
NUMERO CUANTCO
MAGNETCO {m
l
_
Cada orbital dentro de un
subnivel se identifica por un
nmero cuantico magntico
orbital m
l
Para cualquier subnivel los valores
de m
l
son.
M
l
= +l, +{l-1_, . 0
6
NUMERO CUANTCO
MAGNETCO
Nmero cuantico magntico de
spin m
s
m
s = +1/ o -1/
66
NUMERO8 CUANTCO8
1.- n da el nivel y la distancia
promedio relativa del electrn
al ncleo
.- l da el subnivel y la forma
del orbital para el electrn
.- m
l
designa la orientacin del
campo magntico originado por
el movimiento del electrn
dentro del orbital
6
NUMERO8 CUANTCO8
mm
s s
especifica la direccin del especifica la direccin del
giro en el espacio que tiene el giro en el espacio que tiene el
electrn sobre su propio e]e. electrn sobre su propio e]e.
68
TEORA ATOMCA
CONCLU8ONE8
El centro del atomo es un punto
denso, pequeo y cargado
positivamente, que consiste
principalmente de protones y
neutrones.
69
TEORA ATOMCA
CONCLU8ONE8
Alrededor del ncleo, giran
particulas muy pequeas
cargadas negativamente,
llamadas electrones, dando
como resultado que la mayor
parte del atomo es un espacio
vacio.
0
TEORA ATOMCA
CONCLU8ONE8
A los electrones de los atomos
slo les esta permitido tener
ciertos valores que estn
definidos por los nmeros
cuantiaos, los cuales indican su
distancia promedio del ncleo,
su direccin y su rotacin.
1
TEORA ATOMCA
CONCLU8ONE8
El principio de incertidumbre de
Heisenberg, establece que no
se puede determinar
simultaneamente la posicin y
el momento de un electrn,
implicando que la posicin del
electrn es aleatoria.
TEORA ATOMCA
CONCLU8ONE8
Aunque la posicin exacta de
un electrn no puede ser
determinada, si su energia es
conocida la teoria predice la
probabilidad de que un electrn
est en un espacio conocido
TEORA ATOMCA
CONCLU8ONE8
La probabilidad de localizar un
electrn tiene la apariencia de
una nube difusa de densidad
variable.
Algunas de las nubes tienen
formas esfricas y otras son de
formas mas comple]as.
TEORA ATOMCA
CONCLU8ONE8
El protn es una particula muy
pequea con carga positiva.
El neutrn es una particula del
mismo tamao que el protn,
pero sin carga
MAGENE8 POR
RE8ONANCA MAGNETCA
NUCLEAR
Los rayos X son radiaciones de
alta energia que pueden causar
dao fisiolgico
La RMN se fundamenta en un
fenmeno descubierto en los
aos 0, llamado resonancia
magntica nuclear
6
RE8ONANCA MAGNETCA
NUCLEAR
8e basa en la observacin, de
que a seme]anza de los
electrones, el ncleo de muchos
elementos tiene un spin
intrinseco al igual que el spin de
los electrones.
El spin nuclear esta cuantizado
al igual que el spin de los
electrones
RE8ONANCA MAGNETCA
NUCLEAR
El ncleo de
1
H { un protn_
tiene nmeros cuanticos de
un spin posible + 1/ - 1/
El ncleo de hidrgeno es el
mas estudiado por RMN
8
RE8ONANCA MAGNETCA
NUCLEAR
Un ncleo de hidrgeno que gira
acta de modo seme]ante a un
iman pequeo
En ausencia de efectos
externos, los dos estados de
spin tienen la misma energia
pero si se colocan en campo
magntico externo
9
RE8ONANCA MAGNETCA
NUCLEAR
se pueden alinear de modo
paralelo u opuesto
{antiparalelo_ al campo,
dependiendo de su spin
La alineacin paralela es de
menor energia que la
antiparalela en una pequea
cantidad E
80
RE8ONANCA MAGNETCA
NUCLEAR
8i los ncleos son irradiados
con fotones con una energia
igual a E, el spin de los
ncleos cambia de la alineacin
paralela a la antiparalela
La deteccin de la desviacin
de los ncleos entre dos
estados de spin origina un
espectro de RMN { 100-00
MHz_
81
PRNCPO DE EXCLU8ON DE
PAUL
8i no hubiera restricciones
sobre los valores posibles para
los nmeros cuanticos todos
podrian acomodarse el el orbital
1s pero el principio de exclusin
de Pauli nos dice que no puede
haber mas de dos electrones en
un orbital.
8
PRNCPO DE EXCLU8ON DE
PAUL
Por tanto los orbitales se llenan
en orden creciente de energia,
con no mas de electrones por
orbital
e]. Litio { electrones_
el orbital 1s tiene electrones
el tercero va al orbital siguiente
de menor energia. El s
8
CONFGURACON
ELECTRONCA
Podemos resumir cualquier
configuracin electrnica
escribiendo el simbolo de la
subcapa ocupada y agregando
un indice que indique el numero
de electrones en esa subcapa.
Por e]. Para litio se escribe
1s
s
1
8
CONFGURACON
ELECTRONCA
Podemos indicar el arreglo de
los electrones en la forma
siguiente:
Li { fig. en pizarrn _
En esta representacin el
llamado diagrama de orbitales
cada orbital se representa por
una ca]a y cada electrn por
una media flecha
8
CONFGURACON
ELECTRONCA
8i la media flecha apunta hacia
arriba representa un electrn
con un numero cuantico de spin
positivo {m
s
=+ 1/ _
si es hacia aba]o representa un
electrn con spin negativo
{m
s
= -1/ _
86
CONFGURACON
ELECTRONCA
8e dice que los electrones que
tienen spines opuestos, se
encuentran apareados cuando
estan en el mismo orbital
un electrn no apareado no esta
acompaado de por su
compaero de spin opuesto
8
CONFGURACON
ELECTRONCA
En el atomo de litio los dos
electrones del orbital 1s estan
apareados y el electrn del
orbital s no esta apareado
88
CONFGURACON
ELECTRONCA
Escritura de configuraciones
electrnicas
Es importante ver como
cambian las configuraciones
electrnicas de los elementos a
medida que nos movemos de un
elemento a otro
89
Regla de Hund
Para los orbitales degenerados
el estado de menor energia se
logra cuando el nmero de
electrones con el mismo spin es
el maximo
e]. carbn 1s
s
p
figura
90
REGLA DE HUND
E]. Ne 10 electrones
1s
s
p
6
En el nen todos los orbitales
con n= estan llenos
La configuracin representada
por los orbitales s y p llenos
con 8 electrones es muy estable
como resultado el nen es poco
reactivo
91
REGLA DE HUND
8odio 11 electrones
8e puede abreviar la
configuracin del sodio en la
forma siguiente:
Na {Ne_ s
1
9
PRNCPO DE EXCLU8ON
DE PAUL
electrones del mismo atomo
no pueden tener los nmeros
cuanticos idnticos
Вам также может понравиться
- Quimica Inorganica DIAPOSITIVASДокумент33 страницыQuimica Inorganica DIAPOSITIVASJuan Contreras BelОценок пока нет
- Antecedentes de La Mecanica CuanticaДокумент6 страницAntecedentes de La Mecanica CuanticableizherОценок пока нет
- 3-Teoría Cuántica-VfinalДокумент48 страниц3-Teoría Cuántica-VfinaljuanixgenoОценок пока нет
- Quim T6 TeoriaДокумент51 страницаQuim T6 TeoriaRamiroОценок пока нет
- Estructura Del ÁtomoДокумент33 страницыEstructura Del ÁtomopabloОценок пока нет
- Teoría Cuántica y La Estructura Electrónica de Los ÁtomosДокумент14 страницTeoría Cuántica y La Estructura Electrónica de Los ÁtomosNayrobi AcostaОценок пока нет
- Apuntes QuímicaДокумент117 страницApuntes QuímicaAndrea Rodríguez OrrequiaОценок пока нет
- Introduccion BohrДокумент11 страницIntroduccion BohrJhonatan AlfaroОценок пока нет
- Apunte QuimicaДокумент62 страницыApunte QuimicacokemaxmaxОценок пока нет
- Modelo Mecano CuanticoДокумент46 страницModelo Mecano CuanticoVíctor Cárcamo Echeverría100% (2)
- Química Estructura de La MateriaДокумент19 страницQuímica Estructura de La MateriaIvan Oliver SanchezОценок пока нет
- Estructura Atómica UNMSMДокумент58 страницEstructura Atómica UNMSMEduardo SalinasОценок пока нет
- Teoria Atomica de BohrДокумент10 страницTeoria Atomica de BohrErick MartínezОценок пока нет
- Espectros atómicos y radiación electromagnéticaДокумент11 страницEspectros atómicos y radiación electromagnéticaRubenОценок пока нет
- Semana 2 - Teoria Cuantica y Estructura Electronica de Los Atomos 1 PDFДокумент88 страницSemana 2 - Teoria Cuantica y Estructura Electronica de Los Atomos 1 PDFJeremy SteinОценок пока нет
- Espectros atómicos y niveles de energíaДокумент30 страницEspectros atómicos y niveles de energíaOrianaPalacioОценок пока нет
- Naturaleza de La Materia FÍSICA ELECTROMAGNETICAДокумент25 страницNaturaleza de La Materia FÍSICA ELECTROMAGNETICACatalina IbacacheОценок пока нет
- 1.4. Teoría Atómica y Teoría CuánticaДокумент6 страниц1.4. Teoría Atómica y Teoría CuánticaHumberto Javier Guirao MartinezОценок пока нет
- Estructura atómica: modelos históricos y teoría cuánticaДокумент7 страницEstructura atómica: modelos históricos y teoría cuánticaVíctor GutiérrezОценок пока нет
- Tema 1Документ10 страницTema 1maria reverteОценок пока нет
- Estructura Atómica TeoriaДокумент44 страницыEstructura Atómica TeoriaFran BrennanОценок пока нет
- Tema 4. Quimica I - 2018Документ28 страницTema 4. Quimica I - 2018Alex TorresОценок пока нет
- Tema 2 AtomisticaДокумент23 страницыTema 2 AtomisticaMerche García SáezОценок пока нет
- Modelo Atomico de BhorДокумент13 страницModelo Atomico de BhorRodolfo Cervantes Amieva ReyesОценок пока нет
- Diapositiva de Modelos AtómicosДокумент28 страницDiapositiva de Modelos AtómicosJhooncitoMachacaОценок пока нет
- Estructura Atomica IbДокумент27 страницEstructura Atomica IbMaría del marОценок пока нет
- Átomo de BohrДокумент6 страницÁtomo de BohrBrandon PaichoОценок пока нет
- Cuestionario Quimica 1nДокумент11 страницCuestionario Quimica 1nJesau BetanzosОценок пока нет
- Tarea de FísicaДокумент3 страницыTarea de FísicaCristina MorenoОценок пока нет
- Base Experimental de La Teoría CuanticaДокумент5 страницBase Experimental de La Teoría CuanticaBrenda Liz Ramos100% (1)
- Cap. 6. Estructura Electrónica Átomos. Química I. UTNДокумент78 страницCap. 6. Estructura Electrónica Átomos. Química I. UTNJavierОценок пока нет
- 23-24 Tema 2. Enlace Químico y Estructura de La MateriaДокумент17 страниц23-24 Tema 2. Enlace Químico y Estructura de La MateriaJacobo Sánchez CasteloОценок пока нет
- Antecedentes Del Modelo Atomico ModernoДокумент49 страницAntecedentes Del Modelo Atomico ModernoAngie LargachaОценок пока нет
- Resumen Estructura Atómica y Tabla PeriódicaДокумент10 страницResumen Estructura Atómica y Tabla PeriódicaAndrea MolinaОценок пока нет
- Teoría Cuántica y La Estructura Electrónica de Los ÁtomosДокумент23 страницыTeoría Cuántica y La Estructura Electrónica de Los ÁtomoscassianohcОценок пока нет
- Modelos atómicos y números cuánticosДокумент63 страницыModelos atómicos y números cuánticosMartin SeljakОценок пока нет
- Modelo Atomico de BohrДокумент33 страницыModelo Atomico de BohrLorena Herrera Hernandez0% (1)
- Lab. Espectros de EmisiónДокумент5 страницLab. Espectros de Emisiónluis alejandro bolivar rodriguezОценок пока нет
- Seminario 01 AtomoДокумент77 страницSeminario 01 AtomoEstefani KarenОценок пока нет
- Estructura de La MateriaДокумент37 страницEstructura de La MateriacarmencitahuecasОценок пока нет
- modelos atomicosДокумент7 страницmodelos atomicosemilio cortez yañezОценок пока нет
- Unidad 1. Teoría Cuántica y Estructura AtómicaДокумент55 страницUnidad 1. Teoría Cuántica y Estructura AtómicaElenaОценок пока нет
- Cuantizacion de La EnergiaДокумент15 страницCuantizacion de La EnergiaverhemenОценок пока нет
- Atomos 2Документ16 страницAtomos 2Fiorella A. Isabella V.Оценок пока нет
- Quimica MateriaДокумент37 страницQuimica MateriaEmily AlejandraОценок пока нет
- Clase Cuantica 2bachДокумент6 страницClase Cuantica 2bachalopez.94Оценок пока нет
- Problemario N 1Документ3 страницыProblemario N 1katiuska dudierОценок пока нет
- El origen de las líneas espectralesДокумент16 страницEl origen de las líneas espectraleskimi VolkovaОценок пока нет
- Dispositivos Electronicos Sesion 1Документ27 страницDispositivos Electronicos Sesion 1Marco Alex BorjaОценок пока нет
- Postulados de BohrДокумент21 страницаPostulados de BohrSonia Garcia Cienfuegos50% (2)
- Modelos AtómicosДокумент9 страницModelos AtómicosJosé María Jiménez MairelesОценок пока нет
- Tippens Fisica 7e Diapositivas 38cДокумент30 страницTippens Fisica 7e Diapositivas 38cjosegyssaОценок пока нет
- Modelo Atómico de La Mecánica Cuántica OndulatoriaДокумент13 страницModelo Atómico de La Mecánica Cuántica OndulatoriaPaúl MartínezОценок пока нет
- Fisica Moderna-Resumen FinalДокумент13 страницFisica Moderna-Resumen FinalNico FernandezОценок пока нет
- Modelo atómico, estructura electrónica y propiedades periódicasДокумент39 страницModelo atómico, estructura electrónica y propiedades periódicasAldo Ortega González0% (2)
- Capitulo 38Документ33 страницыCapitulo 38Luis Luna MoraОценок пока нет
- Tema 1Документ68 страницTema 1Manuel ArufeОценок пока нет
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaОт EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaОценок пока нет
- TURBINAS ElectromecánicasДокумент17 страницTURBINAS ElectromecánicasJuanMaNoriegaОценок пока нет
- Fabricación de semiconductores: Proceso completoДокумент18 страницFabricación de semiconductores: Proceso completoJuanMaNoriega100% (1)
- Historia y Funcionamiento de Un Motor DieselДокумент21 страницаHistoria y Funcionamiento de Un Motor DieselJuanMaNoriegaОценок пока нет
- Clase 2 GasesДокумент39 страницClase 2 GasesJuanMaNoriegaОценок пока нет
- Ingenieria en MexicoДокумент2 страницыIngenieria en MexicoJuanMaNoriegaОценок пока нет
- El Concepto de MamposteríaДокумент11 страницEl Concepto de MamposteríaMaria Emilia CasalsОценок пока нет
- Proyecto Fin de Carrera - Diseño y Fabricación de Ventilador IДокумент143 страницыProyecto Fin de Carrera - Diseño y Fabricación de Ventilador IxabiferrerasОценок пока нет
- Herramienta CBLДокумент7 страницHerramienta CBLAlexander QuispeОценок пока нет
- El Bombeo Mecánico Es Un Procedimiento de Succión y Transferencia Casi Continua Del Petróleo Hasta La SuperficieДокумент16 страницEl Bombeo Mecánico Es Un Procedimiento de Succión y Transferencia Casi Continua Del Petróleo Hasta La SuperficieCeballo JesusОценок пока нет
- Ecuación de Laplace y PoissonДокумент10 страницEcuación de Laplace y PoissonEduardo SincheОценок пока нет
- Engranajes HelicoidalesДокумент6 страницEngranajes HelicoidalesLuisConterasОценок пока нет
- Laboratorio de fotogrametría: Convenciones topográficas en pares estereoscópicosДокумент9 страницLaboratorio de fotogrametría: Convenciones topográficas en pares estereoscópicosmichael stiven ladino bohorquezОценок пока нет
- Balance Metalúrgico 1Документ15 страницBalance Metalúrgico 1CR34T1V1DAD100% (1)
- Cuestionario de Enlace QuimicoДокумент3 страницыCuestionario de Enlace QuimicoErick100% (1)
- Lab14 Tiristores PFR 2017R1Документ8 страницLab14 Tiristores PFR 2017R1Jorge Aguero CuevaОценок пока нет
- Mantenimiento mecánico: tolerancias dimensionales y ajustesДокумент19 страницMantenimiento mecánico: tolerancias dimensionales y ajustesjokafemОценок пока нет
- Revista Ingeniería y Tecnología No. 19Документ68 страницRevista Ingeniería y Tecnología No. 19LleiLleiОценок пока нет
- Fabricación bola plasma 40VДокумент5 страницFabricación bola plasma 40VFreddy Montalvo Agüero0% (1)
- Manual Pce Emf 823 PDFДокумент6 страницManual Pce Emf 823 PDFjuampere2100% (1)
- Compuertas LogicasДокумент7 страницCompuertas LogicasDaniela FernandezОценок пока нет
- Variables de Proceso Tema 1Документ9 страницVariables de Proceso Tema 1elopez20517Оценок пока нет
- Catalogo Nuevo Ford RangerДокумент23 страницыCatalogo Nuevo Ford Rangerjose0% (1)
- Ex Final TEMДокумент3 страницыEx Final TEMExams 1997Оценок пока нет
- Tecnológico Nacional de México - Transferencia de CalorДокумент3 страницыTecnológico Nacional de México - Transferencia de CalorAdrian CastroОценок пока нет
- Inversión de GiroДокумент6 страницInversión de GiroJUAN PABLO VARGASОценок пока нет
- Momento de TorsionДокумент16 страницMomento de TorsionezambranaОценок пока нет
- Ejercicio 28-30Документ8 страницEjercicio 28-30Abel De La Cruz MoranОценок пока нет
- Método Patrón CremaДокумент9 страницMétodo Patrón CremaMaria Carranza CamposОценок пока нет
- Normas Técnicas para E RuralДокумент113 страницNormas Técnicas para E RuralMarkos Rivera100% (1)
- ESTUDIO DE SUELO EN PAD DE LIXIVIACIONДокумент9 страницESTUDIO DE SUELO EN PAD DE LIXIVIACIONLuis EnriqueОценок пока нет
- FERROBUSДокумент22 страницыFERROBUSAlejandro Quinteros CabreraОценок пока нет
- Práctica Calificada 1 RobДокумент4 страницыPráctica Calificada 1 RobLuis GardoОценок пока нет
- Experiment Ode ReynoldsДокумент2 страницыExperiment Ode ReynoldsRonaldo MataОценок пока нет
- Importancia de Los Enlaces QuímicosДокумент2 страницыImportancia de Los Enlaces QuímicosLuIzinn Glez87% (39)
- Nanomateriales de Dimensión CeroДокумент29 страницNanomateriales de Dimensión CeroKatherin Vásquez SalazarОценок пока нет